|
||||

Распространение и основные биологические свойства изолятов Pseudomonas Aeruginosa, выделенных в свиноводческих хозяйствах Краснодарского краяУДК 619:579.8411 Скориков А.В. Федеральное государственное бюджетное образовательное учреждение Введение. Одной из основных особенностей свиноводческих хозяйств региона является промышленная технология ведения отрасли. Концентрация поголовья на ограниченных площадях, интенсивная технологии содержания животных, накопление условно-патогенной микрофлоры, в том числе и синегнойной палочки во внешней среде, которая в условиях стрессового воздействия оказывает значительное патогенное влияние, особенно в ассоциации с другими микроорганизмами на организм поросят, молодняка свиней, а также свиноматок в послеродовом периоде [2, 5, 8]. Синегнойная инфекция кроме эпизоотологического, имеет и эпидемиологическое значение, Pseudomonas aeruginosa вызывает инфекционные осложнения в хирургических, ожоговых и урологических стационарах [6, 14]. У хряков-производителей вследствие инфицирования Pseudomonas aeruginosa происходит снижение активности спермиев и увеличение микробной загрязненности спермы, что приводит к воспалительным процессам половых органов свиноматок и рождению мертворожденных поросят [11]. В подсосный период выращивания, Pseudomonas aeruginosa вызывает остропротекающую инфекцию [4].
Изучение распространенности синегнойной палочки и изучение основных биологических свойств Pseudomonas aeruginosa продолжает оставаться актуальным, несмотря на то обстоятельство, что в 1862 г. A. Lucke описал раневую инфекцию и увязал наличие синегнойного пигмента с содержанием в ранах палочковидных бактерий и культура синегнойной палочки выделена C. Gessard еще в 1882 г, а в 1889 году A. Charrin обосновал патогенность синегнойной палочки для животных [15].
Бактерии Pseudomonas aeruginosa являются широко распространенными микроорганизмами, в качестве источника энергии используют органические природные соединения, в первую очередь углерод и кислород. Pseudomonas aeruginosa сохраняет свои жизнеспособные свойства при ограничении или отсутствии источников питания, а наличие значительного количества факторов вирулентности в огромной степени определяет её патогенные свойства для организма животных [10]. Значительная часть факторов вирулентности связана со специфическим строением клеточной стенки бактерии липополисахарид, пили и жгутики, «непилевые» адгезины, другая часть представлена внеклеточными продуктами жизнедеятельности данного микроорганизма (экзотоксин А, гемолизины, эластазы, пиоцианин, пиовердин), а также феномен уровня кворума (Quorum Sensing) [3,14].
Целью представленной работы является анализ распространения и изучение основных биологических свойств штаммов Pseudomonas aeruginosa, выделенных из диагностического материала в свиноводческих хозяйствах региона.
Материалы и методы исследования. Изучение и анализ эпизоотической ситуации по распространенности заболевания свиней псев-домонозом проводили на основании данных статистической ветеринарной отчетности Департамента ветеринарии Краснодарского края за период с 1990 по 2019 г. в соответствии с методическим указаниям И.А. Бакулова [1], С.Н. Дудникова [7]. Исследования диагностического материала проводили от свиней различных технологических групп, клинически больных, с признаками расстройства желудочнокишечного тракта и патологией репродуктивной системы. Бактериологические исследования проводились в соответствии Методическими рекомендациями по выделению и диагностике псевдомоноза сельскохозяйственных животных и птиц[9] , подвижность микроорганизмов определяли при помощи препаратов «висячая капля» и на ПЖА, ферментативно-биохимические свойства изучали на средах Гисса и с использованием систем индикации микроорганизмов (СИБ) АО НПО «Микроген» в г. Нижний Новгород «ИмБио», тест-систем NEFERM test (фирмы Erba Lachema, Чехия) и OXY test (Р1_1УД LACHEMA, Чехия, активность продуцирования синегнойной палочкой цитохромоксидазы определяли по методикам описанным в определителе бактерий [12]. Серотиповую принадлежность Pseudomonas aeruginosa в реакции агглютинации с типоспецифическими сыворотками ГИСК им Тарасевича и экспериментальной партии агглютинирующих сывороток изготовленных на ФГУП «Армавирская биофабрика». Статистическая обработка результатов проводилась с использованием пакета прикладных программ Microsoft Office Excel 2010.
Результаты исследований и их обсуждение. В нозологической структуре инфекционной патологии свиней за период с 1991 по 2019 год в регионе заболевание псевдомонозом составляло 9,9% и ежегодно регистрировалось в виде энзоотических вспышек. В период с 1991 по 2012 год заболело 28,0 тыс. голов, из которых пало 33,0% животных. Максимальное распространение заболевание отмечалось в 1999 году, зарегистрировано 42 неблагополучных пункта по псевдо-монозу, в которых заболело 2,1 тыс. голов, из них пало 0,5 тыс. животных, заболеваемость и смертность, соответственно, составили 140,1 и 32,5 на 100,0 тыс. голов. Наибольшая тяжесть протекания эпизоотического процесса отмечалась в 1995 году, когда в 19 неблагополучных пунктах заболело 4,8 тыс. голов и пало 1,6 тыс. голов, при этом заболеваемость и смертность составили 272,0 и 92,8 на 100,0 тыс. поголовья в крае. В дальнейшем отмечались спорадические случаи заболевания свиней, вызванного Pseudomonas aeruginosa [1].
В ходе проведения исследований по изучению этиологической роли P. aeruginosa в возникновении инфекционных заболеваний свиней было установлено, что данный возбудитель выделялся в 67% случаев. Всего выделен 571 изолят P. aeruginosa, в том числе из спермы хряков-производителей, из кормов, из абортированных плодов, из смывов из влагалища свиноматок, находившихся в послеродовом периоде, а также из патологического и диагностического материала от павших и клинически больных поросят (табл. 1). Таблица 1 Количество изолятов P.aeruginosa выделенных в свиноводческих хозяйствах
В виде монокультуры P. aeruginosa выделена в 84 случаях (14,7%), в ассоциации с другими микроорганизмами - в 487 случаях (85,2%). Наибольший удельный вес выделенной синегнойной палочки отмечался в ассоциации с E. coli (47,8%), E. faecalis (21,4%), E. facium (8,8%), Proteus spp. (5,7%), K. pneumoniae (5,5%), S. bovis (4,9%), от 0,2 до 2,5% с S. choleraesuis, S. agalactiae, S. suis, S. pneumonia, S. aureus (табл. 2). Таблица 2 Видовой состав бактерий выделенных из диагностического и патологического материала от свиней в ассоциации с P. aeruginosa (n=487)
При изучении морфологических свойств колоний P. aeruginosa отмечено, что плоские неправильной S-формы высевали в 50-73% случаев, округлой гладкой R-формы - в 35% случаев, складчатые колонии - в 17% случаев, карликовых и мукоидных форм выделено не было.
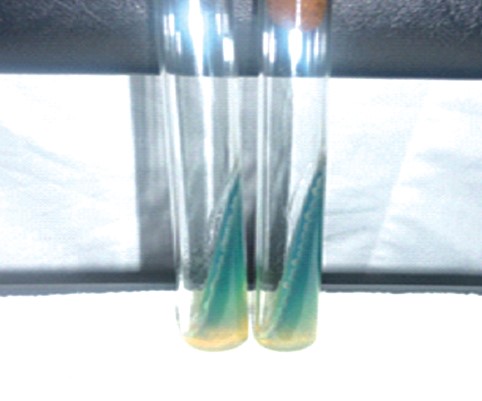
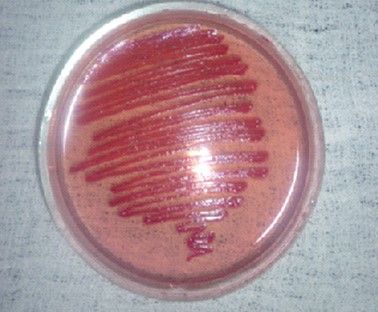
При изучении культуральных, тинкториальных, биохимических свойств P. aeruginosa выделенных 571 изолятов установили, что все изучаемые изоляты синегнойной палочки 100% подвижностью и окрашивались по Грамму отрицательно, обладали термофильными свойствами, 571 изолят давал рост при 42°С с образованием бактерий, при t 4°С рост синегнойной палочки отсутствовал как через 24, так и 48 часов (табл. 3). На селективной питательной среде с W-це-тилперидинием хлорида колонии изолятов в 79,9% случаев росли с образованием водорастворимого пигмента пиоцианина фенотази-нового ряда, при росте на МПБ проба с хлороформам была в 100% случаев положительной, аналогичные результаты были получены при росте колоний на среде Симмонса. У изолятов синегнойной палочки, выращиваемых на МПА, отмечалось окрашивание среды пиоциани-ном (рисунок 1), на МПА с 5% дефибринированной кровью барана в 80-83% случаев отмечался гемолиз. Таблица 3 Морфологические, тинкториальные и культуральные свойства изолятов P. aeruginosa, выделенные из биоматериала и кормов в свиноводческих хозяйствах
Рис. 1. Рост Pseudomonas aeruginosa на МПА
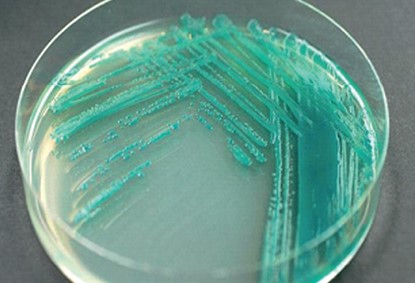
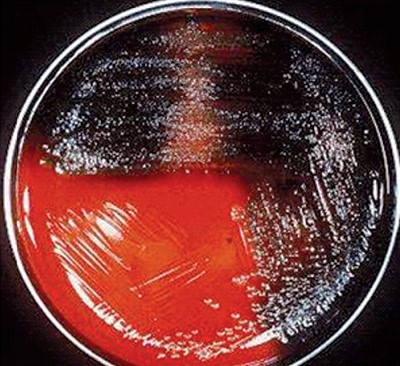
Рис. 2. Рост Pseudomonas aeruginosa на МПБ Усвоение глюкозы через 48 часов культивирования изолятов P. aeruginosa отмечалась в 100% случаев, 100% колоний из изолятов обладали с водой каталазной активностью и осуществляли 100% гидролиз желатина. Все выделенные изоляты давали положительный тест на цитохромоксидазу, в то же время тесты на орнитин и лизин декарбоксилазу были отрицательные, продуцирования изолятами вышеперечисленных ферментов не установлено. При культивировании изоля-тов в МПБ (рисунок 2) через 24 часа пиоцианин продуцировал 45,5% изолятов, полученных из патологического материала, и 63,4% после 48-часового культивирования; у изолятов, полученных из абортплодов эти показатели были, соответственно, в 40 и 50% случаев, из смывов влагалища - 40 и 50%, из спермы хряков - 51 и 60%, из кормов - 40 и 50%. Пигментообразование флюоресцина через 24 ч культивирования находилась в пределах 7-20%, через 48 ч - от 19,5 до 34,0%, пиоцианина в сочетании с флюоресцином соответствовало - 7-10% через 24 ч культивирования и 10-16% после 48 ч культивирования, пигмент пиорубин - 0,4-10% изолятов (рисунок 3, 4, 5). Таблица 4 Биохимические свойства изолятов P.aeruginosa, выделенных из биоматериала и кормов
Биохимическая активность изолятов P. aeruginosa показала, что изучаемые изоляты синегнойной палочки обладают низко выраженными биохимическими свойствами. Изоляты ассимилировали глюкозу и арабинозу, галактозу до образования кислоты, разлагали мочевину, обладали протеолитическими свойствами, разжижали желатин и пептонизировали молоко в течение 72 ч, 51% изолятов, выделенных из патологического материала, и 60% из кормов проявляли фосфатоз-ную активность, не образовывали индол и H2S (табл. 4).
Рис. 3. Рост Pseudomonas aeruginosa на среде ЭНДО
Рис. 4. Окрашивание среды пиацианином в сине-зеленый цвет
Рис. 5. Окрашивание среды пиомеланином в черный и красный цвет Серогрупповую принадлежность отобранных 59 изолятов P. aeruginosa, выделенных из диагностического, патологического материала от свиней и кормов, провели с использованием экспериментальной партии агглютинирующих сывороток, изготовленных ФГУП «Армавирская биофабрика», включающие в наборе 4 поливалентные сыворотки: I (1, 9, 10, 17, 19), II (2, 5, 16, 18, 20), III (3, 12, 13, 14, 15), IV (4, 6, 7, 8, 11) и групповые: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20.
Для серологической типизации были отобраны 59 изолятов P. aeruginosa, выделенных из патологического материала, спермы хряков, смывов из влагалища и кормов, имевших характерный для S-форм колоний рост, округлой выпуклой формы, с неровной поверхностью и неровными краями. К положительному результату РА относили агглютинацию интенсивностью в 3 и 4 креста, сомнительному - 1-2, к отрицательному - отсутствие агглютинации.
Результаты серотипирования показали, что из 59 изолятов агглютинировало с одной сывороткой 36 изолятов (61,0%), одновременно с двумя сыворотками 12 (20,3%), одновременно с тремя сыворотками 4 (6,7%), самоагглютинировано 7 (11,9%). Культуры P. aeruginosa, выделенные из патологического материала от свиней, нами были отнесены к серологическим типам: 01, 03, 04, 05, 06, 09, 010, 011, 013, 014, 016, 018, 019, 020; из спермы - к 08, 09; из абортплодов - к 019, из смывов влагалища - к 03; из кормов - к 03, 013, 014, 016.
Исследования по определению токсигенных свойств экзотоксина А, провели на 25 изолятах P. aeruginosa, отобранных по культурально-морфологическим свойствам, выделенных из патологического материала, абортплодов, смывов из влагалища свиноматок в послеродовом периоде, спермы хряков-производителей, кормов. Учет результатов проводился через 12, 24 и 48 ч после введения фильтрата надосадочной жидкости 4-суточных культур синегнойной палочки, выращенных в бульоне Хоттингера, и вводимых внутрибрюшинно в дозах 0,5 мл и 0,2 мл подкожно белым беспородным мышам живой массой 18-20 г.
При подкожном заражении через 12 ч пало 14,0% лабораторных животных, через 24 ч гибель белых мышей составила 64,0%, через 48 ч пало 14,0%. При внутрибрюшинном заражении гибель лабораторных животных, через 12, 24 и 48 ч составила, соответственно, 12,0%, 74,0% и 8,0%. Всего за 48 ч наблюдений за зараженными лабораторными животными было установлено, что от 92,0 до 94,0% исследуемых культур продуцируют экзотоксин А (табл. 5). Таблица 5 Результаты определения токсигенности изолятов синегнойной палочки
Изучение токсигенных свойств изолятов P. aeruginosa в зависимости от объектов выделения показало, что при подкожном заражении белых мышей (табл. 6) наименьшую токсичность показали изоляты, выделенные из кормов, через 12 ч после введения фильтрата надосадочной жидкости гибели лабораторных животных не отмечалось, и только через 24 и 48 ч после заражения пало, соответственно, 6% и 29%. Наиболее высокую токсичность проявили штаммы, выделенные из патологического материала от свиней, которые вызывали гибель 44% белых мышей через 12 ч и 59% через 24 ч после заражения, изоляты, выделенные из спермы хряков-производителей, вызывали гибель 28% лабораторных животных через 12 ч и 13% через 24 и 48 ч после заражения, что свидетельствует о высокой токсичности данных изолятов. К среднетоксичным относятся изоляты синегнойной палочки, выделенные из абортплодов и смывов из влагалища свиноматок в послеродовой период, они вызывают гибель от 14 до 29% лабораторных животных через 12-48 ч после заражения. Таблица 6 Результаты определения токсигенности изолятов синегнойной палочки выделенных из диагностического и патологического материала в свиноводческих хозяйствах, (n=25)
Из данных таблицы 6 при внутрибрюшинном заражении наибольшую токсигенность через 12 ч после введения фильтрата синегнойной палочки, выделенные из патологического материала 50% и спермы хряков-производителей, среднюю токсигенность проявили штаммы синегнойной палочки выделенные из абортплодов 17% и 11% пало лабораторных животных через 12 и 24 ч после внутрибрюшинного заражения и слаботоксигенные штаммы, вызывавшие гибель 5% лабораторных животных через 48 часов после заражения, нами были выделены из кормов.
Протеолитическая активность изолятов P. aeruginosa, выделенных и отобранных для исследований из патологического материала от павших поросят и молодняка свиней, абортплодов, спермы хряков-производителей, смывов из влагалища свиноматок в послеродовом периоде и кормов, была различна (табл. 7). При изучении протеолитических свойств 571 изолята P. aeruginosa, выделенных из патологического и диагностического материала от животных и кормов, было установлено, что плазмокоагулирующими свойствами обладали 444 (77,8%) изолята, из них у 273 (47,9%) изолятов отмечалась положительная реакция, в то же время 127 (22,2%) изолятов плазмокоакулирующими свойствами не обладали. Лицетиназной и фибринолизгеновой активностью изучаемые изоляты P. aeruginosa не обладали. Таблица 7 Протеолитическая активность изолятов синегнойной палочки выделенные из патологического и диагностического материала в свиноводческих хозяйствах (n=571)
Изоляты синегнойной палочки, выделенные из спермы хряков-производителей, проявляли наибольшую плазмокоагулирующую активность 60% через 4 ч и 100% через 24 ч с начала учета реакции штаммы, выделенные из патологического материала, абортплодов и смывов из влагалища свиноматок, активность плазмокоагуляции проявили на уровне 80%, изоляты, полученные из кормов, - на уровне 60% (табл. 8).
Таблица 8 Плазмокоагулирующая активность изолятов синегнойной палочки выделенных из патологического и диагностического материала (n=25)
Оценка слизеобразования колоний синегнойной палочки на МПА и агаре Хоттингера показала, что после 24 ч культивирования наиболее интенсивное образование слизи проявилось у изолятов синегнойной палочки культивируемых на агаре Хоттингера (85,5%), на МПА образование слизи отмечено у 75% колоний или на 10,1% меньше (табл. 9). Таблица 9 Слизеобразующая способность изолятов синегнойной палочки, n=571
Адгезивная активность изолятов P. aerugunosa, выделенных из кормов, диагностического и патологического материала от свиней, в реакции гемагглютинации представлена в таблице 10. Таблица 10 Определение адгезивных свойств изолятов P. aeruginosa, n=571
Учет специфических адгезивных свойств пилей, называемых Cup-фимбриями (от англ. Chaperone-usher pathway), к эритроцитам кролика через 1, 2, 5 мин при температуре 4 и 20°С показал, что гемагглю-тинационная активность фимбрий проявилась через 1 минуту у 85,6% изолятов синегнойной палочки, через 2 мин у 97,1% изолятов и через 5 мин 100% изолятов проявили адгезивную активность.
Выводы.
Список литературы:
Резюме. Бактерии рода Pseudomonas aeruginosa являются широко распространенными микроорганизмами на свиноводческих предприятиях региона, и из-за факторов вирулентности и патогенных свойств, в этиологическом аспекте представляет значительную угрозу для организма различных половозрастных групп свиней. В виде монокультуры P. aeruginosa выделена в 14,7% случаев, в ассоциации с другими микроорганизмами P. aeruginosa в 85,2% и наибольший удельный вес синегнойной палочки проявился в ассоциации с E.coli 47,8%, E. faecalis 21,4%, E. facium 8,8%, микроорганизмами, вызывающими у поросят в подсосный и отъемный периоды клинику желудочно-кишечных заболеваний. Особенностью эпизоотического проявления псевдомоноза свиней в условия промышленного свиноводства, являются энзоотические вспышки. На селективных питательных средах у колоний изолятов в 79,9 % случаев рост сопровождается образованием водорастворимого пигмента фенотазинового ряда пиоци-анина, на МПА с 5% дефибринированной кровью в 80-83% случаев, колонии синегнойной палочки вызывают зоны гемолиза. Биохимическая активность культур P. aeruginosa показала, низко выраженные биохимические свойства, они ассимилировали глюкозу и арабинозу, галактозу до образования кислоты, разлагали мочевину, обладали протеолитическими свойствами, разжижали желатин и пептонизировали молоко в течение 72 часов, проявляли фосфатозную активность, не образовывали индол и H2S, культуры продуцирующие экзотоксин А, при внутрибрюшинном заражении лабораторных животных максимально проявляют токсигенные свойства. Изоляты синегнойной палочки проявляют плазмокоагулирующую и агезивную активность. Полученные результаты изучения основных биологических свойств изолятов P. aeruginosa, могут быть использованы, при проведении диагностических исследований и проведении противоэпизоотических мероприятий в регионе.
Ключевые слова: синегнойная палочка, изоляты, диагностические исследования, селективные среды, биологические, биохимические, адгезивные, протеолитические, токсигенные, свойства, ассоциации, пигменты, пиоцианин, псев-домоноз, лабораторные животные, свиньи, этиология, желудочно-кишечные заболевания, регион, свиноводческие хозяйства, эпизоотическое проявление, противоэпизоотические мероприятия.
Сведения об авторе: Скориков Александр Владимирович, кандидат биологических наук, заместитель директора по научной работе Краснодарского НИВИ - обособленного структурного подразделения ФГБНУ «Краснодарский научный центр по зоотехнии и ветеринарии»; 350004, г. Краснодар, ул. 1-я линия, 1; тел.: 8-861-2216220; e-mail: knivi@list.ru - ответственный за переписку с редакцией.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|