УДК 619:579.8411
DOI 10.33861/2071-8020-2020-6-17-22
Скориков А.В. Федеральное государственное бюджетное образовательное учреждение
высшего образования «Краснодарский научный центр по зоотехнии и ветеринарии», г. Краснодар
Введение. Одной из основных особенностей свиноводческих хозяйств региона является промышленная технология ведения отрасли. Концентрация поголовья на ограниченных площадях, интенсивная технологии содержания животных, накопление условно-патогенной микрофлоры, в том числе и синегнойной палочки во внешней среде, которая в условиях стрессового воздействия оказывает значительное патогенное влияние, особенно в ассоциации с другими микроорганизмами на организм поросят, молодняка свиней, а также свиноматок в послеродовом периоде [2, 5, 8]. Синегнойная инфекция кроме эпизоотологического, имеет и эпидемиологическое значение, Pseudomonas aeruginosa вызывает инфекционные осложнения в хирургических, ожоговых и урологических стационарах [6, 14]. У хряков-производителей вследствие инфицирования Pseudomonas aeruginosa происходит снижение активности спермиев и увеличение микробной загрязненности спермы, что приводит к воспалительным процессам половых органов свиноматок и рождению мертворожденных поросят [11]. В подсосный период выращивания, Pseudomonas aeruginosa вызывает остропротекающую инфекцию [4].
Изучение распространенности синегнойной палочки и изучение основных биологических свойств Pseudomonas aeruginosa продолжает оставаться актуальным, несмотря на то обстоятельство, что в 1862 г. A. Lucke описал раневую инфекцию и увязал наличие синегнойного пигмента с содержанием в ранах палочковидных бактерий и культура синегнойной палочки выделена C. Gessard еще в 1882 г, а в 1889 году A. Charrin обосновал патогенность синегнойной палочки для животных [15].
Бактерии Pseudomonas aeruginosa являются широко распространенными микроорганизмами, в качестве источника энергии используют органические природные соединения, в первую очередь углерод и кислород. Pseudomonas aeruginosa сохраняет свои жизнеспособные свойства при ограничении или отсутствии источников питания, а наличие значительного количества факторов вирулентности в огромной степени определяет её патогенные свойства для организма животных [10]. Значительная часть факторов вирулентности связана со специфическим строением клеточной стенки бактерии липополисахарид, пили и жгутики, «непилевые» адгезины, другая часть представлена внеклеточными продуктами жизнедеятельности данного микроорганизма (экзотоксин А, гемолизины, эластазы, пиоцианин, пиовердин), а также феномен уровня кворума (Quorum Sensing) [3,14].
Целью представленной работы является анализ распространения и изучение основных биологических свойств штаммов Pseudomonas aeruginosa, выделенных из диагностического материала в свиноводческих хозяйствах региона.
Материалы и методы исследования. Изучение и анализ эпизоотической ситуации по распространенности заболевания свиней псев-домонозом проводили на основании данных статистической ветеринарной отчетности Департамента ветеринарии Краснодарского края за период с 1990 по 2019 г. в соответствии с методическим указаниям И.А. Бакулова [1], С.Н. Дудникова [7]. Исследования диагностического материала проводили от свиней различных технологических групп, клинически больных, с признаками расстройства желудочнокишечного тракта и патологией репродуктивной системы. Бактериологические исследования проводились в соответствии Методическими рекомендациями по выделению и диагностике псевдомоноза сельскохозяйственных животных и птиц[9] , подвижность микроорганизмов определяли при помощи препаратов «висячая капля» и на ПЖА, ферментативно-биохимические свойства изучали на средах Гисса и с использованием систем индикации микроорганизмов (СИБ) АО НПО «Микроген» в г. Нижний Новгород «ИмБио», тест-систем NEFERM test (фирмы Erba Lachema, Чехия) и OXY test (Р1_1УД LACHEMA, Чехия, активность продуцирования синегнойной палочкой цитохромоксидазы определяли по методикам описанным в определителе бактерий [12]. Серотиповую принадлежность Pseudomonas aeruginosa в реакции агглютинации с типоспецифическими сыворотками ГИСК им Тарасевича и экспериментальной партии агглютинирующих сывороток изготовленных на ФГУП «Армавирская биофабрика». Статистическая обработка результатов проводилась с использованием пакета прикладных программ Microsoft Office Excel 2010.
Результаты исследований и их обсуждение. В нозологической структуре инфекционной патологии свиней за период с 1991 по 2019 год в регионе заболевание псевдомонозом составляло 9,9% и ежегодно регистрировалось в виде энзоотических вспышек. В период с 1991 по 2012 год заболело 28,0 тыс. голов, из которых пало 33,0% животных. Максимальное распространение заболевание отмечалось в 1999 году, зарегистрировано 42 неблагополучных пункта по псевдо-монозу, в которых заболело 2,1 тыс. голов, из них пало 0,5 тыс. животных, заболеваемость и смертность, соответственно, составили 140,1 и 32,5 на 100,0 тыс. голов. Наибольшая тяжесть протекания эпизоотического процесса отмечалась в 1995 году, когда в 19 неблагополучных пунктах заболело 4,8 тыс. голов и пало 1,6 тыс. голов, при этом заболеваемость и смертность составили 272,0 и 92,8 на 100,0 тыс. поголовья в крае. В дальнейшем отмечались спорадические случаи заболевания свиней, вызванного Pseudomonas aeruginosa [1].
В ходе проведения исследований по изучению этиологической роли P. aeruginosa в возникновении инфекционных заболеваний свиней было установлено, что данный возбудитель выделялся в 67% случаев. Всего выделен 571 изолят P. aeruginosa, в том числе из спермы хряков-производителей, из кормов, из абортированных плодов, из смывов из влагалища свиноматок, находившихся в послеродовом периоде, а также из патологического и диагностического материала от павших и клинически больных поросят (табл. 1).
Таблица 1 Количество изолятов P.aeruginosa выделенных в свиноводческих хозяйствах
| № п/п | Объекты выделений | Количество культур | % |
|---|---|---|---|
| 1. | Сперма хряков- производителей | 15 | 2,6 |
| 2. | Корма | 10 | 1,8 |
| 3. | Абортплоды | 6 | 1,1 |
| 4. | Смывы из влагалища свиноматок | 6 | 1,1 |
| 5. | Патологический материал | 534 | 93,5 |
| Итого | 571 | 100 | |
В виде монокультуры P. aeruginosa выделена в 84 случаях (14,7%), в ассоциации с другими микроорганизмами - в 487 случаях (85,2%). Наибольший удельный вес выделенной синегнойной палочки отмечался в ассоциации с E. coli (47,8%), E. faecalis (21,4%), E. facium (8,8%), Proteus spp. (5,7%), K. pneumoniae (5,5%), S. bovis (4,9%), от 0,2 до 2,5% с S. choleraesuis, S. agalactiae, S. suis, S. pneumonia, S. aureus (табл. 2).
Таблица 2 Видовой состав бактерий выделенных из диагностического и патологического материала от свиней в ассоциации с P. aeruginosa (n=487)
| № п/п | Вид бактерий | Количество изолятов | |
|---|---|---|---|
| Абсолютное | в % | ||
| 1. | Escherichia coli | 233 | 47,8 |
| 2. | Klebsiella pneumoniae | 27 | 5,5 |
| 3. | Streptococcus bovis | 24 | 4,9 |
| 4. | Streptococcus pneumoniae | 12 | 2,5 |
| 5. | Streptococcus suis | 6 | 1,2 |
| 6. | Streptococcus agalactiae | 5 | 1,0 |
| 7. | Escherichia faeclis | 104 | 21,4 |
| 8. | Escherichia facium | 43 | 8,8 |
| 9. | Staphylococcus aureus | 7 | 1,4 |
| 10. | Proteus spp. | 25 | 5,7 |
| 11. | Salmonella choleraesuis | 1 | 0,2 |
При изучении морфологических свойств колоний P. aeruginosa отмечено, что плоские неправильной S-формы высевали в 50-73% случаев, округлой гладкой R-формы - в 35% случаев, складчатые колонии - в 17% случаев, карликовых и мукоидных форм выделено не было.
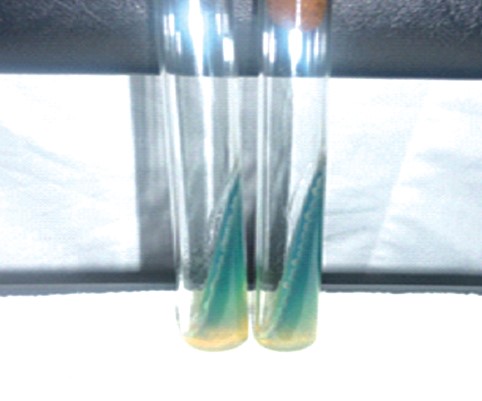
При изучении культуральных, тинкториальных, биохимических свойств P. aeruginosa выделенных 571 изолятов установили, что все изучаемые изоляты синегнойной палочки 100% подвижностью и окрашивались по Грамму отрицательно, обладали термофильными свойствами, 571 изолят давал рост при 42°С с образованием бактерий, при t 4°С рост синегнойной палочки отсутствовал как через 24, так и 48 часов (табл. 3). На селективной питательной среде с W-це-тилперидинием хлорида колонии изолятов в 79,9% случаев росли с образованием водорастворимого пигмента пиоцианина фенотази-нового ряда, при росте на МПБ проба с хлороформам была в 100% случаев положительной, аналогичные результаты были получены при росте колоний на среде Симмонса. У изолятов синегнойной палочки, выращиваемых на МПА, отмечалось окрашивание среды пиоциани-ном (рисунок 1), на МПА с 5% дефибринированной кровью барана в 80-83% случаев отмечался гемолиз.
Таблица 3 Морфологические, тинкториальные и культуральные свойства изолятов P. aeruginosa, выделенные из биоматериала и кормов в свиноводческих хозяйствах
| № п/п | Изучаемые показатели и тесты | Патологический материал n=534, % | Абортплоды n=6, % | Смывы из влагалища n=6, % | Сперма хряков n = 15,% | Корма n = 10, % | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. | Подвижность в висячей капле | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 2. | Окраска по Граму | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 3. | Рост при t 42°С | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 4. | Рост при t 4°С | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 5. | Рост в МПБ через 24 ч, пленка | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 6. | Рост в МПБ через 48 ч, пленка | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 7. | Рост на селективной среде (ЦПХ), С N-цетилперидинием хлорида | 427 | 79,4 | 5 | 80 | 5 | 80 | 12 | 80 | 8 | 80 |
| 8. | Рост на агаре Симмонса | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 9. | Гемолиз на МПА с 5% дефибринированной крови | 443 | 83 | 5 | 81 | 5 | 82 | 12 | 80 | 8 | 80 |
| 10. | Редукция глюкозы через 48 ч: в анаэробных условиях в аэробных условиях |
0 534 |
0 100 |
0 6 |
0 100 |
0 6 |
0 100 |
0 15 |
0 100 |
0 10 |
0 100 |
| 11. | Каталаза | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 12. | Гидролиз желатина | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 13. | Хлороформ тест | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 14. | Наличие: |
|
|
|
|
| |||||
| цитохромоксидаза | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 | |
| аргининдигидролаза | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 | |
| орнитин-декарбоксилаза | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| лизин-декарбоксилаза | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 15. | Продуцирование пигментов: |
|
|
|
|
|
|
|
|
|
|
| пиоцианина: |
|
|
|
|
|
|
|
|
|
| |
| через 24 ч | 243 | 45,5 | 2 | 40,0 | 2 | 40,0 | 8 | 51,0 | 4 | 40,0 | |
| через 48 ч | 339 | 63,4 | 3 | 50,0 | 3 | 50,0 | 9 | 60,0 | 5 | 50,0 | |
| флюоресцина: |
|
|
|
|
|
|
|
|
|
| |
| через 24 ч | 37 | 7,0 | 1 | 16,0 | 1 | 15,0 | 3 | 20,0 | 2 | 20,0 | |
| через 48 ч | 104 | 19,5 | 2 | 34,0 | 2 | 34,0 | 4 | 27,0 | 3 | 30,0 | |
| пиоцианин и флюоресцин: |
|
|
|
|
|
|
|
|
|
| |
| через 24 ч | 37 | 7,0 | 1 | 10,0 | 1 | 10,0 | 1 | 7,0 | 1 | 10,0 | |
| через 48 ч | 65 | 12,1 | 1 | 16,0 | 1 | 16,0 | 2 | 14,0 | 1 | 10,0 | |
| пиорубина: |
|
|
|
|
|
|
|
|
|
| |
| через 24 ч | 2 | 0,4 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 10,0 | |
| через 48 ч | 10 | 1,8 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 10,0 | |
| Отсутствие пигментообразования | 16 | 3,0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |

Рис. 1. Рост Pseudomonas aeruginosa на МПА

Рис. 2. Рост Pseudomonas aeruginosa на МПБ
Усвоение глюкозы через 48 часов культивирования изолятов P. aeruginosa отмечалась в 100% случаев, 100% колоний из изолятов обладали с водой каталазной активностью и осуществляли 100% гидролиз желатина. Все выделенные изоляты давали положительный тест на цитохромоксидазу, в то же время тесты на орнитин и лизин декарбоксилазу были отрицательные, продуцирования изолятами вышеперечисленных ферментов не установлено. При культивировании изоля-тов в МПБ (рисунок 2) через 24 часа пиоцианин продуцировал 45,5% изолятов, полученных из патологического материала, и 63,4% после 48-часового культивирования; у изолятов, полученных из абортплодов эти показатели были, соответственно, в 40 и 50% случаев, из смывов влагалища - 40 и 50%, из спермы хряков - 51 и 60%, из кормов - 40 и 50%. Пигментообразование флюоресцина через 24 ч культивирования находилась в пределах 7-20%, через 48 ч - от 19,5 до 34,0%, пиоцианина в сочетании с флюоресцином соответствовало - 7-10% через 24 ч культивирования и 10-16% после 48 ч культивирования, пигмент пиорубин - 0,4-10% изолятов (рисунок 3, 4, 5).
Таблица 4 Биохимические свойства изолятов P.aeruginosa, выделенных из биоматериала и кормов
| № п/п | Наименование теста | Патологический материал n=534, % | Аборт- плоды n=6, % | Смывы из влагалища свиноматок n=6, % | Сперма хряков n=15, % | Корма n=10, % | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. | Глюкоза | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 2. | Лактоза | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 3. | Сахароза | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 4. | Манит | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 5. | Арабиноза | 272 | 51 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 40 |
| 6. | Фруктоза | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 7. | Инозит | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 8. | Фосфатаза | 270 | 51 | 0 | 0 | 0 | 0 | 0 | 0 | 6 | 60 |
| 9. | Ксилоза | 514 | 96 | 5 | 83 | 5 | 83 | 13 | 87 | 9 | 90 |
| 10. | Целло-биоза | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 11. | Галактоза | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 12. | Эскулин | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 13. | Трегилоза | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 14. | Индол | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 15. | Сероводород | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 16. | Мальтоза | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 17. | Мочевина | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 18. | Пептонизация молока | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
| 19. | Желатин | 534 | 100 | 6 | 100 | 6 | 100 | 15 | 100 | 10 | 100 |
Биохимическая активность изолятов P. aeruginosa показала, что изучаемые изоляты синегнойной палочки обладают низко выраженными биохимическими свойствами. Изоляты ассимилировали глюкозу и арабинозу, галактозу до образования кислоты, разлагали мочевину, обладали протеолитическими свойствами, разжижали желатин и пептонизировали молоко в течение 72 ч, 51% изолятов, выделенных из патологического материала, и 60% из кормов проявляли фосфатоз-ную активность, не образовывали индол и H2S (табл. 4).
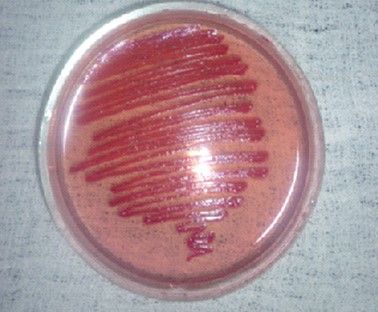
Рис. 3. Рост Pseudomonas aeruginosa на среде ЭНДО
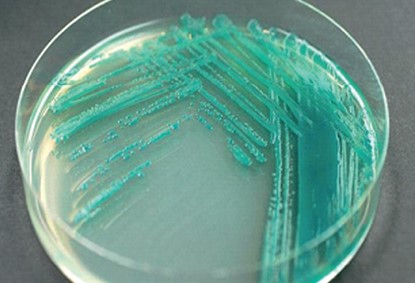
Рис. 4. Окрашивание среды пиацианином в сине-зеленый цвет
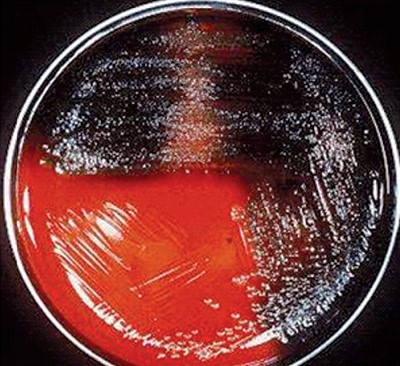
Рис. 5. Окрашивание среды пиомеланином в черный и красный цвет
Серогрупповую принадлежность отобранных 59 изолятов P. aeruginosa, выделенных из диагностического, патологического материала от свиней и кормов, провели с использованием экспериментальной партии агглютинирующих сывороток, изготовленных ФГУП «Армавирская биофабрика», включающие в наборе 4 поливалентные сыворотки: I (1, 9, 10, 17, 19), II (2, 5, 16, 18, 20), III (3, 12, 13, 14, 15), IV (4, 6, 7, 8, 11) и групповые: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20.
Для серологической типизации были отобраны 59 изолятов P. aeruginosa, выделенных из патологического материала, спермы хряков, смывов из влагалища и кормов, имевших характерный для S-форм колоний рост, округлой выпуклой формы, с неровной поверхностью и неровными краями. К положительному результату РА относили агглютинацию интенсивностью в 3 и 4 креста, сомнительному - 1-2, к отрицательному - отсутствие агглютинации.
Результаты серотипирования показали, что из 59 изолятов агглютинировало с одной сывороткой 36 изолятов (61,0%), одновременно с двумя сыворотками 12 (20,3%), одновременно с тремя сыворотками 4 (6,7%), самоагглютинировано 7 (11,9%). Культуры P. aeruginosa, выделенные из патологического материала от свиней, нами были отнесены к серологическим типам: 01, 03, 04, 05, 06, 09, 010, 011, 013, 014, 016, 018, 019, 020; из спермы - к 08, 09; из абортплодов - к 019, из смывов влагалища - к 03; из кормов - к 03, 013, 014, 016.
Исследования по определению токсигенных свойств экзотоксина А, провели на 25 изолятах P. aeruginosa, отобранных по культурально-морфологическим свойствам, выделенных из патологического материала, абортплодов, смывов из влагалища свиноматок в послеродовом периоде, спермы хряков-производителей, кормов. Учет результатов проводился через 12, 24 и 48 ч после введения фильтрата надосадочной жидкости 4-суточных культур синегнойной палочки, выращенных в бульоне Хоттингера, и вводимых внутрибрюшинно в дозах 0,5 мл и 0,2 мл подкожно белым беспородным мышам живой массой 18-20 г.
При подкожном заражении через 12 ч пало 14,0% лабораторных животных, через 24 ч гибель белых мышей составила 64,0%, через 48 ч пало 14,0%. При внутрибрюшинном заражении гибель лабораторных животных, через 12, 24 и 48 ч составила, соответственно, 12,0%, 74,0% и 8,0%. Всего за 48 ч наблюдений за зараженными лабораторными животными было установлено, что от 92,0 до 94,0% исследуемых культур продуцируют экзотоксин А (табл. 5).
Таблица 5 Результаты определения токсигенности изолятов синегнойной палочки
| № п/п | Место введения | Количество павших белых мышей, гол (%) | Количество живых белых мышей, гол (%) | ||
|---|---|---|---|---|---|
| через 12 ч | через 24 ч | через 48 ч | через 48 ч. | ||
| 1. | Подкожное введение, n=50 | 7(14%) | 32(64%) | 7(14%) | 4(8%) |
| 2. | Внутрибрюшинное введение, n=50 | 6(12%) | 37(74%) | 4(8%) | 3(6%) |
Изучение токсигенных свойств изолятов P. aeruginosa в зависимости от объектов выделения показало, что при подкожном заражении белых мышей (табл. 6) наименьшую токсичность показали изоляты, выделенные из кормов, через 12 ч после введения фильтрата надосадочной жидкости гибели лабораторных животных не отмечалось, и только через 24 и 48 ч после заражения пало, соответственно, 6% и 29%. Наиболее высокую токсичность проявили штаммы, выделенные из патологического материала от свиней, которые вызывали гибель 44% белых мышей через 12 ч и 59% через 24 ч после заражения, изоляты, выделенные из спермы хряков-производителей, вызывали гибель 28% лабораторных животных через 12 ч и 13% через 24 и 48 ч после заражения, что свидетельствует о высокой токсичности данных изолятов. К среднетоксичным относятся изоляты синегнойной палочки, выделенные из абортплодов и смывов из влагалища свиноматок в послеродовой период, они вызывают гибель от 14 до 29% лабораторных животных через 12-48 ч после заражения.
Таблица 6 Результаты определения токсигенности изолятов синегнойной палочки выделенных из диагностического и патологического материала в свиноводческих хозяйствах, (n=25)
| № п/п | Предмет выделения | Количество павших белых мышей в зависимости от способа заражения | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| подкожное | внутрибрюшинное | ||||||||||||
| 12 часов | 24 часа | 48 часов | 12 часов | 24 часа | 48 часов | ||||||||
| n | % | n | % | n | % | n | % | n | % | n | % | ||
| 1. | Патологический материла | 3 | 44 | 19 | 59 | 0 | 0 | 3 | 50 | 21 | 58 | 0 | 0 |
| 2. | Аборт-плоды | 1 | 14 | 4 | 13 | 2 | 29 | 1 | 17 | 4 | 11 | 0 | 0 |
| 3. | Смывы из влагалища свиноматок | 1 | 14 | 3 | 9 | 2 | 29 | 0 | 0 | 4 | 11 | 0 | 0 |
| 4. | Сперма хряков- производителей | 2 | 28 | 4 | 13 | 1 | 13 | 2 | 33 | 6 | 15 | 1 | 25 |
| 5. | Корма | 0 | 0 | 2 | 6 | 2 | 29 | 0 | 0 | 2 | 5 | 3 | 75 |
| Итого (n=93) | 7 | 100 | 32 | 100 | 7 | 100 | 6 | 100 | 37 | 100 | 4 | 100 | |
Из данных таблицы 6 при внутрибрюшинном заражении наибольшую токсигенность через 12 ч после введения фильтрата синегнойной палочки, выделенные из патологического материала 50% и спермы хряков-производителей, среднюю токсигенность проявили штаммы синегнойной палочки выделенные из абортплодов 17% и 11% пало лабораторных животных через 12 и 24 ч после внутрибрюшинного заражения и слаботоксигенные штаммы, вызывавшие гибель 5% лабораторных животных через 48 часов после заражения, нами были выделены из кормов.
Протеолитическая активность изолятов P. aeruginosa, выделенных и отобранных для исследований из патологического материала от павших поросят и молодняка свиней, абортплодов, спермы хряков-производителей, смывов из влагалища свиноматок в послеродовом периоде и кормов, была различна (табл. 7). При изучении протеолитических свойств 571 изолята P. aeruginosa, выделенных из патологического и диагностического материала от животных и кормов, было установлено, что плазмокоагулирующими свойствами обладали 444 (77,8%) изолята, из них у 273 (47,9%) изолятов отмечалась положительная реакция, в то же время 127 (22,2%) изолятов плазмокоакулирующими свойствами не обладали. Лицетиназной и фибринолизгеновой активностью изучаемые изоляты P. aeruginosa не обладали.
Таблица 7 Протеолитическая активность изолятов синегнойной палочки выделенные из патологического и диагностического материала в свиноводческих хозяйствах (n=571)
| № п/п | Патологическая активность | Результаты определения | |||
|---|---|---|---|---|---|
| Количество положительных | Количество отрицательных | ||||
| n | % | n | % | ||
| 1. | Плазмокоагуляционная через 30 мин | 0 | 0 | 571 | 0 |
| через 1 ч | 0 | 0 | 571 | 0 | |
| через 2 ч | 0 | 0 | 571 | 0 | |
| через 4 ч | 273 | 47,9 | 298 | 52,1 | |
| через 24 ч | 444 | 77,8 | 127 | 22,2 | |
| 2. | Лецитиназная | 0 | 0 | 350 | 0 |
| 3. | Фибринолизгеновая | 0 | 0 | 350 | 0 |
Изоляты синегнойной палочки, выделенные из спермы хряков-производителей, проявляли наибольшую плазмокоагулирующую активность 60% через 4 ч и 100% через 24 ч с начала учета реакции штаммы, выделенные из патологического материала, абортплодов и смывов из влагалища свиноматок, активность плазмокоагуляции проявили на уровне 80%, изоляты, полученные из кормов, - на уровне 60% (табл. 8).
Таблица 8 Плазмокоагулирующая активность изолятов синегнойной палочки выделенных из патологического и диагностического материала (n=25)
| № п/п | Материал выделенных изолятов | Результаты учета плазмокоагулирующей активности, через | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 30 минут | 1 час | 2 часа | 4 часа | 24 часа | |||||||
| n | % | n | % | n | % | n | % | n | % | ||
| 1. | Патологический материал | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 60 | 4 | 80 |
| 2. | Абортплоды | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 40 | 4 | 80 |
| 3. | Смывы из влагалища свиноматок | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 60 | 4 | 80 |
| 4. | Сперма хряков- производителей | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 60 | 5 | 100 |
| 5. | Корма | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 40 | 3 | 40 |
Оценка слизеобразования колоний синегнойной палочки на МПА и агаре Хоттингера показала, что после 24 ч культивирования наиболее интенсивное образование слизи проявилось у изолятов синегнойной палочки культивируемых на агаре Хоттингера (85,5%), на МПА образование слизи отмечено у 75% колоний или на 10,1% меньше (табл. 9).
Таблица 9 Слизеобразующая способность изолятов синегнойной палочки, n=571
| № п/п | Наименование среды | Результаты изучения | |||
|---|---|---|---|---|---|
| n | % | n | % | ||
| 1. | Агар Хоттингера | 488 | 85.5 | 83 | 14,5 |
| 2. | Мясопептонный агар | 431 | 75,4 | 140 | 26,4 |
Адгезивная активность изолятов P. aerugunosa, выделенных из кормов, диагностического и патологического материала от свиней, в реакции гемагглютинации представлена в таблице 10.
Таблица 10 Определение адгезивных свойств изолятов P. aeruginosa, n=571
| № п/ п | Время учета активности фимбий | Результаты изучения | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| + | ++ | +++ | Итого | ||||||||
| положит. | отрицат. | ||||||||||
| n | % | n | % | n | % | n | % | n | % | ||
| 1. | 1/ 40С | 103 | 18,0 | 71 | 12,5 | 315 | 55,2 | 489 | 85,6 | 82 | 14,4 |
| 2. | 1 200С | 159 | 27,8 | 56 | 9,8 | 279 | 480 | 489 | 85,6 | 82 | 14,4 |
| 3. | 2/ 40С | 65 | 11,4 | 126 | 22,1 | 364 | 63,8 | 555 | 47,1 | 16 | 2,9 |
| 4. | 2/ 200С | 96 | 16,9 | 134 | 23,5 | 325 | 56,9 | 555 | 97,1 | 16 | 2,9 |
| 5. | 5/ 40С | 0 | 0 | 0 | 0 | 571 | 100 | 571 | 100 | 0 | 0 |
| 6. | 5/ 200С | 0 | 0 | 9 | 1,5 | 562 | 98,4 | 562 | 100 | 0 | 0 |
Учет специфических адгезивных свойств пилей, называемых Cup-фимбриями (от англ. Chaperone-usher pathway), к эритроцитам кролика через 1, 2, 5 мин при температуре 4 и 20°С показал, что гемагглю-тинационная активность фимбрий проявилась через 1 минуту у 85,6% изолятов синегнойной палочки, через 2 мин у 97,1% изолятов и через 5 мин 100% изолятов проявили адгезивную активность.
Выводы.
Список литературы:
Резюме. Бактерии рода Pseudomonas aeruginosa являются широко распространенными микроорганизмами на свиноводческих предприятиях региона, и из-за факторов вирулентности и патогенных свойств, в этиологическом аспекте представляет значительную угрозу для организма различных половозрастных групп свиней. В виде монокультуры P. aeruginosa выделена в 14,7% случаев, в ассоциации с другими микроорганизмами P. aeruginosa в 85,2% и наибольший удельный вес синегнойной палочки проявился в ассоциации с E.coli 47,8%, E. faecalis 21,4%, E. facium 8,8%, микроорганизмами, вызывающими у поросят в подсосный и отъемный периоды клинику желудочно-кишечных заболеваний. Особенностью эпизоотического проявления псевдомоноза свиней в условия промышленного свиноводства, являются энзоотические вспышки. На селективных питательных средах у колоний изолятов в 79,9 % случаев рост сопровождается образованием водорастворимого пигмента фенотазинового ряда пиоци-анина, на МПА с 5% дефибринированной кровью в 80-83% случаев, колонии синегнойной палочки вызывают зоны гемолиза. Биохимическая активность культур P. aeruginosa показала, низко выраженные биохимические свойства, они ассимилировали глюкозу и арабинозу, галактозу до образования кислоты, разлагали мочевину, обладали протеолитическими свойствами, разжижали желатин и пептонизировали молоко в течение 72 часов, проявляли фосфатозную активность, не образовывали индол и H2S, культуры продуцирующие экзотоксин А, при внутрибрюшинном заражении лабораторных животных максимально проявляют токсигенные свойства. Изоляты синегнойной палочки проявляют плазмокоагулирующую и агезивную активность. Полученные результаты изучения основных биологических свойств изолятов P. aeruginosa, могут быть использованы, при проведении диагностических исследований и проведении противоэпизоотических мероприятий в регионе.
Ключевые слова: синегнойная палочка, изоляты, диагностические исследования, селективные среды, биологические, биохимические, адгезивные, протеолитические, токсигенные, свойства, ассоциации, пигменты, пиоцианин, псев-домоноз, лабораторные животные, свиньи, этиология, желудочно-кишечные заболевания, регион, свиноводческие хозяйства, эпизоотическое проявление, противоэпизоотические мероприятия.
Сведения об авторе: Скориков Александр Владимирович, кандидат биологических наук, заместитель директора по научной работе Краснодарского НИВИ - обособленного структурного подразделения ФГБНУ «Краснодарский научный центр по зоотехнии и ветеринарии»; 350004, г. Краснодар, ул. 1-я линия, 1; тел.: 8-861-2216220; e-mail: knivi@list.ru - ответственный за переписку с редакцией.
http://vetkuban.com/num6_202006.html