|
||||

Влияние антибиотикотерапии на имунно-физиологический статус рыбУДК 619:616.15:639.2.09:615.33 Романова Н. Н., Сехина О. В., Вишторская А. А. Филиал по пресноводному рыбному хозяйству Федерального государственного Объемы воспроизводства ценных видов рыб и производства продукции товарной аквакультуры в России в последние годы резко выросли [12]. Интенсификация технологических процессов неизбежно приводит к возникновению напряженной эпизоотической ситуации на рыбоводных предприятиях. Высокие плотности посадки, хендлинг, несоответствующее качество воды снижают иммуно-физиологический статус рыб, и на фоне ослабления иммунной системы рыбы часто болеют и в основном бактериальными инфекциями, которые развиваются при контаминации органов бактериальной микрофлорой, которая находится в воде. Если вовремя не провести лечение, то могут быть большие потери рыбопосадочного материала и рыбной продукции. При развитии бактериальных инфекций у рыб применение антибактериальных препаратов позволяет приостановить развивающийся патологический процесс и вспышку заболевания. С другой стороны, частое применение антибиотиков формирует у бактерий резистентность (устойчивость), что в дальнейшим приводит к тому, что они становятся неэффективными для лечения [5]. В связи с этим поиск новых эффективных антибиотиков для использования в животноводстве, в том числе в аквакультуре, является актуальным направлением ветеринарии. Другой сложностью разработки терапии является то, что бактериальные инфекции у рыб чаще всего вызывают разные виды бактерий и, в связи с этим, возникает сложность подбора эффективного антибиотика для лечения, который бы действовал на весь спектр возбудителей. В последние годы в медицине и ветеринарии для лечения бактериозов используют комбинированный метод, заключающий в применении двух разных антибиотиков одновременно. Это направление начинают поддерживать и практики-рыбоводы для разработки эффективных схем лечения бактериальных инфекций рыб. С другой стороны, антибиотикотерапия является дополнительным стресс-фактором на организм рыб, снижающим общую резистентность и может привести к нежелательным побочным эффектам. Для осуществления рационального применения антибиотиков необходимы сведения о возможном влиянии на рыб применяемых лекарственных препаратов. Информации по этому вопросу очень мало, в основном изучали токсичность антибиотиков на организм теплокровных животных [7, 8]. В основе воздействия антибиотиков лежит подавление и уничтожение не только патогенной, но и полезной микрофлоры, что приводит к дисбактериозу и снижению иммунитета. Оценка действия антибиотиков на организм рыб и выявление изменений в крови является достаточно информационной. Кровь является лабильной тканью, ее количественные показатели чувствительны к изменениям, происходящим в организме, и отражают его ответную реакцию. Цель исследования - оценить влияние антибиотикотерапии на иммуно-физиологический статус рыб. Материалы и методы исследований. Экспериментальные работы проводили на годовиках карпа (ср. масса 30 г) и гибридах сибирского осетра х калуги (далее, СО х К) («29,7 г). Во время проведения эксперимента температура воды в аквариумах с опытной и контрольной рыбой составляла 18,0-21,0°C, содержание растворенного кислорода - 6,9-8,1 мг/л. Для кормления использовали экструдированные продукционные корма. Суточная норма кормления составила «1% от массы рыбы. Были сформированы 2 группы рыб (контрольная и опытная) по 15 экземпляров в каждой. Для рыб опытной группы в комбикорм одновременно вводили 2 антибиотика: «Левофлоксацин» и «Хлорте-трациклин» в дозировках 1000 мг/кг и 200 мг/кг ихтиомассы. Эти антибиотики являются новыми для терапии бактериальных инфекций у рыб, первые положительные результаты по оценки эффективности были получены при выполнении научно-исследовательской работы по разработке новых методов профилактики и лечения болезней объектов аквакультуры [6]. Курс кормления составил 7 суток (традиционная длительность курса антибиотикотерапии). Опыты проводили по аналогии у карпа и гибрида СО х К. Левофлоксацин относится к антибиотикам широкого спектра действия из группы фторхинолонов. Активно действующим веществом является офлоксацин. Препарат активен в отношении большинства штаммов микроорганизмов [13]. Хлортетрациклин - антибиотик широкого спектра действия из тетрациклинового ряда. Он подавляет рост и развитие многих грамположительных и грамотрицательных микроорганизмов [14]. Для оценки влияния антибиотиков на организм рыб проводили гематологический анализ. Кровь отбирали из хвостовой артерии пастеровской пипеткой. Анализ проведен согласно Методическим указаниям по проведению гематологического обследования рыб [4]. Определяли следующие гематологические показатели:
Идентификацию форменных элементов крови проводили по общепринятой классификации [2]. Для оценки реактивности организма рыб на антибиотикотера-пию рассчитывали лейкоцитарный индекс интоксикации (ЛИИ) - показатель, характеризующий степень эндогенной интоксикации. Расчет проводили по формуле Кальф-Калифа на основании полученных данных при анализе микроскопии лейкоцитарной формулы. Лейкоцитарный индекс интоксикации Кальф - Калифа [1]:
где М - миелоциты; Плазм.кл. - плазматические клетки; Ю - юные; Мц - моноциты; П - палочкоядерные; Лц - лимфоциты; Сегм. - сегментоядерные; Эоз. - эозинофилы [3]. Статистическая обработка материала проведена с помощью программы Microsoft Excel. Результаты исследований и их обсуждение. После 7-дневного курса антибиотикотерапии внешних изменений у опытных рыб (как у карпа, так и гибрида СО х К) не выявлено, поведение их не отличалось от рыб контрольных групп. Результаты гематологического анализа карпа приведены в таблице 1. Достоверно значимых различий в эритроцитарной картине между контрольной и опытной группами не выявили. Но хотелось бы отметить, что у рыб, получавших антибиотик, содержания гемоглобина было немного выше (на 7,5%), чем у рыб контрольной группы, что, вероятно, связано с тем, что в крови больше зрелых форм эритроцитов, оснащенность их гемоглобином выше. При анализе эритроцитарной картины у опытных рыб отмечен более низкий уровень эритропоэза (количество молодых эритроцитов на 22,7% меньше). Таблица 1 Показатели крови карпа после применения антибиотиков
Примечание: *- различия достоверны относительно контрольной группы После курса антибиотикотерапии общее количество лейкоцитов на 40% выше, чем у рыб из контрольной группы, что характеризует высокую резистентность организма. В лейкоцитарной картине у карпа опытной группы выявлены нейтропения (абсолютное количество нейтрофилов снижено на 44%) и лимфоцитоз (количество лимфоцитов увеличено на 43%). У гибридов СО х К, получавших антибиотик, изменения в эритроцитарной картине были обратные тем, которые были у карпа. Вероятно, это можно объяснить видовой специфичностью рыб. Механизм ответной реакции организма на антибиотикотерапию в эритроцитарной картине развивался иначе. Уровень гемоглобина у рыб в опытной группе значительно снижен (на 32%) по сравнению с контролем, но при этом общее количество эритроцитов оказалось выше (на 30%), а число молодых эритроцитов ниже на 45% (табл. 2). При этом достоверно значимых различий между контрольной и опытной группами не выявлено, что свидетельствует о неспецифической ответной реакции эритроцитарной картины на воздействие антибиотиков. В лейкоцитарной картине у гибрида СО х К изменения были идентичные как у карпа, но менее выраженные. Следовательно, специфической ответной реакцией на антибиотикотерапию являются именно лейкоцитарные показатели. Выявили достоверное увеличение общего количества лейкоцитов на 40% у рыб, получавших в рационе антибиотики. В лейкоформу-ле снизилась доля нейтрофилов (на 17% относительно контрольной группы рыб), но изменения были не такими значимыми, как у карпа, статистической достоверности не обнаружено и пересчет в абсолютные значения не показал снижения количества этих клеток к крови у опытной группы рыб (табл. 2). У гибрида СО х К отреагировали на антибиотикотерапию гранулоциты - эозинофилы - форменные элементы в цитоплазме с ярко-оранжевого цвета гранулами (рисунок 1).
Рис.1. Эозинофил в крови гибрида сибирского осетра х калуги Они характерны для костно-хрящевых рыб, к которым и относятся осетровые. У карпа мы их не наблюдали, что связано с редкой встречаемостью их в периферической крови карповых рыб. Известно, что фагоцитарная активность их ниже, чем у моноцитов и нейтрофилов [10], а хемотаксис связан с веществами, возникающими при аллергизации [1]. Эозинофилы млекопитающих способны аккумулировать гистамин в тканях при аллергических реакциях и воспалении, возможно, что это явление характерно и для эозинофилов пойки-лотермных животных - рыб. Доля эозинофилов у гибридов осетровых рыб, получавших в рационе антибиотики, была почти в 2 раза выше, чем у контрольных рыб, а при пересчете в абсолютные значения их количество даже в 3 раза выше (табл. 2). Таблица 2 Показатели крови гибрида сибирского осетра х калуги (СО х К) после применения максимальной дозы антибиотиков при комбинированном действии (эксперимент на токсичность антибиотиков)
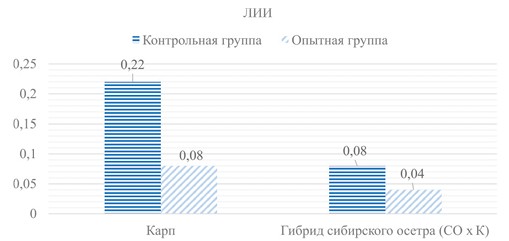
Примечание: *- различия достоверны относительно контрольной группы Для оценки реактивности организма рыб на антибиотикоте-рапию рассчитали ЛИИ. Выявили у опытных групп рыб снижение ЛИИ: у карпа - в 2,75 раза, у гибрида осетра - в 1,95 раз относительно контрольных групп (рисунок 2). Более значимые колебания ЛИИ отмечены у карпа, что соответствует более выраженной степени интоксикации в организме после антибиотикотерапии.
Рис. 2. Лейкоцитарный индекс интоксикации у карпа и гибрида сибирского осетра Заключение. Проведена экспериментальная работа по оценке воздействия антибиотикотерапии на показатели крови карпа и гибрида сибирского осетра х кулуги. Было выявлено, что показатели эритроцитарной картины являются неспецифическими маркерами, происходящие изменения характеризуют видовую ответную реакцию организма. Статистически достоверные изменения отмечали в лейкоцитарной картине. У рыб, получавших антибиотик, резко увеличивается количество лейкоцитов, что указывает на проявление стрессового лейкоцитоза, связанного с выбросом глюкокортикостико-идов в кровь и развитием второй стадии стрессовой реакции - резистентности (адаптации) в организме. В данном случае это объясняет происхождение лейкоцитоза и указывает, что антибиотикотерапия является стресс-фактором для организма рыб. Антибиотики являются одной из главных причин нейтропении и агранулоцитоза (увеличение количество моноцитов и лимфоцитов). Из литературных источников известно, что антибиотики оказывают ингибирующий эффект на нейтрофилы, что связано с изменением структуры антибактериальных препаратов вследствие метаболических процессов в организме, в результате чего продукты метаболизма становятся токсичными для самих фагоцитов. У гибрида СО х К, получавших антибиотик, мы отметили увеличение эозинофилов. Вероятно, эти клетки реагируют на антибиотикотерапию. С учетом их основной функции в организме -ответ на аллергическую реакцию, увеличение числа эозинофилов в периферическом русле можно отнести к прямым маркерам реакции гиперчувствительности осетровых. Рассчитанный лейкоцитарный индекс интоксикации позволил дать оценку реактивности организма рыб на антибиотикотерапию. Отмечено его снижение у рыб опытных групп: у карпа - в 2,75 раза, у гибрида СО х К - в 1,95 раз относительно контрольных групп. Наибольшие колебания ЛИИ проявились у карпа, что указывает на более выраженную степень интоксикации организма этого вида рыб. Таким образом, с учетом максимального 7-дневного применения высоких доз антибиотиков картина крови характерна для начальной стадии стресс-реакции организма, при которой мобилизуются защитные механизмы (увеличение количества лейкоцитов). На фоне проявления лейкоцитоза, нейтропении и лимфоцитоза у осетровых рыб выявлена эозинофилия, что является видоспецифическим маркером осетровых на антибиотикотерапию. Для коррекции иммуно-физиологического состояния после антибиотикотерапии целесообразно проводить курс кормления с пробиотическим препаратом [9, 11]. Список литературы: 1. Алмазов, В. А. Физиология лейкоцитов человека / В. А. Алмазов, Б. В. Афанасьев, А. Ю. Зарицкий // Наука. 1979. 230 с. 2. Иванова, Н. Т. Атлас клеток крови рыб / Н. Т. Иванова // 1983. 184 с. 3. Интерпретация лабораторных данных (справочное пособие) / Н. М. Батырханова, Г. К. Прмагамбетов, К. Б. Иманбекова [и др.] // КазМУНО. 2010. 40 с. 4. Методические указания по проведению гематологического обследования рыб // Сборник инструкций по борьбе с болезнями рыб. 1999. С. 69-97. 5. Портнягина, Е. В. Рациональная антибактериальная терапия и вопросы предупреждения бактериальной резистентности: учебное пособие / Е. В. Порт-нягина, Г. Г. Раднаев // ИГМУ. 2022. 135 с. 6. Применение препаратов «Левофлоксацин» и «СУБ-ПРО» при терапии бактериальной геморрагической септицемии у карповых рыб / Н. Н. Романова, Л. Н. Юхименко, В. В. Вараксина [и др.] // Труды ВНИРО. 2022. Т. 190. С. 116-124. 7. Провоторов, В. М. Роль и место эритроцитов в системе направленного транспорта различных фармакологических средств / В. М. Провоторов, Г. А. Иванова // Клиническая медицина. 2009. № 9. С. 4-8. 8. Особенности распределения цефтриаксона в организме теплокровных животных / А. А. Безъязычная, В. К. Шорманов, Л. Е. Сипливая [и др.] // Фармация. 2020. № 6. С. 51-56. 9. Оценка влияния пробиотика СУБ-ПРО на имунно-физиологический статус рыб/ Н. Н. Романова, П. П. Головин, Л. Н. Юхименко [и др.] // Современные проблемы ветеринарии, зоотехнии и биотехнологии : мат. науч.-практ. конф. ЗооВетКнига. 2020. С. 142-148. 10. Хем, А. Гистология / А. Хем, Д. Кормак // Мир. 1983. 254 с. 11. Gilliland B.C. Drug-induced autoimmune and hematologic disorders // Immunol Allergy Clin North Am. 1991. No. 11. Рр. 525-553. 13. https://www.vidal.ru/drugs/levofloxacin__29985 14. https://www.megamix.ru/products/aviculture/kormovye-antibiotiki-vetpreparaty/khlortetratsiklin/ Резюме. Представлены изменения показателей крови после антибиотико-терапии, проведенной у молоди карпа и гибрида сибирского осетра х калуги. Выявлен ряд показателей эритроцитарной картины, которые являются неспецифическими маркерами, в связи с тем, что после курса применения антибиотиков у карпа и гибрида сибирского осетра х калуги изменения в крови различно и даже противоположно, что указывает на видовую ответную реакцию. Лейкоцитарная картина крови показывает аналогичные изменения как у карпа, так и у гибрида сибирского осетра х калуги. Общее количество лейкоцитов возрастает почти на 40%, что является проявлением стрессового лейкоцитоза, связанного с выбросом глюкокортикостикоидов в кровь и развитием второй стадии стрессовой реакции - резистентности (адаптации) в организме. У рыб, получавших антибиотики, отмечали нейтропению и агранулоцитоз, сопровождающиеся увеличением количества моноцитов и лимфоцитов. Кроме того, у гибрида сибирского осетра х калуги увеличивается количество эозинофилов, что может служить маркером для осетровых рыб на реакцию гиперчувствительности к антибиотикам. Для оценки реактивности организма на антибиотикотерапию рассчитали лейкоцитарный индекс интоксикации, который после курса применения антибиотиков у рыб опытных групп снижается: у карпа - в 2,75 раза, у гибрида сибирского осетра х калуги - в 1,95 раз относительно контрольных групп. Наибольшие колебания лейкоцитарного индекса интоксикации проявляются у карпа, что соответствует более выраженной степени интоксикации организма после антибиотикотерапии. Для коррекции иммуно-физиологического статуса рыб после антибиотикотерапии целесообразно проводить курс кормления с пробиотическим препаратом. Ключевые слова: рыбоводство, антибиотикотерапия, карп, осетровые, гибрид сибирского осетра х калуги, иммуно-физиологический статус, кровь, гематология, показатели крови, лейкоцитарная картина крови. Сведения об авторах: Романова Наталья Николаевна, кандидат биологических наук, доцент, заведующая лабораторией ихтиопатологии филиала по пресноводному рыбному хозяйству ФГБНУ «ВНИРО» («ВНИИПРХ»); 141821, Московская область, Дмитровский г.о., п. Рыбное, 40 а; тел.: 8-495-1086856; e-mail: romanova_nn@vniiprh.ru. Сехина Ольга Васильевна, специалист лаборатории ихтиопатологии филиала по пресноводному рыбному хозяйству ФГБНУ «ВНИРО» («ВНИИ-ПРХ»); 141821, Московская область, Дмитровский г.о., п. Рыбное, 40 а; тел.: 8-495-1086856; e-mail: sekhina_ov@vniiprh.ru. Ответственный за переписку с редакцией: Вишторская Антонина Александровна, специалист лаборатории ихтиопатологии филиала по пресноводному рыбному хозяйству ФГБНУ «ВНИРО» («ВНИИПРХ»); 141821, Московская область, Дмитровский г.о., п. Рыбное, 40 а; тел.: 8-495-1086856; e-mail: vishtorskaya_aa@vniiprh.ru.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|