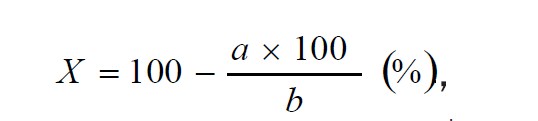|
||||

Лечебно-профилактическая эффективность гамапрена при экспериментальной инфекции мышей, вызванной вирусом простого герпеса 1 типаУДК 619:615.272:616.98:578.825.1 Санин А.В., Наровлянский А.Н., Пронин А.В., Санина В.Ю., Изместьева Анна В., Изместьева Анастасия В., Иванова А.М., Введение. В последние годы герпесвирусные инфекции получают все большее распространение среди домашних г животных. Особенно заметно растет заболеваемость кошек инфекционным ринотрахеитом [12]. Возбудитель этой инфекции - ДНК-содержащий герпесвирус кошек типа 1 (feline herpesvirus type 1, или FHV-1), обладающий липопротеиновой оболочкой, относящийся к подсемейству а-герпесвирусов Alphaherpesvirinae. Помимо FHV-1, в это подсемейство входят также вирус инфекционного ринотрахеита крупного рогатого скота, вирус болезни Ауески, вирус болезни Марека, герпесвирус человека 1 и др. [1]. Возбудители характеризуются наличием липопротеиновой оболочки и содержат 2-цепочечную ДНК. Несмотря на то, что в настоящее время для лечения и профилактики герпетических инфекций используется достаточно большое количество иммуномодуляторов и противовирусных средств, поиск и внедрение препаратов, повышающих резистентность к герпетической инфекции, остается актуальной задачей [15]. Очевидно, что подобные препараты должны не только подавлять размножение вируса герпеса и способствовать коррекции вирусиндуцированного иммунодефицита, но и соответствовать требованиям к безопасности, включающим отсутствие токсичности, аллергенности и реактогенности.
В предыдущих исследованиях было показано, что препараты на основе фосфорилированных полипренолов подавляют размножение ряда вирусов в чувствительных культурах клеток, а также обладают терапевтической активностью при лечении вирусных заболеваний мелких домашних животных {2-7, 9,10}.
Цель исследования - изучить лечебно-профилактическую эффективность препарата Гамапрен (далее, ГП), действующим веществом которого являются фосфорилированные полипренолы, выделенные из листьев шелковицы, при различных вариантах экспериментальной инфекции, вызванной вирусом простого герпеса 1 типа (ВПГ 1) у мышей.
Материалы и методы исследований. Использовали вирус ПГ-1 (штамм VR-3), полученный из ГУ НИИВП им. О.Г. Анджапаридзе РАМН, и штамм Л2 (коллекция вирусов НИИ вирусологии им. Д.И.Ивановского).
В опытах использовали аутбредных беспородных мышей обоего пола массой 7-8 и 10-12 г, полученных из филиала "столбовая" ФГБУН "НЦБТ ФМБА".
В качестве препаратов использовали ГП производства ООО "ГамаВетФарм", содержавший 5 мг активного вещества в 1 мл. Исходный препарат разводили в 50 раз стерильной дистиллированной водой и вводили мышам в объеме 0,2 мл (20 мкг/мышь). В качестве препарата сравнения использовали Ридостин производства ЗАО "Вектор-Медика", п.Кольцово Новосибирской области, содержащий 8 мг активного вещества в 1 мл. Использовали дозу 200 мкг/мышь/ 0,2 мл, в/б, обычно применяемую у мышей при моделировании инфекции
Определение антивирусной активности по подавлению симпластообразования в клеточной культуре. Для оценки противовирусной активности ГП использовали культуру клеток VERO, которую заражали ВПГ1, штамм VR-3. В зараженной культуре оценивали количество симпластов.
Для культивирования клеток VERO использовали ростовую питательную среду: 2/3 среды Игла МЕМ (ПанЭко) и 1/3 среды ДМЕМ (ПанЭко), 15 МЕ/мл гентамицина (ICN, США), 10 % эмбриональной телячьей сыворотки (ICN, США). Клетки рассевали в концентрации 1,5x105 кл/мл в 24-луночных планшетах (ПанЭко, кат. № ПК24о или аналогичные) по 1 мл в лунку. Культивировали в СО2-инкубаторе при 37 0С, 5 % СО2 и 90 % влажности 24 часа до образования монослоя, после чего добавляли по 1 мл ВПГ-1 в разведении от 10-3 до 10-7 (исходный титр 107 ТЦД50/мл). В опытные лунки добавляли ГП в конечной концентрации 400 мкг/мл. В контрольные лунки вносили в том же объеме раствор плацебо. Через 24 часа подсчитывали число симпластов и вычисляли процент подавления симпластообразования по формуле:
Для экспериментов in vivo была отобрана серия ГП, после воздействия которого на клетки VERO оставалось 2 симпласта на лунку (в контроле - 68).
Оценку эффективности ГП при экспериментальном герпетическом менингоэнцефалите проводили на мышах массой 7-8 г при заражении их в мозг 0,03 мл материала, содержащего 10 ЛД50 ВПГ-1 (штамм Л2, инфекционность-5,0-5, 5 ЛД50/0,03 мл), что обеспечивало гибель животных в контрольной группе. ГП вводили внутрибрюшинно в/б или п/к, или перорально по лечебно-профилактической (-24часа, -4 часа, +4часа, +24 часа и +48 часов по отношению к заражению ВПГ-1) схеме. Срок наблюдения - 21 день. В каждой группе было по 20 животных. Эффективность ГП оценивали по увеличению выживаемости и средней продолжительности жизни (СПЖ) животных в опытной группе по сравнению с контрольной группой.
Модель экспериментальной герпетической инфекции у мышей воспроизводили на мышах массой 10-12 г. Для заражения использовали ВПГ-1 штамм Л2, прошедший 3 пассажа на белых мышах весом
7-8 г при внутримозговом заражении. Титр вируса при этом составил 7 lg ЛД50/0,03 мл. Мышей заражали в/б вируссодержащей 10%-ной суспензией мозга мышей (доза - 100 ЛД50). ГП вводили в/б по 2-м схемам: профилактической (за 24 часа до заражения ВПГ-1) и лечебно-профилактической (одновременно с ВПГ-1). В качестве референс-препарата использовали Ридостин, который вводили за 24 часа до заражения ВПГ-1. В каждой группе было по 10 мышей, срок наблюдения составил 15 дней. Противовирусную активность определяли по увеличению выживаемости и СПЖ.
Биологическое титрование ВПГ-1 из мозга мышей на клетках VERO. Для доказательства противовирусной активности ГП были проведены опыты биологического титрования вируса из мозга мышей на клетках VERO.
Титр ВПГ-1 в ткани мозга опытных и контрольных мышей, взятой на 6-й день после заражения (т.е. на пике инфекционного процесса), определяли после обработки культуры клеток 10-кратными разведениями суспензии мозга мышей. Наблюдение и учет ЦПД осуществляли на 3-4-й день после контакта клеток с инфекционным материалом.
Оценка противовирусной эффективности ГП in vivo в инкубационном периоде и на этапе клинически выраженной герпетической инфекции.
На первом этапе исследовали противовирусную активность ГП при введении до появления первых клинических признаков заболевания. Под наблюдением находились 4 групп мышей (по 16 в каждой). Всех мышей заражали ВПГ-1 в дозе 105 ТЦД50 /0,5 мл, в/б + 0,2 мл физраствора; 2-я группа - за 24 часа до заражения вводили Ридос-тин, в/б; 3-я группа - 3-х кратно вводили ГП (одновременно с ВПГ-1, через 24 и 48 часов после заражения), п/к; 4-я группа - 4-х кратно вводили ГП, п/к (на 1-е, 2-е, 3-и, 4-е сутки после заражения, до появления первых клинических признаков заболевания).
На 2-м этапе изучали лечебное действие ГП у мышей с клинически выраженными признаками заболевания. Под наблюдением находились 3 группы животных (по 26 мышей в каждой). Всех мышей заражали ВПГ-1 в дозе 105 ТЦД50 /0,5 мл, в/б + 0,2 мл физраствора, в/б; 2-я группа - за 24 часа до заражения вводили Ридостин в дозе 200 мкг/мышь/0,2 мл, в/б; 3-я группа - 4-кратное п/к введение ГП на 4-е, 5-е, 6-е и 7-е сутки после заражения.
За мышами проводили ежедневное наблюдение в течение 14-и суток, выявляли больных и павших особей. Клинические признаки заболевания регистрировали с 4-х по 8-е сутки после заражения. У больных мышей наблюдали характерные признаки герпетической инфекции с поражениями ЦНС: вялость, взъерошенность шерсти, парезы задних конечностей, судороги с последующей гибелью. По окончании наблюдений, рассчитывали показатели летальности по каждой группе: отношение числа павших животных к общему количеству мышей в группе (в %) и СПЖ в сутках.
Результаты и обсуждение. Эффективность препарата Гама-прен при экспериментальном герпетическом менингоэнцефалите. На модели экспериментального герпетического менингоэнцефалита у мышей показано, что применение ГП по лечебно-профилактической схеме защитный эффект составил 47% при п/к введении, и был несколько ниже при других способах введения. Наибольшую СПЖ наблюдали при пероральном введении (табл. 1). Таблица 1. Эффективность препарата Гамапрен при герпетическом менингоэнцефалите мышей
Лечебно-профилактическая эффективность препарата Гамапрен при экспериментальной герпетической инфекции у мышей. Наибольший эффект был обнаружен у ГП при лечебно-профилактической схеме введения (0час) - выживаемость составила 90%, защита - 50%, а СПЖ - 14,1±0,85. Аналогичным эффектом обладал и эталонный противовирусный препарат Ридостин (табл. 2). В контроле выживаемость была 40%, а СПЖ - 10,0±1,31.
Таблица 2. Эффективность препарата Гамапрен при экспериментальной герпетической инфекции мышей
Примечание: * Р< 0,05 Для доказательства противовирусной активности ГП in vivo были проведены опыты биологического титрования ВПГ-1 из мозга мышей на клетках VERO. Титр ВПГ-1 в ткани мозга опытных и контрольных мышей, взятой на 6-й день после заражения, определяли в результате обработки культуры клеток 10-кратными разведениями суспензии мозга мышей. Наблюдение и учет ЦПД осуществляли на 3-4 день после контакта клеток с инфекционным материалом. Титр ВПГ-1, полученного из мозга контрольных мышей составил 5,0 lg ТЦД50/мл. Титры ВПГ-1 из мозга мышей, которым вводили ГП, составляли 2,0 (-24ч) и 1,5 (0ч) lg ТЦД50/мл, соответственно. Таким образом, ГП существенно снижал титр вируса (на 3,5-2,0 lg), что было сопоставимо с противовирусным действием Ридостина, который снижал титр вируса на 3,5 (-24ч) lg ТЦД50/мл (табл. 3).
Таблица 3. Противовирусная эффективность препарата Гамапрен в опытах биологического титрования ВПГ-1 из мозга мышей на клетках VERO
Исследование антигерпетической активности препарата Гамапрен в эксперименте in vivo в инкубационном периоде и на этапе клинически выраженной инфекции. Как видно из данных, представленных в таблице 4, доза ВПГ-1, использованная в данном опыте (105 ТЦД50), соответствует 1 ЛД75. Ридостин защищал 44% мышей (группа 2), а ГП в дозе 20 мкг/мышь после 3-кратного введения защищал 50% мышей; показатель СПЖ был значительно больше контрольного (группы 1 и 3); после 4-кратного введения ГП защищал 57% мышей, а СПЖ возрастала в 2 раза (группы 1 и 4). Таблица 4. Противовирусная активность ГП в инкубационном периоде при экспериментальной инфекции, вызванной ВПГ-1
Примечание: * - разница между показателями летальности и СПЖ статистически достоверна (при Р < 0,05) в группах 1 и 2; 1 и 3, 1 и 4 Таблица 5. Противовирусная эффективность препарата Гамапрен при клинически выраженной инфекции, вызванной ВПГ-1
Примечание: * - разница между показателями летальности и СПЖ статистически достоверна (при Р < 0,05) в группах 1 и 2; 1 и 3. Согласно данным, представленным в таблице 5, доза ВПГ-1, использованная в данном опыте (105 ТЦД50), соответствует 1 ЛД84 для мышей. Ридостин защищал 50% мышей (группа 2), а ГП, введённый 4-х кратно в течение острого периода, вызывал защиту в 39% случаев: летальность в группе 3 составила 61%; показатель СПЖ был достоверно больше контрольного (группа 1 и 3).
Препарат Гамапрен, рекомендованный для профилактики и лечения герпесвирусных инфекций кошек, также обладает противовирусным действием по отношению к вирусам гепатита С [7], энцефа-ломиелита Тейлера [5], желтой лихорадки, диареи и инфекционного ринотрахеита крупного рогатого скота в чувствительных культурах клеток [2]. Кроме того, показана эффективность ГП при профилактике и лечении вирусных инфекций мелких домашних животных [4, 6, 9, 10].
В настоящей работе представлены результаты, характеризующие антивирусную активность ГП при инфицировании мышей ВПГ-1. Показано, что ГП при различных схемах введения обладает выраженным лечебно-профилактическом действием при разных формах экспериментальной инфекции. Выявлена эффективность ГП при клинически выраженном герпесе на фоне развивающейся неврологической симптоматики: препарат проявлял выраженное лечебное действие при ежедневном однократном введении в течение острого периода (на 4-е, 5-е, 6-е и 7-е сутки после заражения ВПГ-1). При этом ГП по протективной активности был сравним с Ридостином. Визуальное наблюдение за мышами, которым вводили ГП при появлении первых клинических симптомов, показало, что на фоне инъекций препарата клинические признаки прекращались через 2-3 суток и не регистрировались по крайней мере в течение всего периода наблюдений (14 суток).
Это может объясняться, в частности, способностью ГП активировать реакции врожденного иммунитета и блокировать вирусопосредо-ванное нарушение таких реакций, что приводит к ранней элиминации вируса из организма. Либо ГП может непосредственно влиять на различные этапы жизненного цикла ВПГ-1, тем самым нарушая его репродукцию. Ранее было показано, что защитный эффект фосфорилиро-ванных полипренолов (ФП) при вирусных заболеваниях опосредован как прямым противовирусным действием, так и иммуномодулирующей активностью препаратов, связанной с усилением продукции ци-токинов [8]. Важным, на наш взгляд, является то обстоятельство, что ГП достаточно эффективен как при профилактике герпесвирусной инфекции, так и при использовании в период острого клинически выраженного заболевания у мышей, что дает основание для дальнейшего его продвижения в практику в качестве препарата для лечения инфекций, вызванных вирусами герпеса у мелких домашних животных.
В настоящее время большинство противовирусных препаратов, применяющихся для борьбы с герпесвирусными инфекциями собак и кошек, представляют собой аналоги тех или иных нуклеотидов или нуклеозидов ДНК вируса герпеса, либо ингибиторы вирусной ДНК-по-лимеразы, и их безопасность зависит, в значительной степени, от того, насколько специфично их воздействие на вирус [15]. Не случайно, в связи с этим, что одним из немногих противовирусных препаратов, разрешенных в США для лечения кошачьего ринотрахеита, одного из самых распространенных инфекционных заболеваний домашних кошек [12], является Polyprenyl Immunostimulant (PI), безопасность которого, как и ГП, подтверждена клиническими испытаниями [13]. Препараты ГП и PI были одновременно разработаны и изучены в РФ и США в результате совместной Российско-американской программы в рамках проекта МНТЦ. Различие между данными препаратами состоит только в том, что фосфорилированные полипренолы ГП получают из листьев шелковицы, произрастающей на юге РФ, а сырьем для PI служит шелковица, распространенная в США. Кроме того, концентрация действующего вещества в ГП 0,5%, а в PI- 0,25%. И ГП и PI первоначально зарегистрированы для лечения герпесвирусных инфекций кошек, однако PI также проявил эффективность в контролируемых клинических испытаниях при сухой форме кошачьего инфекционного перитонита [14]. Об аналогичных свойствах ГП ранее также сообщалось в отечественных публикациях [11]. Заключение. Таким образом, препарат Гамапрен в экспериментальном исследовании на мышах проявил выраженную антивирусную активность в отношении различных форм инфекции, вызванной ВПГ-1. Наибольшая эффективность препарата выявлена при введении согласно профилактической и лечебно-профилактической схемам.
Список литературы:
Резюме. Значимость герпесвирусных инфекций в инфекционной патологии мелких домашних животных возрастает. Хотя для борьбы с этими инфекциями используется достаточно большое количество препаратов, разработка и внедрение эффективных лечебных средств остается актуальной задачей. Авторами изучена лечебно-профилактическая эффективность препарата Гамапрен (ГП), действующим веществом которого являются фосфорилированные поли-пренолы, выделенные из листьев шелковицы, при различных вариантах экспериментальной инфекции, вызванной вирусом простого герпеса 1 типа (ВПГ 1) у мышей. Использовали ВПГ-1 (штаммы VR-3 и Л2. Опыты проводили на аутбред-ных белых мышей обоего пола массой 7-8 и 10-12 г, полученных из питомника Столбовая. Использовали коммерческий препарат ГП, который вводили мышам в дозе 20 мкг/мышь/0,2 мл. В качестве препарата сравнения применяли коммерческий препарат Ридостин. Модель экспериментального герпетического менингоэнцефалита создавали на мышах массой 7-8 г при заражении их в мозг 0,03 мл материала, содержащего 10 ЛД50 ВПГ-1. Эффективность ГП оценивали по увеличению выживаемости и средней продолжительности жизни (СПЖ) животных в опытной группе по сравнению с контрольной группой. Модель экспериментальной герпетической инфекции у мышей воспроизводили на мышах массой 10-12 г. Для заражения использовали ВПГ-1 штамм Л2, прошедший 3 пассажа на белых мышах весом 7-8 г при внутримозговом заражении. Титр вируса при этом составил 7 lg ЛД50/0,03 мл. ГП вводили в/б по 2-м схемам: профилактической (за 24 часа до заражения ВПГ-1) и лечебно-профилактической (одновременно с ВПГ-1). Также оценивали противовирусную активность ГП при введении до появления первых клинических признаков заболевания и на этапе инфекции с клинически выраженными признаками заболевания. Авторами показано, что ГП в дозе 20 мкг/мышь при п/к введении обладает выраженным лечебно-профилактическом действием при экспериментальной герпетической инфекции. Противовирусная эффективность ГП была выявлена как на модели экспериментального герпетического менингоэнцефалита, так и при введении мышам, инфицированным ВПГ-1 до появления первых клинических признаков заболевания и на этапе инфекции с клинически выраженными признаками заболевания. Выявлена эффективность ГП при клинически выраженном герпесе на фоне развивающейся неврологической симптоматики: препарат проявлял выраженное лечебное действие при ежедневном однократном введении в течение острого периода (на 4-е, 5-е, 6-е и 7-е сутки после заражения ВПГ-1). Ключевые слова: Гамапрен, вирус простого герпеса 1 типа, противовирусные препараты, герпесвирусные инфекции кошек, вирус инфекционного ринотрахеита кошек.
Сведения об авторах:
Санин Александр Владимирович, доктор биологических наук, профессор ФГБУ "ФНИЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел.: 8-499-193-43-55; e-mail: saninalex@inbox.ru.
Наровлянский Александр Наумович, доктор биологических наук, профессор ФГБУ "ФНИЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел.: 8-499-193-43-06; e-mail: narovl@yandex.ru.
Пронин Александр Васильевич, доктор биологических наук, профессор ФГБУ "ФНИЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел.: 8-499-190-57-41; е-mail: proninalexander@yandex.ru.
Санина Валентина Юрьевна, кандидат химических наук, ФГБУ "ФНИЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел.: 8-499-1905851; e-mail: info@gamaleya.org.
Изместьева Анна Васильевна, научный сотрудник ФГБУ "ФНИЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел.: 8916-682-87-45; e-mail: annuhska@list.ru.
Изместьева Анастасия Васильевна, научный сотрудник ФГБУ "ФНИЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел.: 8-985-238-04-49; e-mail: info@gamaleya.org.
Иванова Алла Михайловна, кандидат биологических наук, ФГБУ "ФНИ-ЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел.: 8-499-1905851; e-mail: info@gamaleya.org.
Мезенцева Марина Владимировна, доктор биологических наук, ФГБУ "ФНИЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел.: 8-499-1905851; e-mail: info@gamaleya.org.
Зубашев Игорь Константинович, кандидат медицинских наук, ФГБУ "ФНИЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел.: 8-499-1905851; e-mail: info@gamaleya.org.
Тимофеева Татьяна Юрьевна, научный сотрудник ФГБУ "ФНИЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел.: 8499-1905851; e-mail: info@gamaleya.org.
Ожерелков Сергей Викторович, доктор биологических наук, ФГБУ "Федеральный научный центр исследований и разработки иммунобиологических препаратов им. М.П. Чумакова РАН; 108819, г. Москва, пос. Института полиомиелита, д. 8, стр. 1; тел.: 8-495-8419002; e-mail: sue_polio@chumakovs.su.
Ответственный за переписку с редакцией: Кожевникова Татьяна Николаевна, кандидат медицинских наук, ФГБУ "ФНИЦЭМ им. Н.Ф. Гамалеи" Минздрава России; 123098, г. Москва, ул. Гамалеи, 18; тел: 8-499-190-5851; e-mail: tatiana@micro-plus.ru.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|