|
||||

Интерпретация результатов ELISA для вируса инфекционного бронхита (IBV)Dr. Bart van Leerdam n BioChek B.V. , Использование данных серологии, полученных с помощью метода ELISA, в системе организации здоровья птицы было повсеместно принято для многих заболеваний, включая инфекционный бронхит (IBV). Серология является полезным инструментом для отслеживания иммунного ответа после вакцинации и для постановки диагноза. Очень трудно найти в литературе практические рекомендации касательно интерпретации результатов (IBV) ELISA. Часто остаются без ответа такие практические вопросы, как: "Какой уровень титров и какой коэффициент вариации (CV) следует ожидать после вакцинации против IBV?" и "Можно ли провести различие между вакцинацией и полевым заражением с помощью IBV ELISA?". В данной статье освещается применение и интерпретация результатов анализа IBV ELISA после вакцинации живой и инактивированной вакцинами, и как серология может облегчить идентификацию заражения вирусом инфекционного бронхита в полевых условиях. Где это представляется возможным, обсуждаются серологические результаты полевых историй болезни Обоснование мониторинга IBV Связанные с заболеванием проблемы иногда возникают даже у вакцинированных птиц. Связано ли это с качеством вакцины? Возможно, но гораздо чаще, неудача вакцины является следствием неудовлетворительного обращения и/или применения вакцины. Поэтому, когда имеешь дело с вакцинацией живой вакциной против респираторных заболеваний, наподобие IBV, важно оценить успешность вакцинации Это связано с тем, что успешная вакцинация не всегда является неизбежной, поскольку трудно обеспечить доставку эффективной дозы всем птицам без исключения при использовании методов массовой вакцинация (например, с питьевой водой и спрей методом) для живых вакцин IBV Мониторинг иммунного ответа на вакцинацию помогает обнаружить и диагностировать какие-либо сбои с тем, чтобы предпринять корректирующие меры, если вакцинация оказалась неудачной. Таким образом, отслеживание результатов вакцинации следует рассматривать как "Контроль Качества" вакцинаций, проводимых в полевых условиях Это приводит нас к очень важному моменту при мониторинге с помощью ELISA: следует быть готовым предпринять должные меры в зависимости от результатов. Без принятия мер нельзя ожидать улучшения оптимизации и поддержания эффективности программ вакцинации Интерпретация результатов ELISA Для того чтобы успешно интерпретировать результаты ELISA после серологического мониторинга вакцинированных стад, должны быть соблюдены следующие условия.
В лаборатории следует использовать внешние референтные контроли, чтобы иметь дополнительную гарантию воспроизводимости и точности результатов и обеспечить правильную интерпретацию. Без референтных контролей, в случае получения аномальных титров, мы незнаем, либо это результат ошибок при проведении процедуры теста либо это фактическое отражение иммунного статуса птиц в полевых условиях.Перед проведением анализа необходимо иметь представление о том, какой результат является ожидаемым (базисный уровень титров для успешной вакцинации). Это позволит легче интерпретировать результаты, сравнивая с базисным уровнем, и легко судить об успешности вашей программы вакцинации. Также необходимо иметь представление о том, какие действия следует предпринять, если результаты не соответствуют ожидаемым На практике интерпретация результатов вакцинации обычно проводится путем оценки трех основных компонентов гуморального ответа после введения вакцины, которыми являются Интенсивность отклика, на что указывает значение среднего титра. Развиваются ли у птиц уровни титров в ожидаемом диапазоне (базисный уровень) для примененной вакцины? Эти титры базисного уровня могут варьировать в зависимости от типа птицы, возраста типа вакцины, программа вакцинации и т.д. В каждом конкретном случае следует разработать собственные базисные уровни для своих программ вакцинации и условий на месте. Пример базисных уровней при вакцинации бройлеров против IBV приводятся в таблицах 1 и 2 (в конце статьи). Можно видеть, что базисные уровни (средний титр) могут варьировать в зависимости от использованных вакцинных штаммов Применение относительно мягких вакцин Н120 будет давать значительно меньшие титры по сравнению с ответом, полученным после применения более иммуногенных вакцинных штаммов, таких как IB 4/91 Однородность отклика, на что указывает %CV (коэффициент вариации). Была ли вакцина доставлена каждой птице или нет? Находится ли %CV в пределах требуемого диапазона, или есть ли возможность для улучшения? В качестве общего руководства для коэффициента вариации после вакцинации можно привести следующие значения:
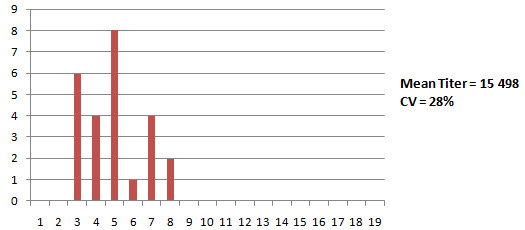
Хотя эти общие рекомендации применимы для большинства живых и инактивированных вакцин, следует иметь в виду, что использование живых вакцин против респираторных заболеваний наподобие IBV, генерирует в целом неоднородный отклик в титрах. Горизонтальное распространение вакцинного вируса среди стад может быть ограниченным, а, кроме этого, живые IBV вакцины могут также давать местный иммунный отклик, который нельзя измерить с помощью метода ELISA Поэтому в случае применения таких живых вакцин, как вакцина Н120 ожидаемый СУдля хорошей вакцинации будет составлять 40-70%. Значение CV на уровне <30% после вакцинации вакциной Н120 следует рассматривать, как подозрение заражения. Однако, при использовании в программе вакцинации более иммуногенных вакцин, наподобие штамма 4/91, значения CV ниже 45% не являются редкими. В случае племенного поголовья или кур-несушек, где перед ина-ктивированной вакциной применяется целый ряд вакцинаций с помощью живых вакцин, полная сероконверсия (100% птиц позитивны) является более важным критерием успеха, чем только один показатель %CV. Было продемонстрировано, что хорошее праймирование живыми вакцинами перед инактивированной оказывает сильное и благоприятное влияние на величину и стойкость титров в течение всего периода продуктивности. Следует проверить, являются ли все птицы (100%) се-ропозитивными Продолжительность отклика, на что указывает средний титр в зависимости от времени. Достаточно ли долго сохраняются титры во времени? Необходима ли еще одна вакцинация с целью форсирования подъема титров выше минимальных защитных уровней или для добавления местной защиты? Как уже упоминалось, существует четкая связь между титрами полученными после живых вакцин и стабильностью титров в ходе продуктивного периода племенного поголовья и кур-несушек после вакцинации инактивированной вакциной. Хорошее праймирование (положительные и однородные титры) перед применением инактивированной вакцины приведет к более стабильным и высоким титрам в течение продуктивного периода. И, наоборот, слабые титры после праймирова-ния (низкие, неоднородные титры с высоким процентом отрицательных результатов) приведут к высоким титрам в начале периода продуктивности и к низким титрам в середине и конце периода яйцекладки. В целом, титры IBV имеют тенденцию к меньшей стабильности в течение периода продуктивности по сравнению с титрами к болезни Гамборо и болезни Ньюкасла. Действительная причина такой нестабильность остается неизвестной, однако она лишь подчеркивает необходимость отслеживания титров IBV в критических точках с целью определения того, не следует ли провести дополнительную вакцинацию с целью стимуляции подъема снижающихся титров. Еще одним фактором, определяющим успех инактивированной вакцины, является уровень антител в момент введения. Высокие титры антител в момент применения могут помешать серологическому отклику на инактивированную вакцину. Такая ситуация, в частности, была замечена после применения более иммуногенных вакцин, наподобие 4/91, незадолго до вакцинации инактивированной вакциной кур-несушек и племенного поголовья. Примером такой программы может быть ситуация, когда племенное поголовье вакцинируют в период выращивания с применением стандартных живых вакцин типа Н120 и МА5 после чего следует вакцинация с помощью IBV4/91 в возрасте 10-15 недель и, наконец, вакцинация инактивированной вакциной против BV в возрасте 18 недель. При применении такой программы часто отмечается снижение титров антител при тестировании образцов сыворотки в возрасте 24 недели, а не подъем титров, как это имеет место в случае применения программы вакцинации без вакцины 4/91. При использовании диагностических наборов системы BioChek результаты могут быть следующими: Средний титр ELISA в возрасте 24 недели Программа с 4/91 - незадолго до инактивированной вакцины 2000 - 5000 По всей видимости, этот эффект можно преодолеть, обеспечивая достаточный интервал между вакцинацией 4/91 и применением инактивированной вакцины. Рекомендуемый интервал должен быть не менее 4-8 недель Успех или неудача вакцинации Индикаторами успешной вакцинации обычно являются высокие однородные и длительно сохраняющиеся титры, находящиеся в ожидаемом диапазоне для данного типа вакцины. Эти образцы должны быть 100% позитивными Индикаторы плохого результата вакцинации в целом являются противоположными: т.е., титры ниже ожидаемых, неоднородные и недолговременные. Титры "ниже базисного уровня" обычно сопровождаются некоторым количеством отрицательных результатов - отумеренной до высокой степени. Мониторинг IBV с определенными интервалами у кур-несушек и племенного поголовья особенно полезен для раннего выявления неудачной вакцинации. Немедленная ревакцинация сразу после выявления неудачной вакцинации будет способствовать предотвращению потерь продуктивности в будущем. Таким образом, отслеживание результатов вакцинации имеет профилактическую природу что является важным в плане экономического обоснования применения программ мониторинга В случае проявления полевого заражения IBV, мониторинг также будет способствовать обеспечению ранней диагностики заболевания с целью ограничения причин потерь продуктивности. Ниже обсуждается как мониторинг может помочь в диагностике полевого заражения IBV Диагностика полевого заражения IBV. Диагноз можно поставить комбинированной оценкой истории стада, клинических признаков, серологии, а также изоляции и идентификации патогена. Серологический мониторинг в особенности полезен для установления времени появления и характера полевой инфекции Для невакцинированных стад присутствие полевого заражения BV может быть легко продемонстрировано положительной серологией IBV. Однако для IBV вакцинированных стад идентификация полевого заражения затруднительна и требует знания ожидаемых титров после вакцинации (базисный уровень). Каждый пользователь системы ELISA должен разработать свои собственные базисные уровни титров в зависимости от: программы вакцинации, специфики используемых вакцин и вида птиц. Эти данные в сочетании с периодическим анализом серологического профиля стад, т.е. серологической истории, позволяют определить являются ли серологические результаты нормальными или аномальными. Неожиданный подъем титров, значительно превышающий ожидаемые титры после вакцинации, могут указывать на присутствие полевого заражения. Однако следует подчеркнуть, что титры сами по себе не могут использоваться для постановки диагноза. Диагностику следует проводить на основе комплексной оценки результатов серологии, клинической симптоматики, а также изоляции патогена. До тех пор пока не будет поставлен диагноз, рекомендуется использовать понятие "подозрение на инфекцию", вместо термина "инфекционные титры" Идентификация IBV инфекции В случае аномально высоких IBV титров следует учитывать три ключевых критерия, которые должны выполняться для того, чтобы сделать вывод, что полученная серология - результат заражения IBV: Средний титр после инфекции должен быть значительно повышен. Обычным правилом является, что средний титр после инфекции, должен, по меньшей мере, в два раза превышать уровень, который является ожидаемым после вакцинации, или должен хотя бы в два раза превышать средний уровень титров до инфекции Значения CV должны быть значение снижены. Коэффициент вариации (CV) должен быть значительно ниже уровней, которые являются ожидаемыми после вакцинации, или значительно ниже уровней CV до инфекции. Например, если Вы вакцинируете цыплят-бройлеров дважды с помощью вакцины Н120, ожидаемый CV находится в диапазоне 50- 80 %. Если после вакцинации Вы получаете значение CV на уровне 35%, то это является указанием на аномальный отклик Клинические признаки должны соответствовать серологии Если серология IBV повышена, но клинические признаки отсутствую или не согласуются с инфекцией IBV, то Вы просто не сможете подтвердить инфекцию IBV Приведенные ниже цифры указывают на серологию полевых случаев IBV инфекции у племенного поголовья и цыплят-бройлеров и помогают проиллюстрировать упомянутые выше ключевые критерии В обоих из этих случаев применяют 3 ключевых критерия Пример 1. Серология IBV племенного поголовья до (34 недель) и после инфекции (37 недель). Серология после инфекции указывает на значительно повышенный средний титр и сниженный коэффициент вариации (CV) по сравнению с серологией до инфекции. Клинические признаки согласуются и соответствуют IBV серологии после инфекции Родители бройлеров в 35 недель 15% снижение яйценоскости
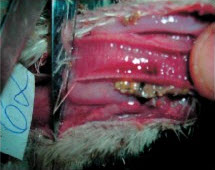
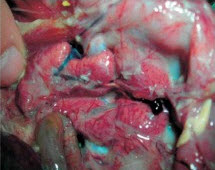
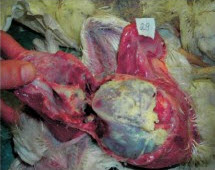
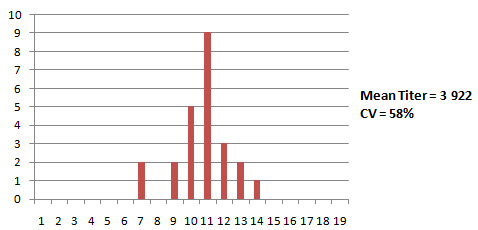
Клинические признаки: мелкие, деформированные яйца и снижение яйценоскости на 15 % Соответствующее повышение тигров и снижение %CV Пример 2. Серология бройлеров в возрасте 44 дня, после двукратной вакцинации Н120. Средний титр значительно увеличен, коэффициент вариации (CV) значительно снижен. Клинические симптомы также соответствуют серологической картине Осложненные IBV инфекции Несмотря на то, что в случае проявления респираторных признаков можно подозревать инфекцию IBV, рекомендуется также провести тестирование инфицированных птиц на предмет присутствия других респираторных патогенов по двум причинам Инфекции IBV часто происходят в сочетании с другими респираторными патогенами, в частности, вирусом птичьего ринотрахеита (ART) (известен также, как птичий пневмовирус (APV)), Ornithobactenum rhinotracheale (OR), Mycoplasma gallisepticum (MG) и Mycoplasma synoviae (MS). Осложненные инфекции можно диагностировать лишь путем просмотра всей серологической картины. Тестирование только на IBV не укажет на взаимодействующие патогены респираторной болезни Серология после респираторных вакцин типа IBV и NDV часто аномально искажается из-за повреждений, присутствующих после респираторного заражения (трахеит и/или аэросаккулит). Эти повреждения делают возможным более активный контакт и проникновение вакцинного вируса в рецепторных местах, что приводит в результате к повышенной по сравнению с нормой серологии после применения живых вакцин IBV и NDV. Это является одной из причин частой ложной диагностики инфекции пневмовирусами (ART), как инфекции IBV, если оценивать только серологию IBV. Анализ всей серологической картины позволяет увидеть характер взаимодействия с другими респираторными агентами, что позволяет надлежащим образом поставить диагноз осложненной инфекции. Часто принятие во внимание ключевых критериев при определении инфекции (как описано выше) помогает исключить "эффект пораженной трахеи": как правило усиленные реакции на вакцину не приводят к удвоению ожидаемых средних титров и/или значительному снижению коэффициента вариации (%CV). Приведенные ниже две истории болезни демонстрируют полезность проведения полного тестирования птиц с респираторными заболеваниями История болезни 1: Хроническая респираторная инфекция, ложно диагностированная, как инфекционный бронхит (IBV) Стадо бройлеров было дважды вакцинированно живой IBV вакциной МА5 В возрасте 21 день у птиц обнаруживалась тяжелая респираторная клиника в сочетании с распухшей головой и смертностью на уровне 10-15%. Вскрытие выявило аэросаккулит с желтым пенистым экссудатом, который был отнесен на счет инфекции Е. coli. Рутинная серология на инфекционный бронхите помощью ELISA выявила слегка повышенные средние титры с более однородным откликом, чем обычно. В связи с тем, что титры были повышены, был сделан вывод о том, что цыплята-бройлеры были заражены инфекционным бронхитом с вторичной инфекцией Е. coli. В программу вакцинации бройлеров была введена третья вакцинация против IBV, но респираторные признаки сохранились. Если провести более полное серологическое обследование, то обнаруживаются значительные положительные титры ART и OR. История болезни 2: Осложненная инфекция IBV с нефропатогенным вариантным штаммом. Стадо бройлеров было дважды вакцинированно живой вакциной Massachusetts (Н120) в возрасте 1 и 20 дней. Птиц также дважды вакцинировали от NDV с применением живой вакцины Avinew в возрасте 1 (спрей) и 20 дней (выпаивание с водой). В возрасте 14-21 дней у птиц проявились респираторные признаки, мягкая диарея и смертность Посмертное обследование выявило трахеит и нефрит. У некоторых птиц аэросаккулит с плотным желтоватым пенистым экссудатом. На приведенных ниже фотографиях иллюстрируется ситуация на ферме. Показаны тяжелый трахеит, воспаление почек (нефрит) и аэросаккулит с плотным творожистым экссудатом. Ниже приводятся полученные с помощью ELISA данные серологии у цыплят в возрасте 46 дней. Тесты на MG и MS оказались отрицательными (данные не показаны). Серология IBV выявила аномально высокие титры со значением CV (25%), что значительно ниже ожидаемого диапазона (50 - 100%). Клинические симптомы также согласовывались с повышенными титрами IBV Результаты серологии ART и OR были также положительными, указывая на наличие этих попутных инфекций, поскольку птицы не подвергались вакцинации. Серология на предмет NDV показала повышенные по сравнению с нормой титры, но усиленная реакция, по всей видимости, была связана с "эффектом поражения трахеи" вакцинным вирусом. Для NDV также не удовлетворялись ключевые критерии, которые указывают на инфекцию. (Средний титр в два раза ниже ожидаемого после вакцинации). На основе этих результатов можно сделать вывод о том, что птицы первоначально были инфицированы нефропатогенным штаммом инфекционного бронхита, a ART и OR действовали в качестве вторичных патогенов Был разработан план на случай непредвиденных дополнительных обстоятельств, который включал вакцинацию с применением живого вариантного штамма IBV (4/91) в возрасте 14 дней с питьевой водой. После реализации новой программы параметры продуктивности вернулись к норме. Образцы сыворотки от пораженных стад, использованных для тестирования с помощью ELISA, были отправлены в лабораторию компании Intervet в Боксмеере, Голландия, для проведения серотипирования с помощью теста нейтрализации вируса (VN). Результаты обобщены в приведенной ниже таблице: История болезни 3: Серотипирование инфекции IBV с QX-подобным штаммом у бройлеров с респираторной инфекцией Цыплят-бройлеров вакцинировали дважды вакциной Н120 в возрасте 1 и 20 дней В возрасте 14-21 дней у птиц были обнаружены респираторные признаки, нефрит и увеличение смертности Результаты серологии цыплят в возрасте 46 дней Специфический тест нейтрализации вируса (VN) выявил самый высокий титр для QX-подобного (или D388) штамма у птиц, которые были вакцинированы только вакциной Н120 серотип Massachusetts (в тесте VN определяется с М41). Можно сделать вывод о том, что результаты серологии с помощью метода ELISA оказались очень полезными для ранней диагностики природы первичного патогена (нефропатогенный IBV) и помогли предотвратить дальнейший урон путем немедленной корректировки программы вакцинации, которая включала вакцину с вариантным штаммом IB 4/91 Дополнительное серотипирование с помощью теста нейтрализации вируса (VN) помогло установить конечный диагноз до уровня специфического штамма (тип D338). Оно подтвердило обоснованность использования вариантного штамма в программе вакцинации с целью расширения спектра защиты против различных вариантов инфекционного бронхита. Осведомленность о присутствии этого серотипа на птицеферме может также оказаться полезной в разработке эффективных программ вакцинации для других пораженных ферм в данном регионе Заключение Основное преимущество серологического мониторинга инфекционного бронхита с помощью ELISA заключается в следующем:
Ключевым пунктом применения программы мониторинга является то, что в зависимости от полученных результатов следуют определенные действия. Принятие немедленных соответствующих мер является очень важным для ограничения и предотвращения дальнейших экономических потерь. Если результаты вакцинации являются неудовлетворительными, это позволит провести повторную оценку процедур вакцинации против IBV и осуществить корректирующие действия. Это делает регулярный мониторинг экономически эффективным профилактическим средством. Повышение эффективности применения вакцины приведете результате к более эффективному контролю над заболеванием и повышению продуктивности стад Резюме Данная статья с практической точки зрения иллюстрирует ключевые моменты в интерпретации результатов серологии с помощью ELISA после вакцинации живыми и инактивированными вакцинами против инфекционного бронхита, а также идентификации заражения IBV. По возможности, результаты серологии обсуждаются на примерах истории болезни в полевых условиях. Особое внимание уделяется следующим ключевым моментам:
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|