|
||||

Совершенствование технологии производства питательной среды для суспензионного культивирования клеток млекопитающихУДК 619:578:616.98:578.828.11 Крюкова Е.Н., Самуйленко А.Я., Мельник Р.Н. ФГБНУ "Всероссийский научно-исследовательский Введение. Для ветеринарной науки и практики представляют значительный интерес стабильные линии перевиваемых клеток сельскохозяйственных и промысловых животных, выведенные в СССР, России и других странах из различных органов и тканей плодов или молодых животных.
Разработка методов культивирования клеток in vitro, освоение этих методов специалистами биофабрик позволила решить многие вопросы реального производства вирусвакцин и диагностикумов. Биофабрики, фирмы, НИИ России выпускают большое количество биопрепаратов, используя первичные культуры клеток, субкультуры, диплоидные штаммы, постоянные линии клеток гибридные и генетически трансформированные культуры клеток животных.
Таким образом, значительно расширился спектр культивируемых клеток, которые могут использоваться не только в научных целях, но и в биотехнологическом производстве вакцин и диагностикумов.
Особо важную роль для жизнедеятельности клеток играют основные аминокислоты - лизин, гистидин, аргинин.
Рассматривая аминокислоты, входящие в состав питательных сред, следует отметить ряд функций, которые они способны выполнять в процессе культивирования: включаться в синтез белка, превращаться в другие аминокислоты, если этих аминокислот нет или они присутствуют в недостаточном количестве, служить источником энергии, если количество глюкозы падает ниже критического уровня, служить исходным материалом для построения других структур, отличных от белков, например, нуклеиновых кислот, и подвергаться целому ряду других превращений.
Специальными исследованиями Игл установили, что для роста и развития клеток позвоночных вне организма необходимы 13 аминокислот. Живому организму необходимы 8 незаменимых аминокислот (изолейцин, лейцин, лизин, метионин, фенилалан, треонин, триптофан, валин), изолированной клетке кроме этих аминокислот требуются еще пять: аргинин, глютамин, гистидин, тирозин, цистин.
Незаменимость отдельных компонентов для развития клеточных культур нельзя рассматривать как абсолютный факт, так как потребность в определенных веществах может возникнуть в связи с отсутствием каких- либо интермедиантов или из-за низкой плотности популяции. Так, дефицит в среде фолиевой кислоты делает незаменимыми глицин, отсутствие пиродоксаля, имеющего большое значение в биосинтезе заменимых аминокислот (аланина, серина, глицина, пролина) вызывает необходимость внесения в питательную среду для поддержания роста клеток этих, считающихся заменимыми, аминокислот. Такие незаменимые факторы как цистин, глютамин, инозитол при высокой концентрации клеток становятся заменимыми и могут синтезироваться клетками.
Пока неизвестно, каким образом внутриклеточный запас аминокислот влияет на белковый синтез и рост клеток. Содержание белка в клетках зависит от их типа, плотности популяции и состава питательной среды. Работа выполнялась в соответствии с техническим заданием и календарным планом "научно-методического сопровождения освоения в производстве питательной среды для суспензионного культивирования клеток млекопитающих". Данная работа проводилась по научнометодическому сопровождению, направленная на освоение в производстве питательной среды для суспензионного культивирования клеток млекопитающих на производственных площадях Федерального Государственного предприятия "Щелковский биокомбинат", которая полностью выполнена в соответствии с "Техническим заданием" и "Календарным планом".
Нашей задачей явилось повышение качества целевого продукта за счет увеличения клеток млекопитающих при их суспензионном культивировании.
Материалы и методы исследований. Работа была выполнена с 2013 по 2015 год в отделе противобактериальных препаратов в ГНУ "Всероссийский научно-исследовательский и технологический институт биологической промышленности", Российской Академии Наук в рамках задания Российской научно-технологической программы фундаментальных и приоритетных и прикладных исследований по научному обеспечению АПК РФ.
Результаты исследований. Поставленную задачу решали в питательной среде для суспензионного культивирования клеток млекопитающих, содержащей натрий хлористый, калий хлористый, магний сернокислый, натрий фосфорнокислый двузамещенный, калий фосфорнокислый однозамещенный, кальций хлористый, натрий двууглекислый, L- аргинин, L-глутамин, L-тирозин, L-триптофан, пантотенат кальция, пиридоксаль НС1, тиамин, мезо-инозит, никотинамид, рибофлавин, фолиевую кислоту, глюкозу, ферментативный гидролизат мышечных белков, ферментативный гидролизат лактальбумина, бен-зилпенициллина натриевую соль, канамицина сульфат, противогрибковый препарат и дистиллированную воду, тем, что в качестве противогрибкового препарата содержит нистатин с активностью от 6*104 до 6,5*104ЕД/л и дополнительно содержит холина хлорид и янтарную кислоту, причем бензилпеницилин натриевая соль используется с активностью 0,09*105 - 1,1*105, а канамицин сульфат - с активностью 0,09*105 - 1,1*105ЕД/л.
Нами впервые установлено, что использование предлагаемого технического решения в заявляемых режимах позволяет повысить производство клеток млекопитающих при суспензионном их культивировании.
Растворение компонентов питательной среды вели в дистиллированной воде, имеющей температуру 35-40°С, при непрерывном перемешивании. В начале растворяют антибиотики и навески солей поочередно (хлористый натрий, хлористый калий, кальций пантотенат. калий фосфорнокислый однозамещенный, натрий фосфорнокислый двузамещенный) до полного растворения предыдущей навески, далее вносят навеску глюкозы. Дополнительно к механическому перемешиванию осуществляют перемешивание сжатым воздухом, то есть барботирование в течение 10-15-ти минут. После растворения навесок убирают барботирование. В глюкозосолевой раствор осторожно, тонкой струйкой при механическом перемешивании вносят хлористый кальций в виде 40%-ного раствора и вновь барботируют. Из указанного в таблице количества гидролизата мышечных белков ферментативного сухого и гидролизата лактальбумина ферментативного готовят 10-12%-ный раствор и вносят его в полученный глюкозосолевой раствор, и растворяют в течение 10-15-ти минут перемешиванием и барботированием.
Отдельно растворяют аминокислоты. Растворение навесок проводят последовательно согласно прописи питательной среды в таблице 1.
Таблица 1. Наиболее широко используемые питательные среды
L-тирозин растворяют отдельно в небольшом количестве дистиллированной воды при нагревании до кипения с добавлением: по каплям концентрированной соляной кислоты до полного просветления раствора.
Все витамины последовательно растворяли в небольшом количестве дистиллированной воды комнатной температуры. При этом каждую последующую навеску растворяли только после полного растворения предыдущей. Рибофлавин и фолиевую кислоту растворяют отдельно в небольшом количестве дистиллированной воды комнатной температуры с добавлением по каплям 20-25%-ного раствора NaOH до полного растворения навесок. Сначала растворяли рибофлавин. затем фолиевую кислоту, при растворении которой необходимо вновь по каплям вносить 20-25%-ный раствор NaOH до полного просветления раствора.
В глюкозосолевой раствор вносили растворы аминокислот, витаминов, сыворотку, натрий двууглекислый и перемешивают. После внесения в среду всех необходимых компонентов добавляют янтарную кислоту и дистиллированную воду до необходимого объема, перемешивали, стерилизовали фильтрацией и вносили в реактор для культивирования клеток.
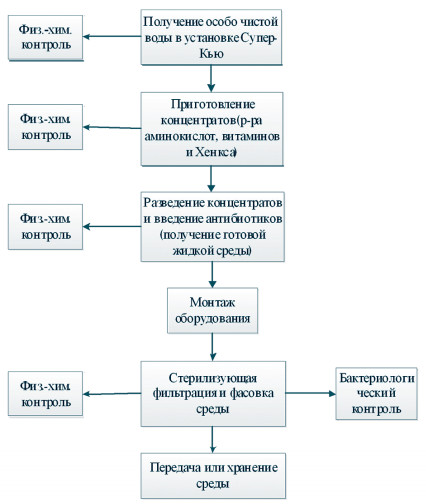
Питательная среда для суспензионного культивирования клеток ВНК-21/13-13 представляет собой растворенную в сверхочищенной воде смесь неорганических солей, аминокислот, витаминов, гидролизатов, глюкозы, антибиотиков и сыворотки крупного рогатого скота, простерилизованную фильтрованием через мембраны с размером пор 0,22 мкм (рисунок 1). По внешнему виду - это прозрачная, светло-соломенного цвета жидкость, со слабым запахом, гидролизата, без опалесценции и осадка.
Рис. 1. Технологическая схема производства питательной среды для суспензионного культивирования клеток ВНК-21/13-13 Питательная среда должна иметь следующие физико-химические показатели:
1. Величина рН 7,0±0,2 (без сыворотки); 7,2±0,2 (с сывороткой).
2. Осмомоляльность или показатель криоскопии: от -0,62 до -0,70 °С.
3. Буферная емкость 3,5±0,5 мг экв. НС1/л.
Стерильность среды концентрируют по ГОСТ 28085-89 (СТ СЭВ 6280-88). Среду фасуют в 5 л бутыли, укупоривают резиновыми пробками, фольгой и бумагой "Крафт". Хранят при 20°С в течение 12-ти месяцев. В случае необходимости среду фильтруют в реакторы для культивирования.
Питательные среды обеспечивали накопление клеток, при суспензионном культивировании перевиваемой линии ВНК-21 до (3,9-4,2)-106 кл./см3 в сравнении с известным техническим решением, где максимальное накопление клеток составило 3,5-106 кл./см3.
В таблице 2 представлены показатели производственных серий сред для суспензионного культивирования клеток ВНК-21/13-13, выборочные данные серий показывают стабильность промышленного производства питательных сред, где воду для производства использовали с установки super Q, до фильтрации рН среды выдерживали в диапазоне показателей от 7,16 до 7,48; At - показатель криоскопии - концентрация растворов солей, определили на приборе при точке замерзания от 0,60 до 0,61; Б - буферная емкость раствора, оттит-ровывали 0,1н раствором НС1, показатель соответствовал от 2,95 до 4,1; рН после фильтрации выдерживали в диапазоне 7,24-7,48; объем каждой серии соответствовал 1262,4 л - (одна тысяча двести шестьдесят два литра). При фильтрации использовали фильтры Millistak - глубинная фильтрация через пластины с размером пор 0,8-0,45р, пред-фильтрацию проводили фильтрами патронного типа с размером пор - 0,5р фильтры Полисепт, стерилизацию проводили так же фильтрами патронного типа Durapore с размером пор -0,22р. Таблица 2. Показатели производственных серий сред для суспензионного культивирования клеток ВНК-21/13-13
Заключение. Таким образом, данное научное внедрение в производство - конструирование питательной среды для суспензионного культивирования клеток млекопитающих - позволяет повысить выход культуры клеток млекопитающих на 11-20%.
Список литературы:
Резюме. Для ветеринарной науки и практики представляют значительный интерес стабильные линии перевиваемых клеток сельскохозяйственных и промысловых животных, выведенные из различных органов и тканей плодов или молодых животных. В последние годы расширился спектр культивируемых клеток, которые могут использоваться не только в научных целях, но и в биотехнологическом производстве вакцин и диагностикумов. Особо важную роль для жизнедеятельности клеток играют основные аминокислоты - лизин, гистидин, аргинин. Разработка методов культивирования клеток in vitro, освоение этих методов специалистами биофабрик позволила решить многие вопросы реального производства вирусвакцин и диагностикумов. Пока неизвестно, каким образом внутриклеточный запас аминокислот влияет на белковый синтез и рост клеток, но содержание белка в клетках зависит от их типа, плотности популяции и состава питательной среды. В статье представлены научные данные по совершенствованию технологии производства питательной среды для суспензионного культивирования клеток млекопитающих. По результатам литературного анализа показаны основные аминокислоты, входящие в состав питательных сред, и их основные функции, которые они способны выполнить в процессе культивирования клеток млекопитающих. Техническим результатом исследований является создание экономически выгодной питательной среды для суспензионного культивирования клеток ВНК-21 в условиях массового биопроизводства при изготовлении культуральных вакцин. Питательная среда обеспечивает накопление клеток, при суспензионном культивировании перевиваемой линии ВНК -21 до (3,9-4,2) - 106кл/см3 в сравнении с известным техническим решением, где максимальное накопление клеток составило 3,5-106кл/см3. Таким образом, техническое решение конструирования питательной среды для суспензионного культивирования клеток млекопитающих позволяет повысить выход культуры клеток млекопитающих.
Ключевые слова: аминокислоты, питательная среда, культура клеток, белковый синтез, рост клеток, фильтры, реакторы, технологические схемы производства, суспензионное культивирование, буферная ёмкость, титрование. Сведения об авторах:
Крюкова Елена Николаевна, соискатель ФГБНУ "Всероссийский научноисследовательский и технологический институт биологической промышленности"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(985)3948012; e-mail: krukovaen@biocombinat.ru.
Самуйленко Анатолий Яковлевич, доктор ветеринарных наук, академик РАН, директор ФГБНУ "Всероссийский научно-исследовательский и технологический институт биологической промышленности"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(910)4253914; e-mail: vnitibp@mail.ru.
Ельников Василий Викторович, кандидат биологических наук, главный технолог ФКП "Щелковский биокомбинат"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(983)948035; e-mail: velnikov@yandex.ru.
Красуткин Сергей Николаевич, кандидат биологических наук, советник противовирусного производства ФКП "Щелковский биокомбинат"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(985)3948031; e-mail: krasotkin@biocombinat.ru.
Литенкова Ирина Юрьевна, кандидат ветеринарных наук, главный технолог научно-исследовательской работы ФКП "Щелковский биокомбинат"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(985)3948034; e-mail: litenkova2012@mail.ru.
Мельник Николай Васильевич, доктор ветеринарных наук, профессор, президент Национальной Ассоциации ветеринарно-биологической промышленности (Ассоциация "Ветбиопром"); 107139, г. Москва, ул. Садово-Спасская, д. 11/1; тел.: 8(905)5450346; e-mail: a-vbp@mail.ru.
Боровой Владимир Николаевич, кандидат ветеринарных наук, директор Департамента ветеринарии Министерства сельского хозяйства Российской Федерации; 107139, г. Москва, ул. Садово-Спасская, д. 11/1; тел.: 8(916)2369350; e-mail: borovoi-vn@mail.ru.
Дресвянникова Светлана Георгиевна, кандидат ветеринарных наук, начальник ГКУ КСББЖ "Краснодарская"; 350004, г. Краснодар, ул. Калинина. 15/1; тел.: 8(861)2216360; e-mail: kraivet.dsg@mail.ru.
Ответственный за переписку с редакцией: Мельник Роман Николаевич, кандидат биологических наук, заведующий отделом ФГБНУ "Всероссийский научно-исследовательский и технологический институт биологической промышленности"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(926)8510696; e-mail: romanos@mail.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|