УДК 619:578:616.98:578.828.11
Крюкова Е.Н., Самуйленко А.Я., Мельник Р.Н. ФГБНУ "Всероссийский научно-исследовательский
и технологический институт биологической промышленности", Московская область, пос. Биокомбината
Ельников В.В., Красуткин С.Н., Литенкова И.Ю. ФКП "Щелковский биокомбинат", Московская область, пос. Биокомбината
Мельник Н.В. "Национальная Ассоциация ветеринарно-биологической промышленности" ("Ветбиопром"), г. Москва
Боровой В.Н. Департамент ветеринарии МСХ РФ, г. Москва
Дресвянникова С.Г. ГКУ КСББЖ "Краснодарская", г. Краснодар
Введение. Для ветеринарной науки и практики представляют значительный интерес стабильные линии перевиваемых клеток сельскохозяйственных и промысловых животных, выведенные в СССР, России и других странах из различных органов и тканей плодов или молодых животных.
Разработка методов культивирования клеток in vitro, освоение этих методов специалистами биофабрик позволила решить многие вопросы реального производства вирусвакцин и диагностикумов. Биофабрики, фирмы, НИИ России выпускают большое количество биопрепаратов, используя первичные культуры клеток, субкультуры, диплоидные штаммы, постоянные линии клеток гибридные и генетически трансформированные культуры клеток животных.
Таким образом, значительно расширился спектр культивируемых клеток, которые могут использоваться не только в научных целях, но и в биотехнологическом производстве вакцин и диагностикумов.
Особо важную роль для жизнедеятельности клеток играют основные аминокислоты - лизин, гистидин, аргинин.
Рассматривая аминокислоты, входящие в состав питательных сред, следует отметить ряд функций, которые они способны выполнять в процессе культивирования: включаться в синтез белка, превращаться в другие аминокислоты, если этих аминокислот нет или они присутствуют в недостаточном количестве, служить источником энергии, если количество глюкозы падает ниже критического уровня, служить исходным материалом для построения других структур, отличных от белков, например, нуклеиновых кислот, и подвергаться целому ряду других превращений.
Специальными исследованиями Игл установили, что для роста и развития клеток позвоночных вне организма необходимы 13 аминокислот. Живому организму необходимы 8 незаменимых аминокислот (изолейцин, лейцин, лизин, метионин, фенилалан, треонин, триптофан, валин), изолированной клетке кроме этих аминокислот требуются еще пять: аргинин, глютамин, гистидин, тирозин, цистин.
Незаменимость отдельных компонентов для развития клеточных культур нельзя рассматривать как абсолютный факт, так как потребность в определенных веществах может возникнуть в связи с отсутствием каких- либо интермедиантов или из-за низкой плотности популяции. Так, дефицит в среде фолиевой кислоты делает незаменимыми глицин, отсутствие пиродоксаля, имеющего большое значение в биосинтезе заменимых аминокислот (аланина, серина, глицина, пролина) вызывает необходимость внесения в питательную среду для поддержания роста клеток этих, считающихся заменимыми, аминокислот. Такие незаменимые факторы как цистин, глютамин, инозитол при высокой концентрации клеток становятся заменимыми и могут синтезироваться клетками.
Пока неизвестно, каким образом внутриклеточный запас аминокислот влияет на белковый синтез и рост клеток. Содержание белка в клетках зависит от их типа, плотности популяции и состава питательной среды.
Работа выполнялась в соответствии с техническим заданием и календарным планом "научно-методического сопровождения освоения в производстве питательной среды для суспензионного культивирования клеток млекопитающих". Данная работа проводилась по научнометодическому сопровождению, направленная на освоение в производстве питательной среды для суспензионного культивирования клеток млекопитающих на производственных площадях Федерального Государственного предприятия "Щелковский биокомбинат", которая полностью выполнена в соответствии с "Техническим заданием" и "Календарным планом".
Нашей задачей явилось повышение качества целевого продукта за счет увеличения клеток млекопитающих при их суспензионном культивировании.
Материалы и методы исследований. Работа была выполнена с 2013 по 2015 год в отделе противобактериальных препаратов в ГНУ "Всероссийский научно-исследовательский и технологический институт биологической промышленности", Российской Академии Наук в рамках задания Российской научно-технологической программы фундаментальных и приоритетных и прикладных исследований по научному обеспечению АПК РФ.
Результаты исследований. Поставленную задачу решали в питательной среде для суспензионного культивирования клеток млекопитающих, содержащей натрий хлористый, калий хлористый, магний сернокислый, натрий фосфорнокислый двузамещенный, калий фосфорнокислый однозамещенный, кальций хлористый, натрий двууглекислый, L- аргинин, L-глутамин, L-тирозин, L-триптофан, пантотенат кальция, пиридоксаль НС1, тиамин, мезо-инозит, никотинамид, рибофлавин, фолиевую кислоту, глюкозу, ферментативный гидролизат мышечных белков, ферментативный гидролизат лактальбумина, бен-зилпенициллина натриевую соль, канамицина сульфат, противогрибковый препарат и дистиллированную воду, тем, что в качестве противогрибкового препарата содержит нистатин с активностью от 6*104 до 6,5*104ЕД/л и дополнительно содержит холина хлорид и янтарную кислоту, причем бензилпеницилин натриевая соль используется с активностью 0,09*105 - 1,1*105, а канамицин сульфат - с активностью 0,09*105 - 1,1*105ЕД/л.
Нами впервые установлено, что использование предлагаемого технического решения в заявляемых режимах позволяет повысить производство клеток млекопитающих при суспензионном их культивировании.
Растворение компонентов питательной среды вели в дистиллированной воде, имеющей температуру 35-40°С, при непрерывном перемешивании. В начале растворяют антибиотики и навески солей поочередно (хлористый натрий, хлористый калий, кальций пантотенат. калий фосфорнокислый однозамещенный, натрий фосфорнокислый двузамещенный) до полного растворения предыдущей навески, далее вносят навеску глюкозы. Дополнительно к механическому перемешиванию осуществляют перемешивание сжатым воздухом, то есть барботирование в течение 10-15-ти минут. После растворения навесок убирают барботирование. В глюкозосолевой раствор осторожно, тонкой струйкой при механическом перемешивании вносят хлористый кальций в виде 40%-ного раствора и вновь барботируют. Из указанного в таблице количества гидролизата мышечных белков ферментативного сухого и гидролизата лактальбумина ферментативного готовят 10-12%-ный раствор и вносят его в полученный глюкозосолевой раствор, и растворяют в течение 10-15-ти минут перемешиванием и барботированием.
Отдельно растворяют аминокислоты. Растворение навесок проводят последовательно согласно прописи питательной среды в таблице 1.
Таблица 1. Наиболее широко используемые питательные среды
| Питательная среда | Особенности состава и применение |
|---|---|
| Среда 199 | Широко используемая многокомпонентная среда, оригинально предназначалась и использовалась для производства полиовируса. Рекомендуется для применения в диагностике вирусных инфекций |
| Основная среда Игла, ВМЕ | Обычно используемая среда с минимальным набором аминокислот и витаминов. Оригинально предназначалась для культивирования клеток HeLa, KB и т.п. |
| Основная среда Игла для культивирования диплоидных клеток, ВМЕ- диплоид | По сравнению с ВМЕ MgS04 заменен на MgCI2 удален i-инозитол |
| Минимальная среда Игла MEM | По сравнению с ВМЕ в 5 раз увеличено содержание аргинина, в 4 раза - гистидина, двукратный набор остальных аминокислот, кроме глютамина, удален биотин. Используется для культивирования большинства перевиваемых линий клеток с повышенными требованиями к составу питательной среды. Позволяет поддерживать культуры длительное время без подкормки |
| Минимальная среда Игла для суспензионных культур, MEMS | По сравнению с MEM удален СаС12 повышено содержание NaH2P04, зачастую дополняется карбоксиметилцеллюлозой |
| Среда Игла в модификации Дюльбекко, ДМЕМ | По сравнению с ВМЕ вдвое увеличен глютамин, добавлен глицин и серин; витамины и аминокислоты увеличены примерно в 4 раза. Присутствуют минимальные количества Fe(N03)3. Оригинально использовалась для выращивания вируса полиомы в первичных культурах клеток эмбрионов мыши |
| Среда Хэма, Р-10, F-12 | Имеет сбалансированный оптимизированный состав, поддерживающий при добавлении белковых фракций сыворотки клональный рост диплоидных клеток китайского хомячка. При добавлении сыворотки представляет собой одну из самых питательных сред, пригодную для выращивания большинства клеточных линий |
| Среда Мак-Коя, МсКоу 5 а (RPM- 1629) | Среда используется для культивирования лейкоцитов, материала биопсий и наиболее требовательных первичных и перевиваемых культур. Требует добавления 10—30% эмбриональной телячьей сыворотки |
| Среда Фишера | Поддерживает рост ряда линий мышечных лейкемических клеток |
| Среда Лейбовица L-15 | В буферной системе отсутствует бикарбонат натрия, что позволяет выращивать клетки в условиях контакта с открытой атмосферой. Глюкоза заменена галактозой |
| Среда NCTC 109 | Оригинально создана как химически определенная среда для выращивания клеток Z-929. При добавлении сыворотки хорошо поддерживает рост клеточных линий. Среда СТС 135 идентична ей по составу, но содержит 1-цистин |
L-тирозин растворяют отдельно в небольшом количестве дистиллированной воды при нагревании до кипения с добавлением: по каплям концентрированной соляной кислоты до полного просветления раствора.
Все витамины последовательно растворяли в небольшом количестве дистиллированной воды комнатной температуры. При этом каждую последующую навеску растворяли только после полного растворения предыдущей. Рибофлавин и фолиевую кислоту растворяют отдельно в небольшом количестве дистиллированной воды комнатной температуры с добавлением по каплям 20-25%-ного раствора NaOH до полного растворения навесок. Сначала растворяли рибофлавин. затем фолиевую кислоту, при растворении которой необходимо вновь по каплям вносить 20-25%-ный раствор NaOH до полного просветления раствора.
В глюкозосолевой раствор вносили растворы аминокислот, витаминов, сыворотку, натрий двууглекислый и перемешивают. После внесения в среду всех необходимых компонентов добавляют янтарную кислоту и дистиллированную воду до необходимого объема, перемешивали, стерилизовали фильтрацией и вносили в реактор для культивирования клеток.
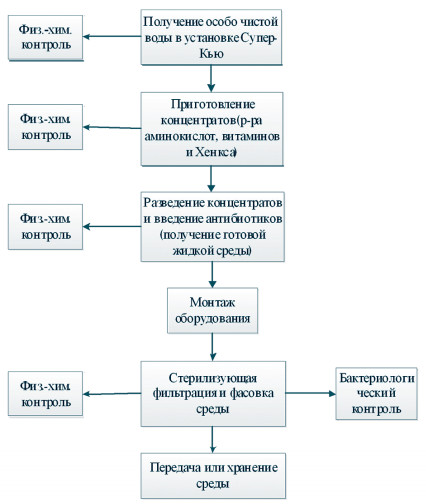
Питательная среда для суспензионного культивирования клеток ВНК-21/13-13 представляет собой растворенную в сверхочищенной воде смесь неорганических солей, аминокислот, витаминов, гидролизатов, глюкозы, антибиотиков и сыворотки крупного рогатого скота, простерилизованную фильтрованием через мембраны с размером пор 0,22 мкм (рисунок 1). По внешнему виду - это прозрачная, светло-соломенного цвета жидкость, со слабым запахом, гидролизата, без опалесценции и осадка.

Рис. 1. Технологическая схема производства питательной среды для суспензионного культивирования клеток ВНК-21/13-13
Питательная среда должна иметь следующие физико-химические показатели:
1. Величина рН 7,0±0,2 (без сыворотки); 7,2±0,2 (с сывороткой).
2. Осмомоляльность или показатель криоскопии: от -0,62 до -0,70 °С.
3. Буферная емкость 3,5±0,5 мг экв. НС1/л.
Стерильность среды концентрируют по ГОСТ 28085-89 (СТ СЭВ 6280-88). Среду фасуют в 5 л бутыли, укупоривают резиновыми пробками, фольгой и бумагой "Крафт". Хранят при 20°С в течение 12-ти месяцев. В случае необходимости среду фильтруют в реакторы для культивирования.
Питательные среды обеспечивали накопление клеток, при суспензионном культивировании перевиваемой линии ВНК-21 до (3,9-4,2)-106 кл./см3 в сравнении с известным техническим решением, где максимальное накопление клеток составило 3,5-106 кл./см3.
В таблице 2 представлены показатели производственных серий сред для суспензионного культивирования клеток ВНК-21/13-13, выборочные данные серий показывают стабильность промышленного производства питательных сред, где воду для производства использовали с установки super Q, до фильтрации рН среды выдерживали в диапазоне показателей от 7,16 до 7,48; At - показатель криоскопии - концентрация растворов солей, определили на приборе при точке замерзания от 0,60 до 0,61; Б - буферная емкость раствора, оттит-ровывали 0,1н раствором НС1, показатель соответствовал от 2,95 до 4,1; рН после фильтрации выдерживали в диапазоне 7,24-7,48; объем каждой серии соответствовал 1262,4 л - (одна тысяча двести шестьдесят два литра). При фильтрации использовали фильтры Millistak - глубинная фильтрация через пластины с размером пор 0,8-0,45р, пред-фильтрацию проводили фильтрами патронного типа с размером пор - 0,5р фильтры Полисепт, стерилизацию проводили так же фильтрами патронного типа Durapore с размером пор -0,22р.
Таблица 2. Показатели производственных серий сред для суспензионного культивирования клеток ВНК-21/13-13
| № серии | Вода с установки super-Q | До фильтрации | После фильтрации | Объем |
|---|---|---|---|---|
| 12 | + | pH = 7,48 | pH = 7,48 | 1262,4л |
| 29 | + | pH = 7,22 | pH = 7,24 | 1262,4л |
| 13 | + | pH = 7,46 | pH = 7,48 | 1262,4л |
| 32 | + | pH = 7,14 | pH = 7,24 | 1262,4л |
| 35 | + | pH = 7,16 | pH = 7,24 | 1262,4л |
Заключение. Таким образом, данное научное внедрение в производство - конструирование питательной среды для суспензионного культивирования клеток млекопитающих - позволяет повысить выход культуры клеток млекопитающих на 11-20%.
Список литературы:
Резюме. Для ветеринарной науки и практики представляют значительный интерес стабильные линии перевиваемых клеток сельскохозяйственных и промысловых животных, выведенные из различных органов и тканей плодов или молодых животных. В последние годы расширился спектр культивируемых клеток, которые могут использоваться не только в научных целях, но и в биотехнологическом производстве вакцин и диагностикумов. Особо важную роль для жизнедеятельности клеток играют основные аминокислоты - лизин, гистидин, аргинин. Разработка методов культивирования клеток in vitro, освоение этих методов специалистами биофабрик позволила решить многие вопросы реального производства вирусвакцин и диагностикумов. Пока неизвестно, каким образом внутриклеточный запас аминокислот влияет на белковый синтез и рост клеток, но содержание белка в клетках зависит от их типа, плотности популяции и состава питательной среды. В статье представлены научные данные по совершенствованию технологии производства питательной среды для суспензионного культивирования клеток млекопитающих. По результатам литературного анализа показаны основные аминокислоты, входящие в состав питательных сред, и их основные функции, которые они способны выполнить в процессе культивирования клеток млекопитающих. Техническим результатом исследований является создание экономически выгодной питательной среды для суспензионного культивирования клеток ВНК-21 в условиях массового биопроизводства при изготовлении культуральных вакцин. Питательная среда обеспечивает накопление клеток, при суспензионном культивировании перевиваемой линии ВНК -21 до (3,9-4,2) - 106кл/см3 в сравнении с известным техническим решением, где максимальное накопление клеток составило 3,5-106кл/см3. Таким образом, техническое решение конструирования питательной среды для суспензионного культивирования клеток млекопитающих позволяет повысить выход культуры клеток млекопитающих.
Ключевые слова: аминокислоты, питательная среда, культура клеток, белковый синтез, рост клеток, фильтры, реакторы, технологические схемы производства, суспензионное культивирование, буферная ёмкость, титрование.
Сведения об авторах:
Крюкова Елена Николаевна, соискатель ФГБНУ "Всероссийский научноисследовательский и технологический институт биологической промышленности"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(985)3948012; e-mail: krukovaen@biocombinat.ru.
Самуйленко Анатолий Яковлевич, доктор ветеринарных наук, академик РАН, директор ФГБНУ "Всероссийский научно-исследовательский и технологический институт биологической промышленности"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(910)4253914; e-mail: vnitibp@mail.ru.
Ельников Василий Викторович, кандидат биологических наук, главный технолог ФКП "Щелковский биокомбинат"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(983)948035; e-mail: velnikov@yandex.ru.
Красуткин Сергей Николаевич, кандидат биологических наук, советник противовирусного производства ФКП "Щелковский биокомбинат"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(985)3948031; e-mail: krasotkin@biocombinat.ru.
Литенкова Ирина Юрьевна, кандидат ветеринарных наук, главный технолог научно-исследовательской работы ФКП "Щелковский биокомбинат"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(985)3948034; e-mail: litenkova2012@mail.ru.
Мельник Николай Васильевич, доктор ветеринарных наук, профессор, президент Национальной Ассоциации ветеринарно-биологической промышленности (Ассоциация "Ветбиопром"); 107139, г. Москва, ул. Садово-Спасская, д. 11/1; тел.: 8(905)5450346; e-mail: a-vbp@mail.ru.
Боровой Владимир Николаевич, кандидат ветеринарных наук, директор Департамента ветеринарии Министерства сельского хозяйства Российской Федерации; 107139, г. Москва, ул. Садово-Спасская, д. 11/1; тел.: 8(916)2369350; e-mail: borovoi-vn@mail.ru.
Дресвянникова Светлана Георгиевна, кандидат ветеринарных наук, начальник ГКУ КСББЖ "Краснодарская"; 350004, г. Краснодар, ул. Калинина. 15/1; тел.: 8(861)2216360; e-mail: kraivet.dsg@mail.ru.
Ответственный за переписку с редакцией: Мельник Роман Николаевич, кандидат биологических наук, заведующий отделом ФГБНУ "Всероссийский научно-исследовательский и технологический институт биологической промышленности"; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8(926)8510696; e-mail: romanos@mail.ru.
http://vetkuban.com/num2_201602.html