|
||||

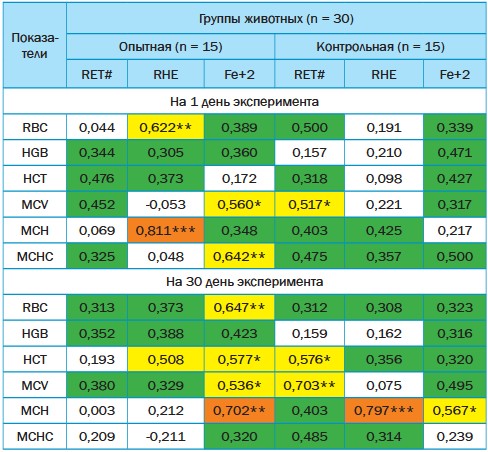
Влияние антиоксидантных средств на гематологические параметры сыворотки крови и электролитный обмен при цистолитиазе струвитного типа у кошекУДК 619:616-07(08):616.6 Ушакова Т.М., Чичиленко В. С. Федеральное государственное бюджетное образовательное учреждение высшего Хроническое течение цистолитиаза струвитного типа [1, 2, 3, 4, 5] и развитие метаболических нарушений [6, 7, 8, 9, 10] сопряжено с процессами активации перекисного окисления липидов. Доказано, что важным фактором риска развития и прогрессии многих патологий, в том числе и болезней урогенитального тракта, является развитие окислительного стресса клеток [11]. С целью коррекции нарушений окислительного метаболизма клетки и защиты их от патологического воздействия активных форм кислорода назначают антиоксидантные средства. Доказано, что антиоксиданты способны не только нейтрализовать свободные радикалы, но и снижать уровень воспалительного процесса, а также улучшать микроциркуляции в тканях [12], что позволит более эффективно осуществлять разработанную стратегию коррекции. Понимание характера влияния антиоксидантных средств на гематологические параметры сыворотки крови и электролитный обмен при цистоли-тиазе струвитного типа у кошек может помочь в разработке мультимодального протокола лечения при данной патологии и повысить эффективность не только терапевтического воздействия стандартных схем лечения и снизить вероятность рецидивирования формирования уроконкрементов. Целью представленных исследований являлось изучение характера гемопоэза и уровня минерального обмена у кошек с признаками цистолити-аза струвитного типа, а также степени интеркорреляции между маркерами обмена железа и показателями красной крови в динамике под влиянием антиоксидантных средств. Материалы и методы исследований. Для осуществления экспериментальных исследований были отобраны 30 беспородных кошек с клиническим проявлением цистолитиаза струвитного типа, имеющие характерную акустическую картину мочевого пузыря. Из подопытных животных по принципу были сформированы две экспериментальные группы - опытная и контрольная. Каждая группа включала в себя по пятнадцать кастрированных котов в возрасте от восьми до десяти лет с массой тела 4,59±0,46 кг и 4,67±0,72 кг. Оценку уровня гематологических параметров сыворотки крови у подопытных животных осуществляли с использованием стандартных методов импеданса проточной жидкости, лазерного рассеяния, колориметрический метод для измерения концентрации HGB и технологию анализа клеток SF Cube для дифференциации и подсчета клеток на гематологическом анализаторе крови «Mindray BC-60R Vet» (ветеринарная клиника ООО «Ветеринарный центр № 1», г. Батайск). Биохимическое исследование сыворотки крови больных животных было осуществлено в «Сеть ветеринарных лабораторий «ВЕТЛАБ» (г. Ростов-на-Дону). Кошкам из опытной группы помимо основной схемы лечения (конве-ния, уролекс, этамзилат, Д-манноза комплекс, гептрал, цианокобаламин 0,5 мг/мл раствор для инъекций, uri-ease витаминный гель для кошек) назначали антиоксидантные средства (эмицидин, L-глютатион, супероксиддимутаза SOD Power, закваска пропионовокислых бактерий «Пропио-никс»). Лечебные мероприятия осуществлялась на фоне применения диетического рациона Cat Urinary Struvite Fit-aroma: Vaccinium macrocarpon. Животным контрольной группы задавали стандартную схему лечения при уролитиазе струвитного типа (синулокс, цистон, гепасейф, лечебный рацион Royal Canin Urinary S/O Feline). Характер изменений гематологических параметров сыворотки крови и электролитного обмена оценивали по результатам данных, собранных от подопытных на 1 и 30 день эксперимента. Полученные результаты обрабатывали с использованием методом вариационной статистики. Оценку взаимосвязи между маркерами обмена железа и показателями красной крови у кошек осуществляли непараметрическим методом с использованием коэффициента ранговой корреляции Спирмена. Обработку результатов исследований проводили методом вариационной статистики с использованием интегрированной системы для комплексного статистического анализа и обработки данных в системе Windows STATISTICA. Оценку взаимосвязи между изучаемыми параметрами осуществляли непараметрическим методом на основании расчета критерия корреляции Спирмена. Результаты исследований и их обсуждение. Данные, полученные при обследовании больных животных обеих групп, указывали на развитие анемического синдрома, что проявлялось снижением концентрации гемоглобина до 83,00±4,90 г/л в опытной группе и до 88,00±6,01 г/л - в контрольной, снижением количественного показателя эритроцитов (RBC -6,10±0,50х1012/л и 5,73±0,83х1012/л) и гематокрита (0,237±0,005% и 0,241±0,007%) (табл. 1). При этом эритроциты были представлены нормоцитами (MCV - 38,90±2,18 фл и 42,10±2,55 фл), а показатели RHE (16,40±1,03 и 16,00±1,14 пг) и RDW-CV (0,188±0,004% и 0,171±0,003) были в пределах референтного интервала, что свидетельствовало о нормальной пролиферативной активности костного мозга и развитии начальной стадии анемии. Параметры WBC у подопытных обеих групп свидетельствовали о развитии воспалительного процесса в организме больных животных, что характеризовалось проявлением нейтрофильного лейкоцитоза (Neu# - 14,06±0,95х109/л и 13,29±1,05х109/л) и эозинопении (Eos# -0,02±0,002х109/л и 0,01±0,001х109/л; Eos% - 0,001±0,0002% и 0,001±0,0003%), при этом в опытной группе относительное количество нейтрофилов было в пределах нормативного показателя. Развитие железодефицитной анемии у котов опытной группы (Fe+2 -11,93±0,50 мкмоль/л) сопровождалось снижением количества тромбоцитов (PLT - 114,00±4,18 х109/л) и тромбокрита (PCT - 1,29±0,06 мл/л) (табл. 1, 2). Как видно из данных таблицы 1, у больных животных было отмечено однонаправленное изменение изучаемых величин, при этом диапазон экстремальных значений большинства показателей не имел различий в обеих экспериментальных группах котов, но в контрольной группе широта распределения RBC была больше на 66,00%, HGB - 22,65%, MCHC - на 16,70%, RDW-SD - на 39,62%, Neu% - на 80,00%, PLT - на 41,15%, PCT -на 50,00%, RET# - на 112,14%, RET% - на 66,64%, IRF - на 223,80%, MFR - на 54,74%, HFR - на 259900,00%, чем в опытной. У кошек из опытной группы вариационный размах Lym# был выше аналогичного показателя из контрольной группы на 211,11%, Eos# - на 100,00%, IPF - на 372,92%, LFR - на 75,24%. Установленный характер изменений обусловлен влиянием индивидуальных особенностей животных и клинического проявления болезни на характер вариабельности изучаемых признаков. На 30 день эксперимента показатели красной крови кошек опытной группы характеризовалась повышением показателя RBC на 85,24% (Р<0,001) по сравнению с уровнем его на 1 день эксперимента, HGB - на 85,54% (Р<0,001) и HCT - на 86,07% (Р<0,001). У животных из контрольной группы был отмечен аналогичный характер изменений индексов RBC, при этом абсолютный показатель RBC повысился на 84,99% (Р<0,001), HGB - на 67,04% (Р<0,001), HCT - на 80,91% (Р<0,001), а также было выявлено снижение средней концентрации гемоглобина в эритроците на 7,67% (Р<0,05) (табл. 1). У котов из опытной группы показатели гетерогенности эритроцитов по объему достоверно снизились: RDW-CV - на 17,55% (Р<0,001), RDW-SD - на 18,79% (Р<0,05). Статистически значимые изменения лейкоцитарного звена гемограммы были выявлены в обеих группах после лечения. Так, у кошек опытной группы отмечалось снижение абсолютного числа WBC на 54,57% (Р<0,001), а также клеток миелоидного ряда, системы мононуклеарных фагоцитов и лимфоидного ряда на 65,79% (Р<0,001), 54,41% (Р<0,001) и 20,05% (Р<0,05) по показателям, соответственно, но абсолютное число Eos# было повышено на 1400,00% (Р<0,001). Аналогичный характер изменений наблюдался и в относительных показателях WBC, так Lym% были достоверно выше на 76,00% (Р<0,01), Eos% - на 3500,00% (Р<0,001) и Bas % - на 100,00% (Р<0,001), хотя все и оставались в рамках референтного интервала, что было обусловлено достаточной вариабельностью лейкоцитарного звена гемограммы. В контрольной группе было выявлено повышение абсолютного числа лимфоцитов на 87,61% (Р<0,001), эозинофилов - на 2800,00% (Р<0,001), базофилов - на 200,00% (Р<0,001), а также относительного числа этих же показателей WBC на 96,05% (Р<0,001), 1900,00% (Р<0,001) и 100,00% (Р<0,001), соответственно. Было отмечено снижение абсолютного и относительного числа моноцитов на 58,69% (Р<0,001) и 58,06% (Р<0,001). Процессы тромбоцитопоэза (IPF) достоверно снизились в 2,28 раза (Р<0,001) в опытной группе и повысились в 1,87 раза (Р<0,001) - в контрольной, при этом у котов из опытной группы абсолютный показатель кровяных пластинок и тромбокрит увеличились в 2,63 раза (Р<0,001) и 2,32 раза (Р<0,001), а в контрольной группе - эти показатели снизились в 1,62 раза (Р<0,001) и 1,76 раза (Р< 0,001), соответственно, но в силу вариабельности тромбоцитарного звена гемограммы все изучаемые показатели остались в рамках нормативных значений. На 30 день эксперимента показатели ретикулоцитарных индексов у кошек опытной группы характеризовались достоверным повышением абсолютного числа ретикулоцитов в 2,44 раза (Р<0,001) и фракции больших зрелых ретикулоцитов (HFR) в 100,00 раз (Р<0,001) за счет активации кроветворения в гемопоэтической ткани. В контрольной группе было отмечено снижением RET# в 1,53 раза (Р<0,01), RET% в 2,69 раза (Р<0,001), и изменения фракционного состава ретикулоцитов, характеризующиеся. уменьшением незрелой фракции (IRF) и больших зрелых ретикулоцитов (HFR) в 1,37 раза (Р<0,01) и 2,28 раз (Р<0,001), а фракция малых зрелых ретикулоцитов (LFR) увеличилась в 1,13 раза (Р<0,05).Уровень маркера железо-рестриктивного эритропоэза (RHE) не имел достоверных изменений в обеих подопытных группах на протяжении всего эксперимента. У больных котов было отмечено однонаправленное изменение изучаемых величин, характеризующееся повышением уровня фосфора неорганического и осмолярности сыворотки крови, снижением показателя железа и магния (табл. 2). В рамках выборки диапазон экстремальных значений большинства показателей не имел различий, однако в силу индивидуальной вариабельности изучаемых величин водно-электролитного обмена широта распределения P+3 в опытной группе была больше на 73,33%, Cl- - 25,00% и осмолярности - на 50,00%, чем в контрольной, а вариационный размах уровня Ca+2 у кошек из контрольной группы был выше аналогичного показателя опытной группы на 42,85 %, Fe+2- на 36,00%. Данные факт подтверждает влияние индивидуальных особенностей животных и клинического проявления болезни на характер вариабельности признаков. Применение разработанной схемы коррекции способствовало оптимизации водно - солевого обмена, однако динамика этого процесса по группам различна. После опыта уровень фосфора неорганического в крови животных из опытной группы был достоверно ниже в 1,12 раза (Р<0,001), чем в контрольной группе, хлора - в 1,01 раза (Р<0,05) и осмолярности - в 1,00 раза (Р<0,001), а железа и магния выше в 1,21 раза (Р<0,001) и 1,12 раза (Р<0,001). Результаты расчета коэффициента ранговой корреляции Спирмена между маркерами обмена железа и показателями красной крови у больных кошек свидетельствовали и наличии прямой связи между большинством исследуемых признаков, но средний объем эритроцита был обратно взаимосвязан с гемоглобинным эквивалентом в опытной группе (табл. 3). Наибольшее количество корреляций было свойственно гемоглобинному эквивалентому и уровню железа в сыворотке крови, так, гемоглобинный эквивалент имел прямую связь с числом эритроцитов и средним содержанием гемоглобина в эритроцитах в опытной группе. Уровень сывороточного железа в свою очередь имеет достоверную сопряженность со средним объемом эритроцита и средней концентрацией гемоглобина в эритроците. Такое же направление связи было свойственно уровню абсолютного числа эритроцитов и среднему объему эритроцита в контрольной группе. Высокая теснота связи по шкале Чеддока была выявлена лишь у котов из опытной группы между MCH и RHE, также у этих особей отмечалась и заметная теснота интеркорреляции - между RBC и RHE, между MCV и Fe+2 , между MCHC и Fe+2, а в контрольной группе - только заметная (между MCV и RET#). При этом сила связи между MCH и RHE у котов опытной группы превышала аналогичный характер взаимосвязи у контрольной группы на 90,82%, а разница коэффициента корреляции Спирмена между RBC и RHE составила 227,37%, между MCV и Fe+2 - 76,65%, между MCHC и Fe+2 - 28,40%. В контрольной группе теснота связи между MCV и RET# оказалась больше на 14,38% по сравнению с аналогичной интеркорреляционной связью опытной группы. Таблица 3 Характер изменения коррелятивных связей между маркерами обмена железа и показателями красной крови у кошек при коррекции цистолитиаза струвитного типа
Примечание: * - Р< 0,05; ** - Р< 0,01; *** - Р< 0,001 в сравнении с критическим значении критерия Спирмена при данном числе степеней свободы; не выделенные цветом ячейки - слабая теснота (сила) связи по шкале Чеддока (от 0,1 до 0,3); зеленым цветом отмечена умеренная теснота (сила) связи по шкале Чеддока (от 0,3 до 0,5); желтым цветом отмечена заметная теснота (сила) связи по шкале Чеддока (от 0,5 до 0,7); оранжевым цветом отмечена высокая теснота (сила) связи по шкале Чеддока (от 0,7 до 0,9); красным цветом отмечена сильная теснота (сила) связи по шкале Чеддока (от 0,9 до 1,0). Таблица 1 Динамика гематологических параметров сыворотки крови у кошек при коррекции цистолитиаза струвитного типа
Примечание: * - Р< 0,05; ** - Р< 0,01; *** - Р<0,001 по сравнению с показателем на 30 день эксперимента Таблица 2 Показатели водно-электролитного баланса в сыворотке крови у кошек при коррекции цистолитиаза струвитного типа
Примечание: * - Р<0,05; ** - Р<0,01; *** - Р<0,001 по сравнению с показателем на 30 день эксперимента Выявленная обратная корреляция объема эритроцита и гемоглобинного эквивалента у больных животных, после опыта приобрела прямую взаимосвязь, а прямая взаимосвязь между объемом эритроцита и средней концентрацией гемоглобина в эритроците сменилась обратной. У пациентов с более высоким уровнем железа в сыворотке крови (опытная группа) после опыта отметили прямую статистически значимую корреляцию с уровнем RBC, HCT, MCV, MCH, а у кошек с наименьшим количеством ретикулоцитов (контрольная группа) - прямую заметную корреляцию с HCT и MCV, повышение гемоглобинного эквивалента сопряжено с возрастанием корреляционной связи с уровнем среднего содержания гемоглобина в эритроцитах. Репрезентативный характер взаимосвязи изучаемых маркеров обмена железа детерминирован особенностями гемопоэза у подопытных на фоне коррекции цистолитиаза струвитного типа. Пациенты из подопытных групп показали разный характер корреляционной связи между маркерами обмена железа и показателями красной крови после опыта, так у кошек опытной группы, так теснота связи между HCT и RHE стала в 1,36 раза больше, между RBC и Fe+2 - в 1,66 раз, между HCT и Fe+2 - в 1,03 раза, между MCH и Fe+2 - 2,02 раза, а между RBC и RHE , между MCH и RHE и между MCV и Fe+2 регистрировалось ослабление связи в 0,60 раза, 0,26 раза и 0,95 раза, соответственно. В контрольной же группе усиление коррелятивной связи регистрировалось между показателями HCT и RET# в 1,81 раза, между MCV и RET# - в 1,36 раза, между MCH и RHE - в 1,87 раза и между MCH и Fe+2 - в 2,61 раза. Полученные результаты исследований, проведенных на 1 день эксперимента, подтверждали тот факт, что развитие цистолитиаза струвитного типа у кошек сопровождается развитием начальной стадии железодефицитной анемии (RBC, HGB, HCT, RDW-CV, RDW-SD, Fe+2,) за счет нормальной пролиферативной активности костного мозга. Параметры лейкоцитарного звена гемограммы у подопытных свидетельствовали о развитии воспалительного процесса. Показатели водно-электролитного обмена характеризовались повышением уровня P+3, и осмолярности сыворотки крови, снижением показателя Mg+2. На 30 день эксперимента показатели красной крови кошек опытной группы характеризовалась повышением показателя RBC, HGB и HCT, снижением RDW-CV, RDW-SD и показателей ретикулоцитарных индексов (RET# и HFR) за счет активации кроветворения в гемопоэтической ткани за счет ослабления перекисного окисления липидов и повышения резервов антиоксидантной системы организма. В лейкоцитарном звене гемограммы отмечалось снижение абсолютного числа WBC, клеток миелоидного ряда, системы мононуклеарных фагоцитов и лимфоидного ряда за счет устранения воспалительного процесса в урогенитальном тракте у подопытных. Применение разработанной схемы коррекции способствовало оптимизации водно-солевого обмена (P+3, Cl-, осмолярность сыворотки крови, Fe+2, Mg+2). Выявленная обратная корреляция объема эритроцита и гемоглобинного эквивалента у больных животных, после опыта приобрела прямую взаимосвязь, а прямая взаимосвязь между объемом эритроцита и средней концентрацией гемоглобина в эритроците сменилась обратной. Заключение. Полученные результаты проведенных исследований указывали на стабилизацию гемопоэтической функции красного костного мозга у подопытных кошек под влиянием антиоксидантных средств в составе мультимодального алгоритма фармакокоррекции цистолитиаза струвитного типа, а также нормализацию водно-электролитного баланса. Список литературы: 1. Vona R. et al. The Impact of Oxidative Stress in Human Pathology // Focus on Gastrointestinal Disorders. Antioxidants. 2021. No. 10. P. 201. 2. Zuo L. et al. Inflammaging, and oxidative stress in human diseases: From molecular mechanisms to novel treatments // Int. J. Mol. Sci. 2019. No. 20. P. 4472. 3. Ушакова, Т. М. Взаимосвязь лабораторных показателей в оси «печень-почки» у кошек с признаками трипельфосфатного уролитиаза / Т. М. Ушакова, В. С. Чичи-ленко // Известия Оренбургского государственного аграрного университета. 2024. № 2 (106). С. 237-244. 4. Ушакова, Т. М. Установление взаимосвязи между лабораторными показателями в оси «почки-кишечник» у кошек с признаками трипельфосфатного уролитиаза / Т. М. Ушакова, Т. Н. Дерезина, В. С. Чичиленко // Ветеринарная патология. 2024. Т. 23. № 2. С. 31-40. 5. Ушакова, Т. М. Верификация уровня морфофункциональных расстройств гепаторенальной системы у кошек при трипельфосфатном уролитиазе / Т. М. Ушакова, Т. Н. Дерезина, В. С. Чичиленко // Ветеринарная патология. 2023. Т. 22. № 4. С. 35-45. 6. Соболев, В. Е. Нефрология и урология домашней кошки / В. Е. Соболев // Российский ветеринарный журнал. Мелкие домашние и дикие животные. 2011. № 1. С. 35-40. 7. Knoll T. et al. Urolithiasis // Urologe. 2019. No. 58. P. 1271. 8. Kirkali Z. et al. Urinary stone disease: Progress, status, and needs // Urology. 2015. No. 86. P. 651-653. 9. Bacarea A. et al. Discrepancy in results between dipstick urinalysis and urine sediment microscopy // Exp. Ther. Med. 2021. No. 21. P. 538. 10. Gottlieb M. et al. The evaluation and management of urolithiasis in the ED: A review of the literature // Am. J. Emerg. Med. 2018. No. 36. P. 699-706. 11. Волкова, М. В. Современные биомаркеры окислительного стресса, оцениваемые методом иммуноферментного анализа / М. В. Волкова, Ю.И. Рагино // Атеросклероз. 2021. Т. 17 (4). С. 79-92. 12. Свободнорадикальное окисление и атиоксидантная терапия / В. К. Казимирко, В. К. Мальцев, В. Ю. Бутылин [и др.] // Орион. 2004. 160 с. Резюме. Имеющиеся протоколы коррекции цистолитиаза у кошек крайне ограничены, поскольку не учитывают роль оксидативного стресса в патогенезе данного заболевания и возможность применения антиоксидантов в подавлении воспалительного процесса, оптимизации окислительного метаболизма клетки и улучшении микроциркуляции урогенитального тракта. Анализ гематологических параметров сыворотки крови и электролитного обмена под влиянием антиоксидантных средств позволит разработать эффективный мультимодальный протокол лечения при цистолитиазе струвитного типа у кошек. Целью представленных исследований являлось изучение характера гемопоэза и уровня минерального обмена у кошек с признаками цистоли-тиаза струвитного типа, а также степени интеркорреляции между маркерами обмена железа и показателями красной крови в динамике под влиянием антиоксидантных средств. Объект исследований - 30 кошек с клиническим проявлением цистолитиа-за струвитного типа. В ходе исследований были использованы стандартные методы гематологического и биохимического анализа сыворотки крови, статистические методы. У подопытных животных при первичном обследовании установлено развитие анемического синдрома, воспалительного процесса в урогенитальном тракте, гиперфосфатемии, гиперосмолярности сыворотки крови и гипомагниемии. После опыта была выявлена оптимизация гемопоэза, разрешение воспалительного процесса, восстановление водно-электролитного обмена. Использование предлагаемого алгоритма коррекции с применением антиоксидантных средств при цистолитиазе у кошек способствует нормализации показателей показатели красной крови (RBC, HGB, HCT, RDW-CV, RDW-SD) и лейкоцитарного звена (WBC, Neu#, Neu%), а также ретикулоцитарных индексов (RET# и HFR) за счет активации кроветворения в гемопоэтической ткани. Применение разработанной схемы коррекции способствовало оптимизации водно-солевого обмена у подопытных (P+3, Cl-, осмолярность сыворотки крови, Fe+2, Mg+2). Выявленная обратная корреляция объема эритроцита и гемоглобинного эквивалента у больных животных, после опыта приобрела прямую взаимосвязь, а прямая взаимосвязь между объемом эритроцита и средней концентрацией гемоглобина в эритроците сменилась обратной. Полученные данные расширяют перечень имеющихся протоколов лечения цистолитиаза струвитного с интравезикальной локализацией песка у кошек. Ключевые слова: гематологические параметры сыворотки крови, цистолити-аз, кошки, электролитный обмен, антиоксидантные средства, коррелятивные связи, маркеры обмена железа. Сведения об авторах: Ушакова Татьяна Михайловна, кандидат ветеринарных наук, доцент, заведующий кафедрой терапии и пропедевтики ФГБОУ ВО «Донской государственный аграрный университет»; 346493, Ростовская область, пос. Персиановский, ул. Кривошлы-кова, 24; тел.: 8-928-6055873; e-mail: tanja_0802@mail.ru. Дерезина Татьяна Николаевна, доктор ветеринарных наук, профессор, заведующий кафедрой биологии и общей патологии ФГБОУ ВО «Донской государственный технический университет»; 344000, Ростовская область, г. Ростов-на-Дону, пл. Гагарина, 1; тел.: 8-903-4351237; e-mail: derezinasovet@mail.ru. Ответственный за переписку с редакцией: Чичиленко Виталий Сергеевич, аспирант ФГБОУ ВО «Донской государственный аграрный университет»; 346493, Ростовская область, пос. Персиановский, ул. Кривошлыкова, 24; тел.: 8-999-9667257; e-mail: chichilenko.vitaliy@mail.ru.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|