|
||||

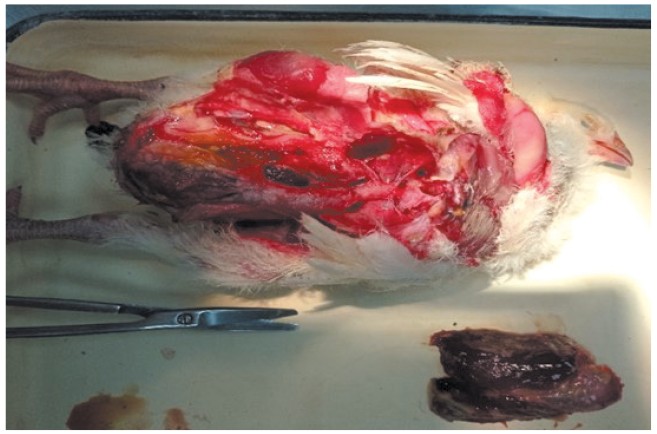
Видовой состав микроорганизмов, изолированных из тканей и органов павшей птицыУДК 619:616.9:636.5 Мухаммадиева А. С. Федеральное государственное бюджетное образовательное учреждение высшего образования За последнее время в птицеводстве появилось суще-~ственное количество новых скороспелых и высокопро-дуктивных кроссов птиц [12]. Вместе с этим среди населения, в том числе и частных предпринимателей, растет популярность разведения сельскохозяйственной птицы в целях получения куриного мяса и яиц как источников полноценного животного белка и дополнительного дохода [4, 8]. Тем не менее, не всегда удается соблюдать технологические и зооветеринарные условия содержания и кормления птиц [10, 13]. Несоблюдение требований к выращиванию птиц приводит в местах их обитания к появлению патогенной и условно-патогенной микрофлоры, которая на фоне снижения резистентности организма животного способно вызывать в зависимости от вида возбудителя различные инфекционные заболевания [11, 14]. В течение последних лет картина инфекционной патологии сельскохозяйственной птицы меняется с огромной скоростью одновременно с интенсификацией птицеводства: растет число заболеваний, обнаруживаются новые нозологические единицы и происходит генетическая трансформация раннее обнаруженных штаммов микроорганизмов [3]. Исследователями установлено изменения клинической картины бактериальных инфекций и особенностей их патогенеза [2], а также повышение количества инфекционных заболеваний, вызываемых ассоциациями условно-патогенных микроорганизмов [3]. Представителями условно-патогенной микрофлоры являются гемолитические штаммы кишечной палочки и стафилококки [7, 9], обитающие во внешней среде на предметах ухода за животными, поилках, кормушках, а также на кожных и перьевых покровах птиц. Широко распространенная в природе клебсиелла обнаруживается у погибших после вспышки пневмонии цыплят, которые содержались с несоблюдением зоогигиенических норм и требований [3]. Протей, характеризующийся высокой протеолитической активностью и факторами токсигенности, также практически постоянно встречается на кожных покровах, в кишечнике, половой и респираторной систем птицы [1, 17]. Учитывая актуальность проблемы, целью нашей работы являлось выделение и идентификация микроорганизмов, которые изолированы из тканей и органов павших цыплят-бройлеров и кур-несушек, содержащихся в частном секторе. Материалы и методы исследований. Материалом для посмертного патологоанатомического исследования служили свежие трупы павших 30 голов цыплят-бройлеров и 20 голов кур-несушек от 10-дневного до 2-месячного возраста, доставленные в непроницаемой таре из разных районов Республики Татарстан от частных лиц для бактериологического анализа и определения причины гибели животного. Посев на жидкие и твердые питательные среды МПА, МПБ, ГРМ-агар Эндо (Оболенск, Россия) проводили бактериологической петлей и отпечатками органов из паренхиматозных органов (сердце, печень, селезенка, почка) и костного мозга [3, 9]. После чего пробирки и чашки Петри с посевами инкубировали в термостате при 37°С в течении 24 ч. Дальнейшую идентификацию выделенных микроорганизмов проводили путем пересева выросших колоний на дифференциально-диагностические питательные среды для изучения характера их роста, тинкториальных и биохимических свойств [2]. При проведении дифференциации кишечной палочки визуально отбирали темно-красные или вишневого цвета с зеленым металлическим блеском образовавшиеся колонии на среде агар Эндо, сальмонелл - бесцветные или с розовым оттенком, псевдомонад - неровные интенсивно-розовые, протей - бесцветные с розовым оттенком и характерным ползучим ростом. На МПА стафилококки образовывали ровные круглые колонии желтого цвета [3, 7]. Изолированные из патологического материала колонии пересевали на поверхность агаризованной среды МПА для выделения и накопления чистой культуры бактерий [2, 9]. Для определения способности культур ферментировать углеводы применяли агар Клиглера-ГРМ (Оболенск, Россия) или среды Гисса-ГРМ (Оболенск, Россия), для оценки утилизации цитрата натрия - цитратный агар Симмонса (№ 14 ГРМ, Оболенск, Россия), для установления подвижности бактерий - полужидкий питательный агара [9]. Биохимическую идентификацию выделенных микроорганизмов проводили с помощью индикаторных бумажных систем (набор № 2, Микроген, Россия), 0,6% раствора а-нафтола и 40% раствора гидроксида натрия (постановка реакции Фогес-Про-скауэра), а также кровяного и желточно-солевого агара. Идентификацию эшерихий осуществляли набором сывороток «О» коли агглютинирующих (Армавирская биофабрика, Россия), сальмонелл - хромогенной средой РАМБАХ-агар (Merck, Германия), набором сальмонеллезных сывороток О-комплексных и моноре-цепторных О- и Н-агглютинирующих (набор № 1 и № 2, Курская биофабрика, Россия). Окраску фиксированных мазков осуществляли с помощью набора реагентов для окраски микроорганизмов по методу Грама (Микро-ГРАМ-НИЦФ, Россия) [2, 9]. Антибиотикоустойчивость изолированных микроорганизмов оценивали, используя диски, пропитанные антимикробными действующими веществами (НИЦФ, Россия) [2, 9]. Установление патогенных свойств выделенных микроорганизмов осуществляли на белых мышах массой от 14,0 до 18,0 г методом заражения последних чистой культурой [15]. Результаты исследований и их обсуждение. При осмотре трупов павшего молодняка птиц отмечали следующее: глаза цыплят-бройлеров были запавшими, перьевой покров испачкан, взъерошен, гребешки имели синюшный оттенок. При патологоанатомическом исследовании наблюдали мелкие точечные кровоизлияния и кровоподтеки на эндокарде и под эпикардом, воспаление внутренней стенки и клапанов сердца, гепатизацию легких, наложение фибринозных пленок на печени, сильно увеличенную селезенку, гиперемию слизистых оболочек тонкого и толстого отделов кишечника, подкожные отеки в области бедер и воспалительные процессы, локализующихся в отделах нижних конечностей (рисунок 1).
Рис. 1. Исследование внутренних органов трупа павшего цыпленка-бройлера в возрасте 22 суток Согласно морфологическим и культурально-биохимическим показателям, видовой состав бактерий, выделенных из трупов павших цыплят-бройлеров, включал возбудителей E. coli, S. enteritidis, S. typhimurium, P. aeruginosa, P. mirabilis и S. aureus (табл. 1). Таблица 1 Видовой состав патогенной микрофлоры, выделенной из организма павших цыплят-бройлеров
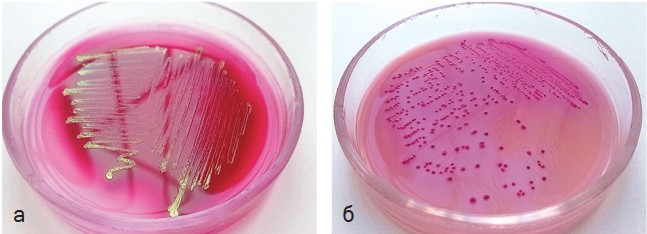
За исследуемые пробы были приняты органы птиц. Всего было изучено 150 образцов. Среди них положительными оказались 88,5% образцов, в которых наибольшую встречаемость имел вид Escherichia coli - 65,3% (рисунок 2 а). Род Salmonella был представлен двумя основными серотипами: Salmonella enteritidis (10,6%) и Salmonella typhimurium (2,0%). Бактерия Pseudomonas aeruginosa обнаруживалась в 10 пробах и составляла 6,6 % от общего числа образцов. Proteus mirabilis и Staphylococcus aureus выделены в незначительном количестве и составили 2,0% каждый. Следует отметить, что при первичном посеве мазков из всех органов молодняка птиц на среды наблюдали рост E. coli и S. enteritidis. Селезенка и красный костный мозг являлись единственными органами цыплят-бройлеров, с которых были получены наибольшее количество положительных проб.
Рис. 2. Рост культур: а - Escherichia coli на ГРМ-агаре Эндо, выделенная из организма павшего цыпленка-бройлера; б - Salmonella enteritidis, выделенная из организма павшей курицы-несушки, на хромогенной среде РАМБАХ-агаре При изучении трупов птиц старшего возраста была отмечена общая патологоанатомическая картина. У кур-несушек перьевой покров был загрязненным, клоака и область хвоста были испачканы жидким пометом, подкожные отеки в области живота. При осмотре внутренних органов наблюдали фибринозные наложения на печени и сердце, кровоизлияния на легких, увеличение селезенки, гиперемию слизистых оболочек тонкого и толстого отделов кишечника, желточный перитонит и воспаление слизистой оболочки клоаки. По видовому составу микрофлора органов погибших кур-несушек была разнообразной (табл. 2). Согласно морфологическим и культурально-биохимическим показателям видовой состав бактерий, выделенных из органов и тканей павших кур, включал таких возбудителей как E. coli, S. enteritidis, P. mirabilis и S. aureus. Всего было проанализировано 100 проб внутренних органов, из них положительными оказались 83%. Наиболее важное этиологическое значение имела Escherichia coli и ее доля составила 65%. Вторым по значимости отмечен вид Staphylococcus aureus, который был выявлен в 8% от общего числа образцов. Salmonella enteritidis (рисунок 2 б) и Proteus mirabilis выявлялись в меньших количествах - 7% и 3%, соответственно. В патологическом материале данной группы птиц кишечная палочка в разном количестве была выделена со всех исследуемых органов. Сальмонелла при первичном посеве также показала рост на средах со всех проб, кроме одного органа - сердце, золотистый стафилококк - почка. Печень и красный костный мозг являлись единственными органами птиц, с которых были выделены наибольшее число положительных проб. Таблица 2 Видовой состав патогенной микрофлоры, выделенной из организма павших кур-несушек
При бактериологическом исследовании всех трупов птиц и серологической типизации выделенной кишечной палочки были установлены следующие энтеропатогенные серогруппы: О1, О2, О18, О55, О78, О111, О115 и О119. Преобладающими среди указанных серотипов кишечной палочки являлись О2 (73,4%), О78 (12,8%) и О115 (9,2%). Основным источником возбудителя эшерихиоза, скорее всего, служила больная или переболевшая в основном стаде птица, которая выделяла патогенные серотипы E. coli с пометом, тем самым, обсеменяя ими поилки и кормушки. Не исключается возможность заноса возбудителя мелкими грызунами и синантропными птицами [16]. Все выделенные изоляты в ходе проведенной работы оценивали на антибиотикоустойчивость. Большинство культур бактерий проявляли резистентность к таким антимикробным препаратам, как бензилпенициллин, линкомицин, ампициллин с сульбактамом, триметоприм с сульфаметоксазолом, ванкомицин, цефурок-сим, цефаклор, цефепим и цефтазидим. Слабочувствительными бактерии оказались к амоксициллину, фузидиновой кислоте, доксициклину, фурадонину, цефотаксиму и чувствительны к тикарцил-лину с клавулановой кислотой, амоксициллину с клавулановой кислотой, гентамицину, цефтриаксону, а также левомицетину (результаты не показаны). Исследование чувствительности бактериальных штаммов к антибиотикам позволяет выявить и заменить малоэффективные или вовсе не обладающие активностью препараты, которые могут приводить к образованию антибиотикоустойчивых форм микроорганизмов и загрязнять птицеводческую продукцию [5, 6]. Заключение. Таким образом, видовой состав бактерий, выделенных из трупов павших цыплят-бройлеров, включал возбудителей E. coli, S. enteritidis, S. typhimurium, P. aeruginosa, P. mirabilis и S. aureus, из трупов павших кур - E. coli, S. enteritidis, P. mirabilis и S. aureus. При этом наибольшую встречаемость имели энтеропатогенные серогруппы E. coli, преобладающими среди которых являлись О2 (73,4%), О78 (12,8%) и О115 (9,2%). Установлено, что большинство изолированных бактерий проявляли резистентность к бензилпенициллину, линкомицину, ампициллину с сульбактамом, триметоприму с сульфаметоксазолом, ванкомицину, цефуроксиму, цефаклору, цефепиму и цефтазидиму. Список литературы: 1. Антагонистический потенциал молочнокислых микроорганизмов в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы/ Р. С. Мухаммадиев, Р. С. Мухаммадиев, В. Г. Гумеров [и др.] // Агропромышленный комплекс: проблемы и перспективы развития: материалы всероссийской научно-практической конференции. 2022. С. 138-144. 2. Безбородова, Н. А. Сравнение лабораторных методов диагностики инфекций, вызываемых патогенными и условно-патогенными микроорганизмами / Н. А. Безбородова, Н. А. Ким // Эффективное животноводство. 2018. № 2 (141). С. 46-47. 3. Болезни птиц, вызываемые условно-патогенной микрофлорой/ Э. Д. Джавадов, О. Б. Новикова, Д. А. Красков [и др.] // Эффективное животноводство. 2023. № 6 (188). С. 8-12. 4. Буяров, В. С. Производство яиц и мяса птицы в фермерских и приусадебных хозяйствах / В. С. Буяров, И. В. Червонова, А. В. Буяров // Вестник аграрной науки. 2022. № 6 (99). С. 13-27. 5. Влияние антибиотиков, использующихся в животноводстве, на распространение лекарственной устойчивости бактерий (обзор) / И. С. Сазы-кин, Л. Е. Хмелевцова, Е. Ю. Селиверстова [и др.] // Прикладная биохимия и микробиология. 2021. Т. 57. № 1. С. 24-35. 6. Выживаемость ассоциаций микроорганизмов на основе биосо-вместимых штаммов молочнокислых и спорообразующих бактерий в условиях in vitro, аналогичных для различных отделов пищеварительного тракта сельскохозяйственной птицы/ Р. С. Мухаммадиев, Р. С. Мухамма-диев, Л. Р. Валиуллин [и др.] // Достижения науки и техники АПК. 2024. Т. 38. № 6. С. 39-45. 7. Герасимова, А. О. Колибактериоз птиц - актуальные вопросы / А. О. Герасимова, О. Б. Новикова, А. А. Савичева // Ветеринария сегодня. 2023. Т. 12. № 4. С. 284-292. 8. Калугина, З. И. Сельское предпринимательство в современной России: мимикрия старых и становление новых форм / З. И. Калугина // ЭКО. 2016. № 6 (504). С. 78-98. 9. Новикова, О. Б. Микрофлора, выделяемая от перепелов и контроль бактериальных болезней в перепеловодческих хозяйствах / О. Б. Новикова // Эффективное животноводство. 2020. № 9 (166). С. 66-69. 10. Новые штаммы Lactobacillus acidophilus как перспективные пробиотики для птицеводства/ Л. Р. Валиуллин, Р. С. Мухаммадиев, Р. С. Му-хаммадиев [и др.] // Ветеринария Кубани. 2022. № 6. С. 16-21. 11. Оптимизация параметров совместного культивирования Bacillus subtilis GA27 и Bacillus subtilis RF-45 для возможности создания пробиотиков, метапробиотиков и метабиотиков для птицеводства/ Р. С. Мухам-мадиев, Р. С. Мухаммадиев, Л. Р. Валиуллин [и др.] // Ветеринария Кубани. 2023. № 3. С. 32-38. 12. Технология содержания и кормления родительского стада мясных кур и цыплят-бройлеров/ В. С. Буяров, А. В. Буяров, М. А. Талалаева [и др.] // Биология в сельском хозяйстве. 2023. № 2 (39). С. 5-11. 13. Ферментативная активность гидролаз штаммов микроорганизмов, перспективных для создания на их основе кормовых добавок и биологических консервантов/ Р. С. Мухаммадиев, Р. С. Мухаммадиев, И. Г. Каримуллина [и др.] // Состояние, проблемы и перспективы развития современной науки: материалы национальной научно-практической конференции. 2021. С. 127-133. 14. Enterococcus cecorum - новая угроза промышленному птицеводству/ Е. П. Горфункель, Д. Г. Тюрина, Л. А. Ильина [и др.] // Птицеводство. 2020. № 1. С. 51-57. 15. Murine models of Salmonella infection / G. T. Walker, R. R. Gerner, S. P. Nuccio et al. // Curr. Protoc. 2023. 3 (7). e824. 16. One health clones of multidrug-resistant Escherichia coli carried by synanthropic animals in Brazil / E. Sano, F. Esposito, H. Fontana et al. // One Health. 2022. 16. 100476. 17. Proteus mirabilis causing cellulitis in broiler chickens / M. S. Sanches, A. Baptista, M. de Souza et al. // Braz. J. Microbiol. 2020. 51 (3). 1353-1362. Резюме. Несоблюдение требований к выращиванию сельскохозяйственной птицы приводит в местах ее обитания к появлению патогенной и условно-патогенной микрофлоры, которая на фоне снижения резистентности организма животного способно вызывать различные инфекционные заболевания или бессимптомное носительство. Учитывая актуальность проблемы, целью настоящей работы являлось выделение и идентификация микроорганизмов в патологическом материале от павших кур-несушек и цыплят-бройлеров, содержащихся в частном секторе. Материалом для патологоанатомического исследования служили свежие трупы павших 30 голов цыплят-бройлеров и 20 голов кур-несушек от 10-дневного до 2-месячного возраста, доставленные из разных районов Республики Татарстан. Идентификацию выделенных микроорганизмов проводили с использованием дифференциально-диагностических питательных сред для оценки характера их роста, тинкториальных и биохимических свойств. Согласно морфологическим и культурально-биохимическим показателям видовой состав бактерий, выделенных из трупов павших цыплят-бройлеров, включал возбудителей E. coli, S. enteritidis, S. typhimurium, P. aeruginosa, P. mirabilis и S. aureus, из трупов павших кур - E. coli, S. enteritidis, P. mirabilis и S. aureus. При этом наибольшую встречаемость имели энтеропатогенные серогруп-пы E. coli, преобладающими среди которых являлись О2 (73,4%), О78 (12,8%) и О115 (9,2%). Большинство изолированных бактерий проявляли резистентность к бензилпенициллину, линкомицину, ампициллину с сульбактамом, триметоприму с сульфаметоксазолом, ванкомицину, цефуроксиму, цефаклору, цефепиму и цефтазидиму. Слабочувствительными бактерии оказались к амоксициллину, фузидиновой кислоте, доксициклину, фурадонину, цефотаксиму и чувствительны к тикарциллину с клавулановой кислотой, амоксициллину с клавулановой кислотой, гентамицину, цефтриаксону, а также левомицетину. Ключевые слова: выделение, идентификация, микроорганизмы, видовой состав, павшая птица, цыплят-бройлеры, куры-несушки, птицеводство. Сведения об авторах: Мухаммадиев Ришат Салаватович, кандидат биологических наук, научный сотрудник лаборатории кормов и кормовых добавок ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-939-3728789; е-mail: tashir9891@mail.ru. Каримуллина Ильсияр Габделгазизовна, кандидат биологических наук, старший научный сотрудник лаборатории вирусологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-904-7699225; е-mail: 89047699225@mail.ru. Яруллин Айнур Ильнурович, кандидат биологических наук, ведущий научный сотрудник, заведующий отделения вирусологических и ультра-структурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-905-3174170; е-mail: abii@mail.ru. Мухаммадиев Ринат Салаватович, кандидат биологических наук, старший научный сотрудник лаборатории кормов и кормовых добавок ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-987-4214127; е-mail: tanirtashir@mail.ru. Тарасова Евгения Юрьевна, кандидат биологических наук, ведущий научный сотрудник лаборатории ветеринарной санитарии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.:8-905-3779932; е-mail: Evgenechka1885@gmail.com. Хамидуллина Разина Зиннатулловна, младший научный сотрудник лаборатории вирусологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.:8-952-0329511; е-mail: khamidullina140178@gmail.com. Ответственный за переписку с редакцией: Мухаммадиева Алина Сергеевна, кандидат ветеринарных наук, младший научный сотрудник лаборатории культур клеток и питательных сред ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-917-2396095; e-mail: alinasakura_mail.ru@mail.ru.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|