|
||||

Детекция ДНК эмерджентных инфекций, как инструмент мониторинга за распространением и циркуляцией Mycoplasma bovis и Mycoplasma bovigenitalium у крупного рогатого скота на территории Уральского регионаУДК 619:577.21:001.891.53:579:636.2
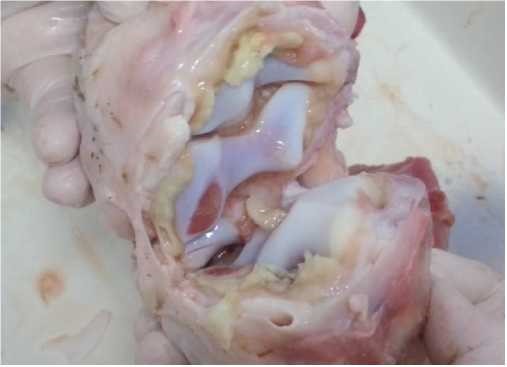
Безбородова Н.А., Порываева А.П., Шилова Е.Н., Кожуховская В.В., Красноперов А.С. Федеральное государственное бюджетное научное учреждение Микоплазмоз крупного рогатого скота в XXI веке имеет яркие признаки эмерджентной инфекции, так как до этого большинство европейских и североамериканских стран считались «свободными» от микоплазмоза. В настоящее время микоплазменная инфекция распространена по всему миру, ежегодно регистрируется до n-случаев заболевания микоплазмозом. Основными причинами, сдерживающими оздоровление и защиту популяций крупного рогатого скота от микоплазмоза, является отсутствие эффективных вакцин и методов лечения, а также тенденция к увеличению устойчивости возбудителя к противомикробным препаратам [1, 11]. Виды Mycoplasma принадлежат к классу Mollicutes и характеризуются небольшим размером генома [0,58-1,4 Mbp], низким содержанием G + C [23-40%] и отсутствием клеточной стенки. Это определяет их как простейшие и наименее самовоспроизводящиеся, и свободноживу- щие вне макроорганизма формы жизни [16]. Отсутствие клеточной стенки у микоплазм затрудняет распознавание этих патогенов иммунной системой животных, вследствие чего «иммунный ответ» выражен слабо. Кроме того, большинство антибиотиков, которые действуют на клеточные стенки бактерии, в случае с возбудителями микоплазмоза не эффективны [9, 11]. Клинические формы микоплазмоза у животных варьируют от острых до латентных, бессимптомных и хронических [5]. Самым распространенным клиническим проявлением микоплазмоза у коров является мастит, у молодняка - поражение дыхательных путей и суставов. Известно, что некоторые виды микоплазм являются основными возбудителями болезней, другие же считаются сопутствующими и играют роль кофакторов в ассоциациях с бактериями и вирусами [3, 11, 15]. К наиболее распространенным клинически значимым видам относят двух основных возбудителей: Mycoplasma bovis и Mycoplasma bovigenitalium. Mycoplasma bovis считается наиболее опасным патогеном, поражающим верхние дыхательные пути, приводящим к пневмониям, отитам, артритам, маститам, эндометритам и кератоконъюнктивитам [11, 14, 16]. Mycoplasma bovis поражает все возрастные группы крупного рогатого скота и может сохраняться в стаде длительное время. Яцентюк С.П., Parker A.M., Haapala V. (2017-2018) отмечают, что возбудитель Mycoplasma bovis часто интродуцируется в закрытых и биобе- зопасных молочных стадах во время искусственного осеменения за счёт использования зараженной спермы, что в последствии приводит к вспышкам маститов [3, 12, 15]. В последнее время зарубежные исследователи отмечают, что в случаях пневмонии у коров и телят наблюдался синергизм между Mycoplasma bovis и возбудителями семейства Pasteurellaceae, а также Mycoplasma bovis и M. haemolytica [9, 11]. Mycoplasma bovigenitalium вызывает маститы у коров, обнаруживается в репродуктивном тракте и часто ассоциирована с эндометритами, бесплодием, нарушением родовой деятельности [10, 11, 14]. Известно, что Mycoplasma bovigenitalium является возбудителем некротического вульвовагинита у коров и, по мнению многих иностранных исследователей, именно данное заболевание наносит наибольший ущерб сельскохозяйственным предприятиям. Так же, доказано, что наличие Mycoplasma bovigenitalium в сперме быков снижает подвижность сперматозоидов [1, 11, 13]. Классическим лабораторным методом диагностики микоплазм является «культуральный метод» [1, 15]. Недостаток данного метода состоит в том, что питательные среды культивирования имеют достаточно сложный состав, культуры микоплазм растут медленно (7-10 дней), очень часто происходит подавление их роста другими бактериями. Идентификация микоплазм как кофакторов бактериально-вирусных инфекций этим методом очень сложна и, порой, невозможна [1, 5, 15]. В настоящее время для диагностики микоплазмозов широко применяется молекулярно-биологические методы - ПЦР с видоспецифичными праймерами, которые позволяют выявлять ДНК патогена в различных образцах биологического материала от животных [1, 2, 15]. Цель исследований - провести дифференциальный анализ выявленных микоплазм от коров и телят с помощью ПЦР-диагностики на территории Уральского региона. Материалы и методы исследований. Методом ПЦР в период 2019-2020 годов было исследовано 116 проб биоматериала от коров и телят из 13 сельскохозяйственных организаций Уральского региона. В качестве биоматериалов использовали: пробы молока, соскобы с влагалища у коров, кусочки плаценты, смывы с носоглотки телят, патологическим материалом стали пробы паренхиматозных органов от абортированных плодов, пораженные суставы от павших телят. При проведении дифференциальных лабораторных исследований использовали набор для выделения ДНК «Diatom DNA Prep 200» (компания ООО «ИзоГен», Москва), набор для определения «Chlamydia spp.» (компания ООО «ФакторМед», Москва), набор для определения видоспецифичных микоплазм у коров Mycoplasma bovis и Mycoplasma bovigenitalium (ООО «ИДС», Москва), комплект реагентов для идентификации «С. pecorum», «С. abortus», «Mycoplasma spp.» крупного рогатого скота, инфекционного ринотрахеита крупного рогатого скота «Gen Pak DNA PSR Test BHV1» (компания ООО «ИзоГен», Москва), наборы для определения вируса диареи крупного рогатого скота (ООО «ИнтерЛаб- Сервис», Москва). Амплификацию в режиме реального времени проводили с применением оборудования Rotor-Gene 3000 (Corbett Life Science, Авста- ралия), QuantStudio 5 (США), термоциклера Appliede Biosystems 2720 (Сингапур). Исследования выполнены в элекрофорезном варианте с применением агарозного геля и мини-камеры Mini-Sub Cell GT (Bio-Rad, США) с визуализацией под ультрафиолетовым излучением в камере CHEMIDOC XRS+ с интерпретацией результатов с помощью гель-документации Gel Doc XR+ (Bio-Rad, США). Результаты исследований и их обсуждение. Известно, что в норме микоплазмы обитают на слизистых оболочках респираторных и мочеполовых органов животных, при снижении иммунной защиты организма патоген размножается и колонизирует слизистые, что приводит к развитию инфекционного процесса. В большинстве случаев микоплазменная инфекция у животных протекает либо в субклинической, либо в латентной форме, что способствует развитию хронических воспалительных заболеваний репродуктивных органов у коров [5, 7]. В ранее проведенных нами исследованиях биопроб от крупного рогатого скота, содержащегося в хозяйствах Свердловской области (2018 год), были выявлены специфические участки ДНК только одного возбудителя инфекционного заболевания. Ассоциаций бактериальных и вирусных патогенов не наблюдалось. Наличие ДНК бактерий рода Mycoplasma spp. диагностировали в 7,6% случаев [5]. Клиническое проявление микоплазмоза, ассоциированного с Mycoplasma bovis, отмечали в молочных стадах у животных разного возраста. У телят проявлнение возбудителя отмечали в возрасте 1-1,5 месяцев при формировании смешанных групп (перегруппировке, переводе в большие телятники). Течение данной инфекции характеризовалось стойкими хроническими пневмониями, устойчивыми к антибактериальной терапии, в том числе, к использованию антибиотиков группы макролидов (тилозин, азитромицин). У телят также отмечались средние отиты (рисунок 1), полиартриты с преимущественным поражением запястных (рисунок 2), локтевых и скакательных суставов. У коров в данном стаде отмечали острые маститы с фибринозным или гангренозным поражением паренхиматозной ткани молочной железы, с тенденцией к дальнейшей хронизации воспалительного процесса.
В период 2019-2020 годов количество положительных в ПЦР проб составило 17,2%. В биологических материалах от коров и телят были выявлены геномы Mycoplasma bovis и Mycoplasma bovigenitalium. ДНК Mycoplasma bovis выделена из биопроб синовиальной жидкости от телят, из смывов с носоглотки телят, соскобов с влагалища у коров и из гомогената паренхиматозных органов от абортированных плодов в 11,2% случаев. В исследованном биологическом материале геномы Mycoplasma bovigenitalium были обнаружены в смывах с носоглотки телят и соскобах с влагалища у коров (1,0%). Коинфицирование Mycoplasma bovis/M. bovigenitalium выявили в 2 образцах (смыв с носоглотки теленка, соскоб с влагалища у коровы). Так же в одной из проб поступившего биоматериала (смывы с носоглотки телят) присутствовали ДНК Mycoplasma bovigenitalium и Chlamydophila pecorum, что говорит о наличии микст-инфекции. Стоит отметить, что в аналогичных пробах от телят из этой же сельскохозяйственной организации были обнаружены генетические материалы Chlamydophila pecorum и Bovine virus diarrhoea, что свидетельствует об активной циркуляции бактериальной и вирусной инфекции. Во всех остальных исследуемых образцах биологических проб генетические материалы Chlamydia spp., Chlamydophila abortus, Chlamydophila pecorum, Bovine herpes virus (type 1) и Bovine virus diarrhoea отсутствовали. При ретроспективном анализе результатов дифференциальной диагностики методом ПЦР было показано, что, несмотря на ветеринарно-санитарные и зоогигиенические меры, некоторые из обследованных хозяйств остаются неблагополучными по микоплазменной инфекции по настоящее время. Так, в 2019 году в биоматериалах, поступивших из одного такого хозяйства, специфические участки ДНК Mycoplasma bovis были выявлены в гомогенате паренхиматозных органов от абортированных плодов, а также в синовиальной жидкости пораженных суставов от павших 3-месячных телят (рисунок 3). В 2020 году при дифференциальной диагностике биологических проб, поступивших из этой же сельскохозяйственной организации, от телят в смывах со слизистых носовых ходов обнаружены два вида микоплазм - Mycoplasma bovis и Mycoplasma bovigenitalium. Необходимо подчеркнуть, что во всех случаях результаты исследования образцов биоматериала методом ПЦР на Chlamydophila pecorum, Chlamydophila abortus и Bovine herpes virus (type 1) были «отрицательными». Данные диагностических исследований свидетельствуют о том, что среди молодняка и взрослого поголовья крупного рогатого скота происходит постоянная циркуляция двух видов микоплазм - Mycoplasma bovis и Mycoplasma bovigenitalium.
По мнению большинства исследователей, имеющих практический опыт в оздоровлении стад, для эрадикации возбудителя микоплазмоза требуется длительное время. Инфекцию Mycoplasma bovis и Mycoplasma bovigenitalium практически невозможно идентифицировать на ранних стадиях заболевания, трудно контролировать, прежде всего, вследствие внутриклеточной природы патогена, его высокой генетической и антигенной изменчивости. Генетическая пластичность возбудителя, его способность к образованию биопленок обуславливает формирование резистентности у изолятов микоплазмы к противомик- робным препаратам, отсутствие клеточной стенки не дает возможность применять бактерицидные антибиотики. Иммунобиологические препараты для вакцинопрофилактики мико- плазмозов крупного рогатого скота в настоящее время находятся в стадии разработки. Субклинический характер заболевания способствует распространению микоплазмы в стаде [9, 11]. Основными средствами, позволяющими проводить эффективное лечение крупного рогатого скота с манифестацией Mycoplasma bovis, является ограниченный спектр антибиотиков с бактериостатическим действием (тулатромицин, тилмикозин, препараты тетрациклинового ряда). Тем не менее, для снижения зависимости от антибиотиков, необходимо создавать «закрытые» стада с оптимальными параметрами биозащиты для предотвращения заноса возбудителей микоплазмоза из неблагополучных ферм. Выводы и предложения. В результате проведенных ПЦР исследований на наличие микоплазменной инфекции в биологическом материале (116 проб) от коров и телят были выявлены геномы Mycoplasma bovis и Mycoplasma bovigenitalium в 17,2% проб. В двух образцах биоматериалов (смыв с носоглотки теленка, соскоб с влагалища у коровы) присутствовало одновременно несколько видов микоплазм (Mycoplasma bovis + Mycoplasma bovigenitalium). В одной из проб (смывы с носоглотки телят), поступившей на исследование, были обнаружены геномы Mycoplasma bovigenitalium + Chlamydophila pecorum, что говорит о микст-инфекции. При этом в биопробах, поступивших ранее, были обнаружены специфические участки Chlamydophila pecorum и Bovine virus diarrhoea. Таким образом, анализ результатов исследований биологического материала за 2019-2020 годы методом ПЦР на видоспецифичную микоплазму показал, что в сельскохозяйственных организациях, находящихся на территории Уральского региона, на фоне циркуляции вирусных и бактериальных патогенов установлено наличие микоплазменных инфекций двух видов (Mycoplasma bovis, Mycoplasma bovigenitalium). В связи с отсутствием эффективных вакцин против Mycoplasma bovis, Mycoplasma bovigenitalium важно проводить регулярный мониторинг, скрининг для раннего выявления субклинических носителей в стадах крупного рогатого скота с использованием метода ПЦР для предотвращения неконтролируемого распространения микоплазмозов [4, 6, 9, 11, 17]. В качестве профилактики и искоренения инфекции необходимо проводить постоянную санитарную обработку ферм с использованием эффективных дезинфицирующих средств [8], использовать пастеризацию и термообработку молозива и сырого молока [12]. Исследования выполнены в рамках Государственного задания Минобрнауки России по теме 0532-2021-007 в отделе ветеринарнолабораторной диагностики с испытательной лабораторией и в отделе мониторинга и прогнозирования инфекционных болезни ФГБНУ УрФАНИЦ УрО РАН. Список литературы:
Резюме. В данной статье проведен клинико-лабораторный анализ микро- плазменной инфекции у коров и телят в период 2019-2020 годов. Клиническое проявление видоспецифичного микоплазмоза отмечали в молочных стадах у животных разного возраста. У коров инфекция наблюдалась в виде острых маститов, у молодняка вызывала поражение дыхательных путей и суставов, проявлялась в виде отитов. Методами ПЦР было исследовано 116 биопроб от коров и телят из 13 сельскохозяйственных организаций Уральского региона. В результате ПЦР были выявлены геномы Mycoplasma bovis и Mycoplasma bovigenitalium в 17,2% проб. Mycoplasma bovis выделена из биоматериала синовиальной жидкости от телят, из смывов с носоглотки телят, соскобов с влагалища у коров и из паренхиматозных органов от абортированных плодов в 11,2% случаев. Геномы Mycoplasma bovigenitalium были обнаружены в смывах с носоглотки телят и соскобах с влагалища у коров (1,0%). В двух пробах (смыв с носоглотки теленка, соскоб с влагалища у коровы) было обнаружено одновременное наличие генетического материала нескольких микоплазм (Mycoplasma bovis + Mycoplasma bovigenitalium). А в одной из проб (смывы с носоглотки телят) были выявлены ДНК Mycoplasma bovigenitalium + Chlamydophila pecorum, что говорит о микст-инфекции. В пробах, поступивших ранее, были обнаружены геномы Chlamydophila pecorum и Bovine virus diarrhoea, что свидетельствует об активной циркуляции вирусно-бактериальных патогенов на территории Уральского региона. Ключевые слова: крупный рогатый скот, телята, эмерджентные инфекции, микоплазменная инфекция, Mycoplasma bovis, Mycoplasma bovigenitalium, геном, молекулярно-биологические методы, ПЦР-диагностика, инфекционный возбудитель. Сведения об авторах: Порываева Антонина Павловна, доктор биологических наук, ведущий научный сотрудник ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-922-1122095; e-mail: app1709@inbox.ru. Шилова Евгения Николаевна., доктор ветеринарных наук старший научный сотрудник ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: adelaida.gurgenovna@mail.ru. Кожуховская Вероника Валентиновна, младший научный сотрудник ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-950-6361400; e-mail: tetramegon@yandex.ru. Красноперов Александр Сергеевич, кандидат ветеринарных наук, старший научный сотрудник ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-903-0833132; e-mail: marafon.86@list.ru. Ответственный за переписку с редакцией: Безбородова Наталья Александровна, кандидат ветеринарных наук, старший научный сотрудник ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-9049817214; e-mail: n-bezborodova@mail.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|