|
||||

Ранняя диагностика инфицированных вирусом лейкоза крупного рогатого скота животных - залог успешного оздоровления хозяйстваУДК 619: 616.988-07: 616.155: 636.2 Коваленко А.М., Явников Н.В. Федеральное государственное бюджетное образовательное учреждение Введение. Вирусные инфекционные заболевания животных наносят значительный экономический ущерб скотоводству, а лейкоз крупного рогатого скота, являясь наиболее актуальным заболеванием, вызывает в большинстве стран мира высокий уровень инфицированности поголовья. Довольно позднее выявление инфицированности животных, несмотря на использование современных диагностических тестов, способствует широкому распространению лейкоза крупного рогатого скота [3, 17].
Лейкоз крупного рогатого скота (далее, EBL), вызываемый В-лим-фотропным вирусом лейкоза (далее, BLV), относящийся к РНК-содер-жащим вирусам семейства Retroviridae, рода Deltaretrovirus, является медленно протекающим хроническим инфекционным заболеванием опухолевой природы [1, 5, 7].
Эффективность выявления заболевших животных на более ранних этапах развития инкубационного периода при медленно протекающих инфекциях является залогом формирования устойчивого благополучия по лейкозу крупного рогатого скота. Лейкоз до настоящего времени является одним из наиболее экономически значимых заболеваний, наносящих значительный ущерб развитию молочного и мясного скотоводства [10, 11]. Потери от лейкоза обусловлены не только удалением больного скота, но и устойчивым состоянием у животных иммунодепрессии, а также рисков развития патологий инфекционной этиологии, включающих поражения кроветворной, иммунной и репродуктивной систем [8, 13]. Кроме того, в молоке, полученном от инфицированных животных, изменяются физико-химические показатели аминокислотного состава, содержания белков, лактозы и казеина. Такое молоко, являясь не сыропригодным по составу и технологическим свойствам, потенциально опасно для человека ввиду накопления канцерогенных метаболитов при развитии онкогенеза у инфицированных коров [9].
Для улучшения эпизоотической ситуации по лейкозу крупного рогатого скота в неблагополучных хозяйствах стан ЕЭС, США и Японии разрабатываются национальные программы по оздоровлению от этой инфекции с использованием передовых технологий [15, 16, 18].
Ведущие лейкозоологи указывают на процесс распространения и стационарного неблагополучия по лейкозу крупного рогатого скота, на постоянное выявление антропогенных факторов, одним из которых является техногенное загрязнение, напрямую влияющее на состояние иммунной системы животных [2].
При развитии медленных инфекций, в том числе и лейкоза крупного рогатого скота, какие-либо клинические нарушения отсутствуют, но при этом выявляются антитела против вируса лейкоза крупного рогатого скота (далее, ВЛ КРС).
Вирус, попадая в организм, повреждает, в первую очередь, иммунокомпетентные клетки, что приводит к развитию иммунодефицитных состояний у животных.
Основным путем передачи является горизонтальный. В последние десятилетия некоторыми авторами освещена возможность присутствия вертикального пути передачи, то есть трансплацентарного инфицирования. При этом отдифференцировать трансплацентарный путь от заражения теленка при родовспоможении (при повреждении родовых путей, кожи и слизистых оболочек теленка) не удалось, так как только лишь у 5-8% телят, полученных от лейкозных коров, наблюдалось развитие инфекционного процесса [2, 12].
Существенно ускорился процесс эффективного оздоровления поголовья крупного рогатого скота от лейкоза благодаря использованию разработанных серологических диагностических тест-систем, способствующих быстрому выявлению инфицированных особей при осуществлении оздоровительных, а также профилактических мероприятий [14].
Базовым серологическим тестом для выявления инфицированных вирусом лейкоза крупного рогатого скота является реакция иммунной диффузии (далее, РИД) и иммуноферментный анализ (далее, ИФА), где используется в качестве испытуемого клинического материала - сыворотка крови и молоко, с последующим применением гематологического теста [3].
В большинстве стран Европы с 1988 года прописано применение РИД и ИФА для выявления инфицированных лейкозом крупного рогатого скота. Кроме того, в последние годы все шире используется метод молекулярно-генетического анализа (далее, ПЦР) для диагностики лейкоза крупного рогатого скота. Высокая специфичность такого метода достигается благодаря детекции фрагмент провирусной ДНК вируса лейкоза. Специфичность задается нуклеотидной последовательностью праймеров, что исключает возможность получения ложных результатов. Метод ПЦР обладает высокой чувствительностью, дающей возможность обнаружить единичные фрагменты вирусных нуклеиновых кислот [6].
Молекулярно-генетические тесты позволяют проводить типизацию инфекционных агентов, открывая возможности изучения генетической структуры вируса лейкоза, а также вносят вклад в развитие молекулярной эпизоотологии.
Изучение изменчивости вируса лейкоза позволяет совершенствовать диагностические тест-системы путем подбора специфичных праймеров для консервативных фрагментов генома возбудителя.
В настоящее время изучено влияние колострального иммунитета на серологические диагностические исследования молодняка крупного рогатого скота, которое обуславливает появление ложноположительных результатов. Учитывая этот феномен, с 15-дневного возраста телят исследуют с использованием метода ПЦР-диагностики.
Сложная эпизоотическая ситуация по лейкозу крупного рогатого скота в Российской Федерации, в том числе и в молочно-товарных предприятиях Белгородской, Тюменской, Челябинской, Курганской областей и Республики Башкортостан послужила началом исследований по раннему выявлению инфицированных животных в неблагополучных хозяйствах с целью повышения успешности проводимых оздоровительных противолейкозных мероприятий. Целью исследования является использование ранней диагностики инфицированных вирусом лейкоза крупного рогатого скота животных при применении серологических и молекулярно-генетических методов, а также определения значимости ПЦР при выявлении BLV инфицированных телят.
Материалы и методы исследований. Исследования проводились в лаборатории лейкоза отдела мониторинга и прогнозирования инфекционных болезней ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук», на кафедре инфекционной и инвазионной патологии ФГБОУ ВО «Белгородский государственный аграрный университет имени В.Я. Горина», а также в 20 животноводческих сельскохозяйственных предприятиях Тюменской, Челябинской, Курганской, Белгородской областей и Республики Башкортостан.
Исследования проведены в рамках направления 160 Программы ФНИ государственных академий наук на 2013-2020 гг. по теме «Разработка теоретических основ для создания и внедрения программы мониторинга, диагностики, лечебно-профилактических и оздоровительных мероприятий по защите животных от эпизоотически значимых инфекционных болезней».
Для проведения эпизоотологических исследований использовали методику Санкт-Петербургской государственной академии ветеринарной медицины (Приказ Минсельхозпрода РФ от 11.05.1999 № 359 «Об утверждении правил по профилактике и борьбе с лейкозом крупного рогатого скота»).
Методику проведения гематологических и серологических исследований с использованием реакции иммунодиффузии выполняли согласно Методическим указаниям по диагностике лейкоза крупного рогатого скота, утвержденным Департаментом ветеринарии Министерства сельского хозяйства Российской Федерации от 23 августа 2000 г. № 13-7-2/2130.
Объектом исследования были телята в возрасте от 15 дней до 1 месяца и коровы - 3-4 года и 6 лет.
Биоматериалы (кровь, молозиво) от крупного рогатого скота для проведения ПЦР-исследований были получены из 20 сельскохозяйственных организаций Тюменской, Челябинской, Курганской, Белгородской областей и Республики Башкортостан. Всего методом ПЦР было исследовано 1 269 биологических проб крови.
Выделение провируса лейкоза из крови крупного рогатого скота и постановку ПЦР проводили в соответствии с инструкциями производителя по применению тест-систем. Использовали набор реагентов для выделения ДНК «DiatomDNAPrep 200» компании ООО «ИзоГен» (Россия).
Для амплификации ДНК применяли набор Bovine leukemia virus «GenPakDNAPCRTestBLV» ООО «ИзоГен»; тест-систему «Лейкоз» для выявления вируса лейкоза крупного рогатого скота методом ПЦР с ЭФ-детекцией результатов («ИнтерЛабСервис», Россия); тест-систему «Лейкоз» для выявления вируса лейкоза крупного рогатого скота методом ПЦР с детекцией продуктов амплификации в реальном времени («ИнтерЛабСервис», Россия).
Амплификацию проводили с использованием термоциклера Appliede Biosystems 2720 (Сингапур). Исследования в режиме реального времени проводили с применением амплификатора Rotor-Gene 3000 (Австралия). Учет полученных данных осуществляли методом горизонтального элекрофореза с применением 1,5%-агарозного геля с добавлением бромистого этидия в качестве интерколирующего красителя для ДНК. В работе применяли следующее оборудование: мини-камеру Mini-SubCellGT производства компании Bio-Rad (США) с визуализацией под ультрафиолетовым излучением и камеру Bio-RadCHEMIDOCXRS+ (США).
Статистическую обработку данных проводили методами вариационной статистики в виде расчетов среднего арифметического, стандартного отклонения и коэффициентов вариации с использованием программного обеспечения Microsoft Office Excel 2007.
Результаты исследований и их обсуждение. Поскольку животноводческие сельскохозяйственные предприятия по выращиванию крупного рогатого скота являются стационарно неблагополучными по лейкозу в Тюменской, Челябинской, Курганской, Белгородской областях и Республики Башкортостан от 10 и более лет, эпизоотологические исследования на предмет инфицирования вирусом лейкоза крупного рогатого скота были проведены в молочно-товарных хозяйствах в январе и в июне 2020 года. Использовали эпизоотологический метод исследования с применением усовершенствованной методики раннего выявления инфицированных вирусом лейкоза крупного рогатого скота животных и результаты ретроспективных и проспективных эпизоотологических и серологических исследований. В основу методики раннего выявления лейкозных животных в неблагополучных хозяйствах заложено сокращение периодичности проведения исследования в два раза и увеличение искомых сывороточных противовирусных антител в испытуемых образцах.
В результате проведенных исследований установлено, что в большинстве молочно-товарных хозяйств крупных холдингов, где животные эксплуатируются не более трех лактаций, лейкозная инфекция отсутствует, то есть они являются свободными от лейкоза крупного рогатого скота. Хозяйства же, в которые генетический материал (телки) завозится ежегодно из-за рубежа и эксплуатация их проходит до 4-7 лактаций наблюдается появление положительно-реагирующих в реакции иммунодиффузии особей.
По результатам эпизоотологических исследований на Урале, в частности в Тюменской, в Челябинской, в Курганской областях и Республики Башкортостан общий уровень инфицированности лейкозом поголовья крупного рогатого скота составляет, соответственно, 6,3, 6,5, 7,3 и 8,1%.
Уровень инфицированности поголовья животных и эпизоотологическая ситуация по лейкозу крупного рогатого скота в молочно-товарных хозяйствах Белгородской области значительно сложнее.
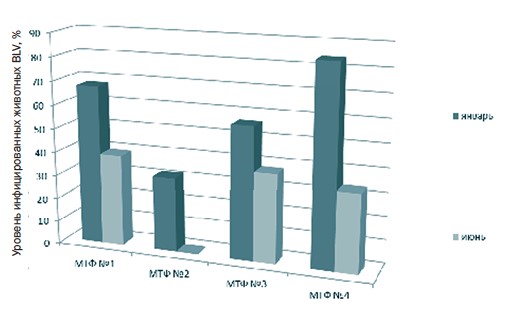
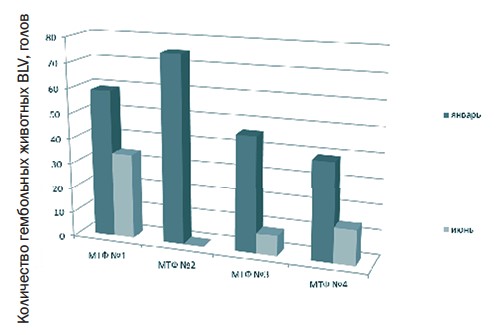
Проведенными эпизоотологическими мониторинговыми исследованиями в животноводческих сельскохозяйственных предприятиях Белгородской области установлено неблагополучие по лейкозу крупного рогатого скота в четырех сельскохозяйственных предприятиях Чернянского и Шебекинского районов - МТФ № 1 (ООО «ММФ Не-жеголь»), МТФ № 2 (АО «Орлик»), МТФ № 3 (ЗАО «Восход») и МТФ № 4 (ООО «Победа»), где во время проведения январского диагностического исследования с использованием РИД было выявлено значительное количество серологически положительных особей. При этом уровень инфицированности поголовья крупного рогатого скота в этих четырех хозяйствах составил, соответственно, 67,7, 31,7, 56,4 и 84,1%. При этом гематологическая стадия развития лейкозного процесса наблюдалась в МТФ № 1, в МТФ № 2 и в МТФ № 3, соответственно, у 59 голов (8%), 75 (7%) и 46 (12,3%) от общего числа серопозитивных животных (табл. 1, рисунок 1).
Таблица 1 Результаты серологических и гематологических исследований по лейкозу крупного рогатого скота в неблагополучных хозяйствах на территории Белгородской области (январь 2020 г.)
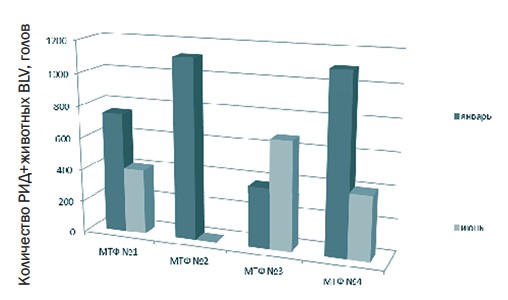
Рис. 1. Уровень инфицированности поголовья крупного рогатого скота в неблагополучных хозяйствах Белгородской области, % Таким образом, проведенными диагностическими исследованиями при проведении оздоровительных мероприятий от лейкоза крупного рогатого скота в четырех стационарно неблагополучных хозяйствах Белгородской области был установлен уровень инфицированности от 31,7 до 84,1%. Однако, в Тюменской, Челябинской, Курганской областях и Республике Башкортостан уровень инфицированности лейкозом поголовья крупного рогатого скота составил от 6,3 до 8,1%. В целом по Белгородской области по состоянию на январь 2020 года, учитывая неблагополучие по лейкозной инфекции крупного рогатого скота среди четырех вышеприведенных хозяйств с общей численностью поголовья 6 605 голов, выявлено 3 343 реагирующих в реакции иммунодиффузии головы, то есть 50,6% (рисунок 2). При этом гематологически больных особей выявлено 219 голов (6,6%).
Рис. 2. Количественный показатель выявляемости больных животных лейкозом с использованием РИД в неблагополучных хозяйствах Белгородской области (голов) Исследования, проведенные в тех же четырех хозяйствах через 6 месяцев, показали, что на МТФ № 1 выявлено 405 голов, дающих положительный результат в реакции иммунодиффузии, что составило 39% среди 1 054 голов крупного рогатого скота, находящихся в этом хозяйстве. При этом с помощью гематологического теста выявлено 34 головы, что составило 8,4% (табл. 2, рисунок 3). Таблица 2 Результаты серологических и гематологических исследований по лейкозу крупного рогатого скота в неблагополучных хозяйствах на территории Белгородской области (июнь 2020 года)
Рис. 3. Выявляемость гематологически больных лейкозом животных в неблагополучных хозяйствах Белгородской области, голов На МТФ № 2 за этот 6-месячный период исследований не выявлено положительно реагирующих животных и осталось поголовье крупного рогатого скота 418 голов в связи с тем, что все положительно реагирующее поголовье было вывезено на мясоперерабатывающие предприятия (табл. 2, рисунок 2, 3).
На МТФ № 3 при общем количестве 1 775 голов выявлено за 6месячный период исследований 672 головы, реагирующие в реакции иммунодиффузии, что составило 37,8%. Гематологическим тестом было выявлено 8 голов или 1,2% (табл. 2, рисунок 2, 3).
На МТФ № 4 при общем количестве поголовья 1 192 головы выявлено РИД положительных особей 399 особей, что составило 33,5%. Также выявлено 14 голов крупного рогатого скота, находящихся в гематологической стадии развития лейкозного процесса, что составило 3,5% (табл. 2, рисунок 2, 3).
В целом за 6 месяцев 2020 года среди вышеперечисленных четырех неблагополучных хозяйств, в которых насчитывается 4 439 голов крупного рогатого скота выявлено РИД положительных особей 1 476, что составило 33,2%. Установлено наличие за этот период гематологически больных животных - 56 голов, что составило 3,8% от числа положительно реагирующих в реакции иммунодиффузии.
Периодическими серологическими исследованиями с интервалом в шесть месяцев, проведенными в данных неблагополучных хозяйствах установлено, что использование РИД позволило снизить количество РИД+ животных: на МТФ № 1 на 27, 0%, на МТФ № 2 на 31,7%, на МТФ № 3 на 18,96% и на МТФ № 4 на 50,4%. При этом количество животных с гематологической стадией развития лейкозного процесса снижалось на МТФ № 1 на 4,7%, на МТФ № 3 на 11,85%, на МТФ № 4 на 2,3% от общего числа крупного рогатого скота (табл. 1, 2, рисунок 2, 3).
Сложная эпизоотическая ситуация в вышеперечисленных животноводческих предприятиях свидетельствует о присутствии источника возбудителя инфекции в данных хозяйствах, несмотря на регулярные диагностические исследования и удаления из общего стада РИД+ и немедленную сдачу на убой гематологически больных особей. В связи с этим была предпринята попытка выявления инфицированных телят, начиная с 15-дневного возраста с использованием полимеразной цепной реакции как в хозяйствах Белгородской области, неблагополучных по лейкозу крупного рогатого скота, так и в сельскохозяйственных животноводческих предприятиях Тюменской, Челябинской и Курганской областей.
От поголовья телят, начиная с 15-дневного возраста, из неблагополучных по лейкозу крупного рогатого скота хозяйств в Белгородской области выявляли с помощью ПЦР от 18 до 28% телят, инфицированных вирусом лейкоза. В Челябинской области у 39% телят в биопробах крови обнаруживали специфические участки провируса лейкоза. В Тюменской области уровень инфицированности молодняка крупного рогатого скота составлял 28%. В Курганской области ПЦР положительных телят, зараженных ВЛ КРС, составил около 30%.
Все это свидетельствует о том, что с помощью ПЦР удается выявлять инфицированных вирусом лейкоза телят в возрасте от 15 дней до 1 месяца, в стационарно-неблагополучных животноводческих предприятиях. Заражение вирусом лейкоза данных животных происходило, скорее всего, в период отёла при разрывах и повреждениях родовых путей и инфицированности теленка при контакте с материалом, содержащим элементы крови.
Таким образом, проведенными исследованиями установлена высокая диагностическая ценность ПЦР по выявлению вируса лейкоза крупного рогатого скота у телят с 15-дневного возраста. Данный метод позволяет проводить раннее выявление латентных вирусоносителей среди молодняка в оздоравливаемых от лейкоза животноводческих предприятиях. При дальнейших исследованиях у взрослого поголовья крупного рогатого скота до 6-летнего возраста обнаруживали вирусоноситель-ство с использованием ПЦР. Использование метода ПЦР при диагностике вируса лейкоза позволяет выявлять скрытых вирусоносителей и вовремя выводить их из стада, ускоряя проведение применяемых оздоровительных противолейкозных программ.
Во всех случаях у животных, имеющих положительные результаты в ПЦР-тесте, были выявлены противолейкозные антитела с использованием реакции иммунодиффузии и иммуноферментного анализа.
Заключение. Вышеприведенные результаты исследований свидетельствуют о том, что в Тюменской, Челябинской, Курганской и Белгородской областях, а также в Республике Башкортостан наблюдается схожее течение эпизоотического процесса при лейкозе крупного рогатого скота в неблагополучных животноводческих сельскохозяйственных предприятиях. Использование ранней диагностики лейкоза крупного рогатого скота животных с применением серологических и молекулярно-генетических методов позволилов молочно-товарных хозяйствах Тюменской, Челябинской, Курганской областях и Республике Башкортостан выявить от 6,3 до 8,1% больных лейкозом животных. А в Белгородской области в четырех стационарно неблагополучных хозяйствах этот показатель составил от 31,7 до 84,1%. Метод полимеразной цепной реакции позволил выявлять от 18 до 39% телят с 15-дневного возраста инфицированных вирусом лейкоза крупного рогатого скота в неблагополучных по лейкозу животноводческих предприятиях. При исследовании методом ПЦР коров удалось выявлять от 29% до 54% особей, инфицированных вирусом лейкоза крупного рогатого скота. Это свидетельствует о необходимости последовательного применения серологических исследований и значимости молекулярно-генетических тестов для выявлении BLV инфицированных телят.
Список литературы:
Резюме. Целью исследований является применение серологических и молекулярно-генетических методов диагностики для выявления инфицированного вирусом лейкоза крупного рогатого скота, а также определение значимости ПЦР при выявлении BLV-инфицированных телят. Исследования проводились в лаборатории лейкоза отдела мониторинга и прогнозирования инфекционных болезней ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук», на кафедре инфекционной и инвазионной патологии ФГБОУ ВО «Белгородский государственный аграрный университет имени В.Я. Горина», а также в 20 животноводческих сельскохозяйственных предприятиях Тюменской, Челябинской, Курганской, Белгородской областей и Республики Башкортостан. Исследования проведены в рамках направления 160 Программы ФНИ государственных академий наук на 2013-2020 гг. по теме «Разработка теоретических основ для создания и внедрения программы мониторинга, диагностики, лечебно-профилактических и оздоровительных мероприятий по защите животных от эпизоотически значимых инфекционных болезней». Система оздоровительных противолейкозных мероприятий с использованием комплексного серологического и гематологического тестирования, способствует сокращению количества РИД+ животных и гематологически больных особей за 6-месячный период на 32,0% и 6,28%, соответственно. Применение метода полимеразной цепной реакции способствует выявлению дополнительно от 18 до 39% телят с 15-дневного возраста, инфицированных вирусом лейкоза крупного рогатого скота, в неблагополучных по лейкозу животноводческих предприятиях. При исследовании методом ПЦР коров удается выявлять от 29% до 54% особей, инфицированных BLV. Это свидетельствует о необходимости последовательного применения серологических исследований и значимости молекулярно-генетических тестов для выявлении BLV инфицированных телят.
Ключевые слова: лейкоз крупного рогатого скота, EBL, вирус лейкоза крупного рогатого скота, BLV, оздоровительные противолейкозные мероприятия, ранняя диагностика, РИД, ПЦР, ИФА, эпизоотологический мониторинг, колостральный иммунитет.
Сведения об авторах:
Коваленко Анатолий Михайлович, доктор ветеринарных наук, профессор кафедры инфекционной и инвазионной патологии ФГБОУ ВО «Белгородский государственный аграрный университет им. В.Я. Горина»; 308503, Белгородская область, Белгородский район, п. Майский, ул. Вавилова, 1; тел.: 8-960-6283307; е-mail: mycobacteria@rambler.ru.
Явников Назар Валентинович, кандидат ветеринарных наук, доцент кафедры незаразной патологии ФГБОУ ВО «Белгородский государственный аграрный университет им. В.Я. Горина»; 308503, Белгородская область, Белгородский район, п. Майский, ул. Вавилова, 1.
Петропавловский Максим Валерьевич, кандидат ветеринарных наук, старший научный сотрудник ФГБНУ «Уральский федеральный аграрный научноисследовательский центр Уральского отделения Российской академии наук»; г. Екатеринбург, ул. Белинского, 112а; тел.: 8-902-8774657; е-mail: petropavlovsky_m@mail.ru.
Кривоногова Анна Сергеевна, доктор биологических наук, доцент, ведущий научный сотрудник ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; г. Екатеринбург, ул. Белинского, 112а; тел.: 8-982-6512934; е-mail: tel-89826512934@yandex.ru.
Ответственный за переписку с редакцией: Исаева Альбина Геннадьевна, доктор биологических наук, доцент, ведущий научный сотрудник ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; г. Екатеринбург, ул. Белинского, 112а; тел.: 8-902-8729810; e-mail: isaeva.05@bk.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|