|
||||

Ксеноимплантация матрикса костной ткани при замещении дефектов кости у кроликовУДК [611.018.4:616.71-007.21-089.844]:619-092.9 Накоскин А.Н., Дюрягина О.В., Ковинька М.А. ФГБУ Российский научный центр Введение. В ветеринарной хирургии органосберегающие операции всё чаще рассматриваются в качестве альтернативы ампутации конечности при опухолевом поражении костей опорно-двигательной системы [6]. В этой связи, одним из наиболее сложных и актуальных вопросов современной ветеринарной хирургии остается поиск возможных способов устранения различного рода дефектов, возникающих в результате метаболических нарушений в структуре костного обмена, в том числе и при заполнении дефектов, образованных после резекции костных опухолей [5]. В настоящее время для решения данной проблемы используют инактивированные костные ремпланты, а также импланты, изготовленные на основе аллокости [1]. Малоизученной остается возможность использования ксеноматериала в качестве альтернативы [7, 8], хотя исследования, посвященные этой проблеме, представлены в некоторых публикациях [9, 10].
Целью настоящего исследования является обоснование возможности использования имплантатов на основе ксенокости для замещения дефектов костей у домашних животных.
Материалы и методы исследования. В эксперименте исследована ксеноимплантация внеклеточного матрикса костной ткани. В качестве реципиентов использовались кролики вида Oryctolagus cuniculus породы "Советская шиншилла", самцы в возрасте от 8-ми месяцев до 1,2 лет, массой тела от 3 до 4,5 кг. Животные содержались в индивидуальных клетках. Кормление кроликов осуществлялось 1 раз в сутки по стандартному рациону, вода вволю.
Ксеноимплантационные материалы получали из губчатой костной ткани сельскохозяйственных животных: быка (Bos Taurus taurus) и лошади (Equus Linnaeus) по единой технологии [4]. Экспериментальные животные были распределены на следующие группы: контрольная группа (n=6) - дефект без заполнения); 1-я опытная группа (n=6) с имплантацией ксеноматрикса костной ткани быка; 2-я опытная группа (n = 6) с имплантацией ксеноматрикса костной ткани лошади.
Проведенные экспериментальные исследования выполнялись в соответствии с требованиями ГОСТ Р ИСО 10993-1-2009, Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях, с одобрения Этического комитета Центра Илизарова.
Оперативное вмешательство проводилось в стерильных условиях, под общим обезболиванием. Выполняли моделирование несквозных цилиндрических дефектов костной ткани размером 2*6 мм в двух "точках": на латеральной поверхности дистального метафиза правой и левой бедренной кости. В контрольной группе полученные дефекты не заполняли. В опытных группах в полость дефектов помещали исследуемый ксеноматрикс костной ткани.
Для профилактики развития септических послеоперационных осложнений в день операции животным контрольной и опытных групп выполняли однократное введение антибактериальных и противовоспалительных лекарственных средств.
В течение всего периода эксперимента клинически и рентгенологически оценивали реакцию организма животного на введение ксеноматрикса костной ткани быка и лошади. Клиническое обследование проводили ежедневно, рентгенологическое - на 7-е, 14-е, 30-е, 60-е и 90-е сутки опыта. Рентгенографию выполняли при помощи рентген-аппарата TOSHI-BA (Rotanode) Model E7239, N 10G 749 (Япония).
Результаты исследования. В ранний послеоперационный период общее состояние у кроликов в контрольной и опытных группах было удовлетворительное, отмечалось повышение температуры тела на 0,2-0,3°С, снижение аппетита. Потеря массы тела к 5-м суткам составила от 100 до 350 грамм. С 6-7 суток общее состояние животных улучшалось, аппетит восстанавливался до прежнего уровня. Животные вели себя активно, свободно передвигались в клетке. Хромоты не отмечалось. Слизистые оболочки были розовые. Функции желудочно-кишечного тракта и мочевыделительной системы соответствовали норме. В первые сутки после операции отмечали развитие умеренного асептического послеоперационного воспаления в зонах оперативных вмешательств. В области хирургического воздействия выявлялись средняя болезненность окружающих мягких тканей, небольшой послеоперационный отек и гиперемия. Отмечалось необильное выделение серозного экссудата из шва операционной раны. К седьмым суткам данные симптомы исчезали. На всём протяжении линии шва формировался темно-красный сухой струп шириной 2 мм. Полное заживление операционных ран у всех животных отмечали на 10-11-й день после операции.
В поздний послеоперационный период и до конца эксперимента состояние животных было хорошее, температура тела была в пределах физиологической нормы 38,5-39,1°С. Приём корма и воды без особенностей. Животные вели себя активно, хромоты не отмечалось. Прирост массы тела составил 150-380 г. Естественные физиологические отправления без изменений.
В зонах имплантации кожа гладкая, подвижная, эластичная послеоперационные рубцы бледные, тонкие. Проявления болезненности, припухлостей, уплотнений вглубь лежащих мягких тканей не отмечалось.
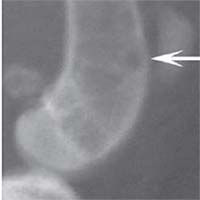
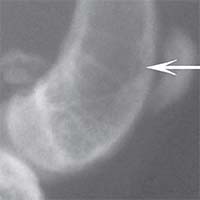
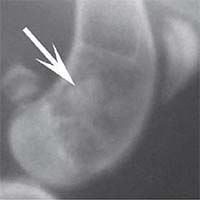
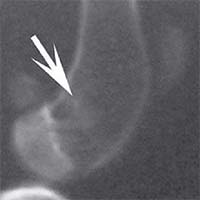
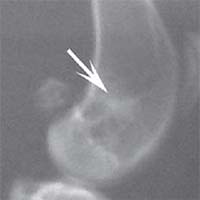
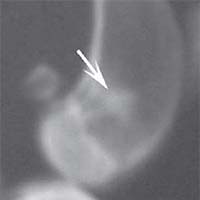
В контрольной группе животных в день операции на рентгеновском снимке в боковой проекции дефект метафиза бедра визуализировался, имел круглую форму с четкими краями, полость дефекта просматривалась хорошо. К 14-м суткам края дефекта не имели четких границ, были покрыты рыхлыми тенями костного регенерата. На 30-е сутки края дефекта сглаживались и плохо определялись. Плотность тканей полости дефекта была приближена к плотности "материнской" кости, объём дефекта уменьшился. К 60-м суткам края дефекта принимали веретенообразную форму, вытянутую вертикально. Полость дефекта просматривается плохо. К 90-м суткам дефект метафиза бедренной кости замещался полностью новообразованной костной тканью и был неотличим по плотности от материнской кости (рисунок 1).
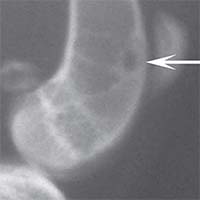
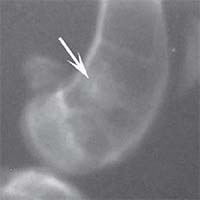
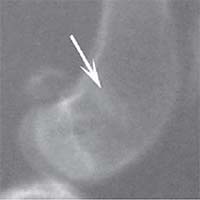
Рис. 1. Рентгенологическая картина замещения дефекта метафиза бедренной кости кролика в контрольной группе: а) день операции, б) 14 суток, в) 30 суток, г) 60 суток, д) 90 суток У животных первой опытной группы с имплантацией ксеномат-рикса костной ткани быка в день операции на рентгеновском снимке в зоне дефекта метафиза бедра виден имплантационный материал, плотность которого была приближена к плотности корковой пластинки кости животного. Края дефекта имели неправильную "многогранную" форму с четкими границами. К 14-м суткам имплантируемый материал хорошо визуализировался, был рентген-контрастен, его структура была выражена. К 30-м суткам плотность имплантируемого материала как в метафизах бедер, так и в телах позвонков без изменений. Признаков изменения структуры материнской кости не отмечается. На 60-е сутки появлялись признаки снижения плотности и уменьшения объема имплантируемого материала. Определялись нити костных трабекул, идущие к ксеноматриксу. К 90-м суткам имплантат не имел четких границ и принимал вид слабоконтрастной облаковидной тени. На рентгеновских снимках отдельные частицы материала определялись в виде плотных точек, связанных с материнской костью нитями костных трабекул (рисунок 2).
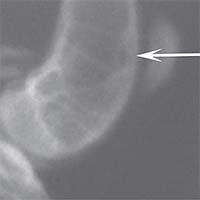
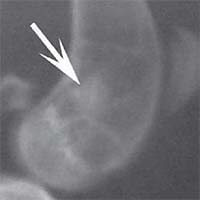
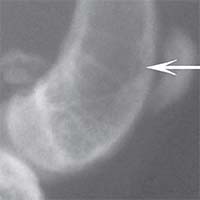
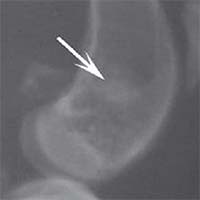
Рис. 2. Рентгенологическая картина замещения дефекта метафиза бедренной кости кролика в первой опытной группе с имплантацией ксеноматрикса кости быка: а) день операции, б) 14 суток, в) 30 суток, г) 60 суток, д) 90 суток У животных второй опытной группы с имплантацией ксеномат-рикса костной ткани лошади в день операции на рентгеновском снимке виден имплантационный материал, структура его неоднородная, плотность приближается к плотности корковой пластинки кости животного. Края дефекта не имеют четких границ. На 14-е сутки отмечалось увеличение плотности и сглаживание структуры материала. К 30-м суткам плотность имплантируемого материала была без изменений. Признаков изменения структуры материнской кости не отмечалось. На 60-е сутки эксперимента плотность имплантируемого материала также была без изменений. Замечено образование костных трабекул, соединяющих материал с материнской костью. К 90-м суткам края материала не имеют четких границ, но плотность имплантируемого материала оставалась без изменений по сравнению с предыдущим сроком исследования. На рентгеновских снимках определяются четкие, контрастные тени костных трабекул, связывающих ксеномате-риал и материнскую кость (рисунок 3).
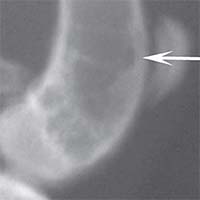
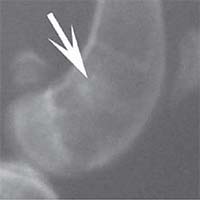
Рис. 3. Рентгенологическая картина замещения дефекта метафиза бедренной кости кролика во второй опытной группе с имплантацией ксеноматрикса кости лошади: а) день операции, б) 14 суток, в) 30 суток, г) 60 суток, д) 90 суток Таким образом, клиническая картина течения постимпланта-ционного периода при использовании ксеноматериалов, полученных из костной ткани быка и лошади, свидетельствует об отсутствии признаков отторжения имплантатов.
Результаты рентгенологических исследований показали, что у животных второй и третьей групп имплантируемый ксеноматериал определялся в зоне дефекта до 30-ти суток эксперимента. К 90-м суткам эксперимента наблюдались рентгенологические признаки замещения зоны имплантации новообразованной костной тканью. Однако, динамика замещения дефектов при имплантации материала из костной ткани быка и лошади различной. Резорбция имплантационного материала, изготовленного из костной ткани быка, наступала быстрее,чем материала, изготовленного из кости лошади. Костный матрикс из кости лошади претерпевал изменения более медленно, к 90-м суткам эксперимента хорошо определялся в зоне имплантации.
Согласно проведенным исследованиям костный матрикс, полученный из костной ткани быка и лошади, может быть рекомендован в качестве имплантационного материала для замещения дефектов костной ткани других видов домашних животных. Список литературы:
Резюме. Одним из наиболее сложных и актуальных вопросов современной ветеринарной хирургии является поиск возможных способов устранения различного рода дефектов, возникающих в результате метаболических нарушений в структуре костного обмена, в том числе и при заполнении дефектов, образованных после резекции костных опухолей. В работе представлены результаты изучения возможности применения ксеноматериалов для замещения дефектов костей. В качестве ксеноматериалов использовали подготовленную по оригинальной методике губчатую костную ткань быка и лошади. Исследовали клинические и рентгенологические признаки замещения дефектов костей у кролика. В результате исследования установлено, что использование ксеноматериалов на основе губчатой костной ткани приводит к замещению костного дефекта, несмотря на видовые отличия. Однако, динамика замещения дефектов при использовании имплантов из губчатой кости быка и лошади является различной. Резорбция имплантационного материала, изготовленного из костной ткани быка, наступала быстрее, чем материала, изготовленного из кости лошади. Костный матрикс из кости лошади претерпевал изменения более медленно, к 90-м суткам эксперимента хорошо определялся в зоне имплантации. Согласно проведенным исследованиям костный матрикс, полученный из костной ткани быка и лошади, может быть рекомендован в качестве имплантационного материала для применения в ветеринарной хирургии с целью замещения дефектов костной ткани других видов домашних животных.
Ключевые слова: ксеноимплантация, замещение дефектов костей, позвоночник, бедро, ренгенологические исследования, клинические исследования, ветеринарная хирургия, кролик, бык, лошадь.
Сведения об авторах:
Дюрягина Ольга Владимировна, кандидат ветеринарных наук, старший научный сотрудник ФГБУ "РНЦ "ВТО" имени академика Г. А. Илизарова" Минздрава России; 640014, г. Курган, ул. М. Ульяновой, 6; тел.: (3522)45-05-38; e-mail: diuriagina@mail.ru. Ковинька Михаил Александрович, кандидат биологических наук, старший научный сотрудник ФГБУ "РНЦ "ВТО" имени академика ГА. Илизарова" Минздрава РФ; 640014, г. Курган, ул. М. Ульяновой, 6; тел.: (3522)45-05-38; e-mail: mkovinka@mail.ru.
Ответственный за переписку с редакцией: Накоскин Александр Николаевич, кандидат биологических наук, старший научный сотрудник ФГБУ "РНЦ "ВТО" имени академика Г.А. Илизарова" Минздрава РФ; 640014, г. Курган, ул. М. Ульяновой, 6; тел.: (3522)45-05-38; e-mail: nakoskin_a@mail.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|