|
||||

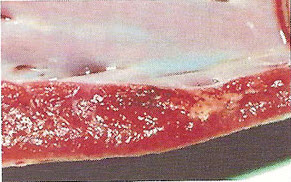
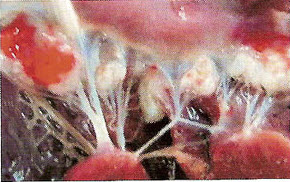
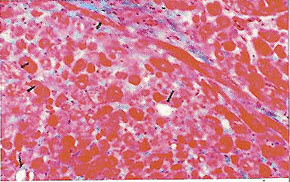
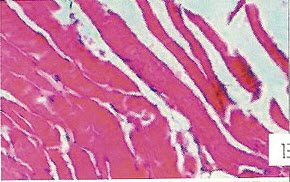
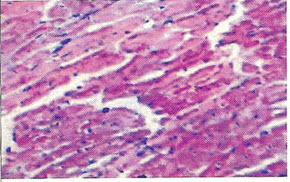
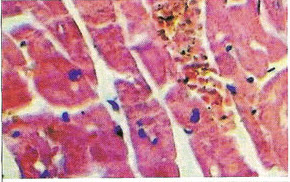
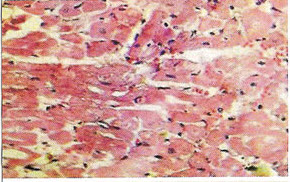
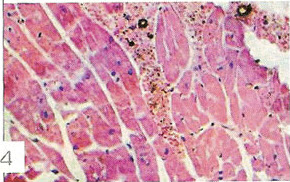
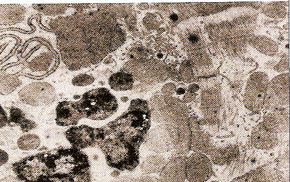
Морфологические изменения в миокарде при цирковирусной инфекции у свинейС.Н. Карташов, A.M. Ермаков, А.Г. Ключников ГНУ СКЗНИВИ РАСХН, Цирковирусная инфекция свиней - чрезвычайно широко распространенное заболевание, вызванное цирковирусом типа 2. В хозяйствах заболевание чаще всего проявляется синдромом мультисистемного истощения и патологией беременности. ВС-2 (PCV-2) - болезнетворный вирус, вызывающий послеотьемный синдром мультисистемного истощения (ПСМИ) у свиней [1,2]. В дополнение к ПСМИ, считают, что вирус ЦВС-2 может у зараженных животных вызвать дерматиты, нефротический и нефритический синдромы, поражения практически всех паренхиматозных органов [3]. Вместе с тем, гистологические изменения у свиней при цир-ковирусной инфекции еще полностью не описаны, что и определило цель нашего исследовании. В период с июля по декабрь 2008 года нами было исследовано 1038 голов поросят 3-5 месячного возраста, из них у 431 головы (41,52%) в полимеразной цепной реакции был обнаружен цирковирус, клинически заболевание проявлялось у 94 голов (9%), при этом у 87 из них (92,55%) при гистологическом исследовании были обнаружены изменения в сердце. Цель и задачи исследования. Исходя из вышеизложенного, целью нашей работы явилось уточнение морфологических особенностей поражения миокарда у свиней при синдроме послеотьемного мультисистемного истощения. Материал и методы исследования. Для решения поставленных задач нами было обследовано 94 свиньи с диагнозом синдром послеотьемного мультисистемного истощения, который был поставлен методом выделения ДНК PCV-2 в ПЦР. Все животные были подвергнуты эвтаназии или посмертному патологоанато-мическому вскрытию с последующим морфологическим исследованием сердца. Из образцов сердца, фиксированных в формалине и заключенных в парафин, изготовляли серийные срезы толщиной 4 мкм с последующей окраской гематоксилином и эозином. Результаты исследования. При макроскопическом исследовании отмечались петехиальные и полосчатые кровоизлияния под эпикардом и эндокардом клапанного аппарата сердца (рис. 2). На разрезе в миокарде обнаруживались трансмуральные и субэндокардиальные участки серого цвета, не резко контрастирующие с окружающим неизмененным миокардом. Такие участки соседствовали с участками темно-красного цвета (рис. 1). Гистологически в миокарде в исследованной группе у 36 животных (38,3%) были выявлены следующие особенности по сравнению с контролем. Отмечалась неравномерная гипертрофия отдельных пучков и пластов мышечных волокон, сочетающаяся с выраженным диффузно-очаговым интерстициальным склерозом. Наряду с участками резкой гипертрофии мышечных волокон, встречались отдельные локусы истонченных и как бы вытянутых мышечных волокон. В ряде случаев эти участки контактируют друг с другом. Гипертрофированные кардномиоциты имели диаметр от 12 до 17 мкм, тогда как в группе контроля диаметр кардиоми-оцитов колебался от 8 до 12 мкм. При атрофических изменениях кардиомиоцита его толщина была менее 8 мкм. В данном случае очаги атрофированных карди-омиоцитов имеют мелкоочаговый характер и контактируют с гипертрофированными волокнами (рис. 4). Участки контрактур чередовались с участками пере растяжения мышечных волокон. При этом мышечные волокна, находящиеся в состоянии контрактуры, выглядят более короткими и утолщенными, ядра округлые. Растянутые кардиоми-оциты выглядят более длинными, а ядра вытянутыми (рис. 5). В отдельных кардиомиоцитах одинаковой длины и диаметра отмечается выраженный полиморфиз ядер. Некоторые ядра достигают в диаметре 8 мкм, тогда как у соседних кардиомиоцитов их величина не превышает 2-3 мкм (рис. 5, 6). Межклеточный отек в миокарде обозначается резко выраженным увеличением пространств между отдельными кардиомиоцита ми в области синцитиальных контактов (рис. 6,7,8). Расширение пространств между боковыми стенками кардиомиоцитов обусловлено расширенными капиллярами или отеком стенки капилляров (рис. 8). Перинуклеарная вакуолизация чаще встречалась в гипертрофированных и конт-рактурных кардиомиоцитах (рис. 8). В 14 случаях (14,89%) отмечается выраженное нарушение расположения слоев кардиомиоцитов. Архитектоника миокарда нарушена, слои кардиомиоцитов идут в различных направлениях (рис. 7). Иногда отдельные мышечные пучки были волнисто извиты, между ними можно было видеть сетчатый интерстициальный и периваскулярный склероз. Капиллярная сеть местами расширена и переполнена эритроцитами, при этом отмечается сладж феномен. Местами эритроцитов в капиллярах нет, но вокруг капилляров отмечается фиброз. При окраске гематоксилин-эозином это выглядит как увеличенные просветы между отдельными кардиомиоцитами, заполненные волокнистой структурой (рис. 5). Некоторые прекапиллярные артериолы резко переполнены, в этих участках отмечаются кардиомиоциты без ядер и начинающийся распад кардиомиоцитов - кардиолизис (рис. 5,6).
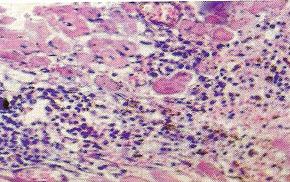
В некоторых случаях (10 поросят, или 10,64%) наблюдались обширные участки кардиолизиса, где кардиомиоциты выглядят резко уменьшенными и сморщенными, между ними увеличены межклеточные расстоянии. Позже такие кардиомиоциты подвергаются фрагментированию (рис. 5). Еще один гистопатологический признак встречался в 27 случаях (28,72%) в миокарде у свиней при ПСМИ, это расщепление кардиомиоцитов. По ходу карди-омиоцита обнаруживается довольно большая щель, заполненная капилляром, в котором могут присутствовать эритроциты [4,5]. Электронно-микроскопический анализ кардиомиоцитов при ПСМИ у свиней показал, что в сократительных структурах кардиомиоцитов - миофибриллах - преобладали расслабленные саркомеры (длина 2,13+0,1 мкм), однако можно было наблюдать кардиомиоциты, в которых отмечались как расслабленные, так и пересокращенные миофибриллы. В контрольном материале длина саркомера составила 15,66±0,4 мкм. В миокарде Z-диск, с помощью которого кардиомиоциты соединяются в мышечные "волокна", был часто расширен и имел извилистый ход. В отдельных кардиомиоцитах обнаруживалась явная атрофия миофибриллярного аппарата с гиперплазией мелких митохондрий. Матрикс митохондрий был просветлен, в нем выявлялись аморфные и внутрикристные электронноплотные включения; аморфные включения располагались между редуцированными кристами митохондрии. Выявлены кардиомиоциты, в которых отмечается процесс утраты [5], "лизиса" миофибрилл, их дезорганизация с полиморфизмом Z-материала, наличие обилия мелких мультиформных митохондрий, для них характерно хорошее развитие гранулярного и гладкого эндоплазматического ретикулума, комплекса Гольджи, наличие ядер с диспергированным хроматином (рис. 9). При морфометрическом исследовании обнаружено снижение количества микрососудов на единицу площади среза миокарда: в контрольной группе это количество было 2736±217, в то время как у поросят с СПМИ плотность микро-циркуляторного русла резко падала и составляла 1135+398. Ультраструктурное исследование микроциркуляторного русла показало, что и эти малочисленные микрососуды миокарда были часто выключены из системы микроциркуляции: встречались спавшиеся капилляры, окруженные плотной соединительно-тканной муфтой. Базальная мембрана капилляров была расширена, слоиста. Часто просвет капилляров оказывался полностью закрытым конгломератами из форменных элементов крови, тромбоцитов, или обтурирован крупным цитоплазматическим выступом эндотелиальной клетки. Пространство между кардиомиоцитами и капиллярами было увеличено, что еще в большей степени ограничивало питание кардиомиоцитов. У 85,11% исследованных нами животных отмечались преимущественно лимфоцитарные инфильтраты. В зоне поражения также присутствовали дегенеративные изменения кардиомиоцитов, вплоть до кардиолизиса, в таких активных очагах отмечались расширение сосудов и заполнение их кровью, в некоторых сосудах отмечалось тромбообразование (рис. 10). Заключение. В ходе проведенных гистологических исследований выявлены основные изменения миокарда у поросят с клинически выраженным синдромом послеотъемного мультисистемного истощения. Лимфоцитарные инфильтраты отмечались у 80,11% поросят, неравномерная гипертрофия отдельных пучков и | пластов мышечных волокон, сочетающаяся с выраженным диффузно-очаговым интерстициальным склерозом - у 38,30%, расщепление кардиомиоцитов - у 28,72%, нарушение расположения слоев кардиомиоцитов - у 14,89% и обширные участки кардиолизиса - у 10,64% животных. Литература
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|