|
||||

Сравнительная характеристика штаммов Bacillus Subtilis как перспективных кандидатов в пробиотики для животноводстваУДК 579.64 Мухаммадиев Риш. С., Мухаммадиев Рин. С. Федеральное государственное бюджетное научное учреждение «Всероссийский Микробная экосистема (микробиота) пищеварительной системы сельскохозяйственного животного участвует в процессе поддержании здорового состояния и нормального функционирования его организма [1, 18]. При этом ингредиенты, которые используются в составе рациона животного, утилизируются за счет метаболической способности микроорганизмов, населяющих его желудочно-кишечный тракт [17, 36]. В современных условиях интенсификации животноводства, включая птицеводства, повышается риск возникновения нарушений микроэкологии кишечника (дисбиотическое состояние) у молодняка сельскохозяйственных животных на фоне использования низкого качества рациона и воздействия отрицательных факторов внешней среды [12, 21]. Нарушения структуры кишечного микробиоценоза, которые характеризуются низким разнообразием и количеством уникальных видов бактерий, способствуют развитию различных инфекций [37]. В промышленном животноводстве в качестве средств предотвращения и лечения инфекций животных активно используются антибиотики [16, 21]. В этом плане наиболее применяемыми классами антибиотических препаратов являются макролиды, тетрациклины, сульфонамиды, фторхинолоны, аминогликозиды, в-лактамные и полиеновые антибиотики и другие [3]. Установлено, что активное использование указанных средств в субингибирующих количествах существенно способствует дестабилизации генома бактерий, повышая вирулентность или диссеминацию их генетического материала, который связан с резистентностью [3, 39]. Устойчивые к антибиотикам бактерии могут обнаруживаться продуктах животноводства, включая социально значимых (мясо, яйца и другие) [6, 32], что, в свою очередь, увеличивает риск горизонтального переноса генов резистентности условно-патогенных и патогенных бактерий в микробиом человека. Исследователями экспериментально подтверждено факт передачи клинически важными антибиотикрезистентными генами между сельскохозяйственными животными и сотрудниками ферм [3, 24]. В связи с этим для коррекции дисбиотических состояний кишечника сельскохозяйственных животных и в качестве альтернативы антибиотическим средствам исследователями были предложены пробиотики [11, 18]. Согласно данным группы экспертов Международной научной ассоциации пробиотиков и пребиотиков (International Scientific Association for Probiotics and Prebiotics, ISAPP), пробиотики определяются как живые идентифицированные организмы, которые в достаточных концентрациях оказывают положительный эффект на здоровье хозяина [8]. В существенной степени в состав указанных препаратов входят микроорганизмы, принадлежащие к родам Lactococcus, Lactobacillus, Bifidobacterium, Enterococcus и Streptococcus [7, 14]. К настоящему времени выявлено, что проявлять пробиотические свойства способны и виды спорообразующих бактерий, принадлежащие к роду Bacillus, которые, отличаясь биологическими особенностями от остальных микроорганизмов-пробиотиков, имеют ряд преимуществ при их использовании [11, 16]. Пробиотический штамм микроорганизма в составе пробиотика обладает индивидуальными метаболическим потенциалом и характеризуется определенной эффективностью [12, 13]. Поэтому особое внимание исследователи отводят поиску новых микробных штаммов и характеристике биологических особенностей последних [11, 14]. В этом плане поливидовой или полиштаммовый пробиотик потенциально способен обеспечивать разные способы воздействия, приводя к синергетическому эффекту [14, 10]. В Федеральном центре токсикологической, радиационной и биологической безопасности (ФГБНУ «ФЦТРБ-ВНИВИ») и Всероссийском научно-исследовательском институте фитопатологии (ФГБНУ ВНИИФ) изолированы спорообразующие штаммы B. subtilis МР2 и B. subtilis RF-45 - продуценты биологически активных метаболитов. Целью настоящей работы было сравнительно оценить биологические свойства спорообразующих штаммов B. subtilis МР2 и RF-45, их потенциал как кандидатов в пробиотики для животноводства. Материалы и методы исследований. Объектами исследований были спорообразующие штаммы B. subtilis МР2 и RF-45, которые изолированы из природных источников экониш Республики Татарстан (Россия) и Московской области (Россия). Их физиолого-биохимические особенности, идентификация, способность к продукции внеклеточных гидролаз, а также некоторые другие свойства in vitro и in vivo были установлены нами ранее [27, 28]. Бациллярные культуры поддерживали и выращивали, используя соответственно среду LB-агар или LB-бульон (Luria Bertani) (Condalab, Испания). Тест-культурами служили бактерии Staphylococcus aureus (грамположительные), Escherichia coli, S. enterica (грамотрицатель-ные) и грибы F. graminearum, F. moniliforme, F. sporotrichioides (из коллекций ФГБНУ «ФЦТРБ-ВНИВИ» и ФГБНУ ВНИИФ). Антимикробный потенциал исследуемых спорообразующих бактерий относительно возбудителей различных инфекций сельскохозяйственных животных определяли с помощью метода диффузии в агар [14]. Для этого отделяли бактериальные клетки от супернатанта (далее, БС) бацилл путем центрифугирования культуральной жидкости (далее, КЖ) при 3.8 тыс. g в течение 12 мин. Клетки бактерий суспендировали, применяя стерильный физиологический раствор, с целью получения их клеточной суспензии (далее, КС) [14, 23]. Далее вносили по 100 мкл КС, КЖ или БС спорообразующих бактерий в лунки (диаметр 10 мм) агара с тест-культурой. Инкубацию осуществляли при температуре (35,0±1,0)°C в течение 24 ч. Степень антимикробного потенциала бацилл устанавливали согласно зоне задержки роста возбудителя различных инфекций животных вокруг лунок. Антимикробный потенциал бацилл относительно токсин-обра-зующих грибов осуществляли с помощью способа, который был описан нами в более раннем исследовании [27]. Анализ степени антагонистической активности бациллярных штаммов оценивали согласно размеру зоны ингибирования тест-грибов. Имитацию процесса транзита спор бациллярных штаммов по пищеварительной системе животного in vitro осуществляли последовательным их выдерживанием в среде LB-бульон с пепсином (Sigma-Aldrich, США) (рН 2.5) (соответствует желудку) и бычьей желчью (pH 7,5) (Merck, США) (соответствует кишечнику) в течение 3 и 8 ч соответственно [11]. Содержание жизнеспособных клеток (КОЕ/мл), которые прорастали из спор бацилл, анализировали способом последовательных 10-кратных разведений с использованием LB-агара. Анализ адгезивной способности бацилл осуществляли in vitro с помощью клеток линии НТ-29 [22, 35]. Установление гемолитической активности бациллярных штаммов проводили, используя Колумбийский (кровяной) агар (Conda, Испания) [35, 38]. Поиск генов, которые кодируют различные токсины, в бациллах проводили методом, описанным нами в более раннем исследовании [28]. Эксперименты, в которых использовались лабораторные животные (мыши), осуществляли строго, опираясь на принципы Европейской Конвенции по защите позвоночных животных (Страсбург, 1986), а также требования, определенные в Директиве Европейского Парламента и Совете Европейского Союза [15]. Определение эффективности исследуемых в работе бацилл в коррекции нарушений кишечной микроэкологии животных осуществляли на 36 белых мышах (живая масса 19-21 г.), используя модель дисбактериоза, индуцированного антибиотическим препаратом гентамицином [19]. Мышей с гентамицин-ассоциирован-ным дисбиозом разделяли на 4 равные группы:
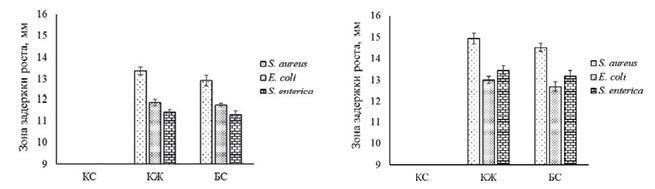
На последние сутки исследования осуществляли патологоанатомическое вскрытие мышей всех групп с целью забора из толстой кишки их фекальных масс. В фекалии животных количественно (КОЕ/мл) анализировали различные группы микроорганизмов методом последовательных 10-кратных разведений фекальной суспензии с последующим переносом ее в соответствующие питательные среды [9, 14]. Статистическую обработка полученных после экспериментальных исследований данных проводили, используя стандартные методики, как описано нами ранее [4]. Результаты исследований и их обсуждение. В настоящей работе анализировали антимикробный потенциал КС, КЖ и БС спорообразующих штаммов B. subtilis МР2 и RF-45 против видов бактерий - возбудителей различных инфекций сельскохозяйственных животных, а также микромицетов, способных к продукции фузариотоксинов. Установлено, что КЖ и БС исследуемых бацилл характеризовались ингибирующим эффектом относительно всех использованных в нашем исследовании тест-бактерий. Тем не менее, по сравнению с штаммом МР2, B. subtilis RF-45 на 8,18-18,07 % эффективнее подавлял рост тест-бактерий (рисунок 1).
Рис. 1. Антимикробный потенциал КС, КЖ и БС штаммов B. subtilis МР2 (слева) и RF-45 (справа) относительно бактерий-возбудителей различных инфекций сельскохозяйственных животных (различия между значениями антагонистической активности КЖ и антагонистической активности БС бацилл статистически не значимы при p=0,05) Следует отметить, что в условиях эксперимента КС бацилл не проявляла антагонистического влияния на S. aureus, E. coli и S. enterica. Бациллярные штаммы проявляли антагонистические свойства относительно токсинобразующих микромицетов (табл. 1) [27], при этом в случае штамма RF-45 отмечали его более высокий анти-грибной потенциал. Таблица 1 Антимикробный потенциал бациллярного штаммов МР2 в отношении токсинобразующих микромицетов
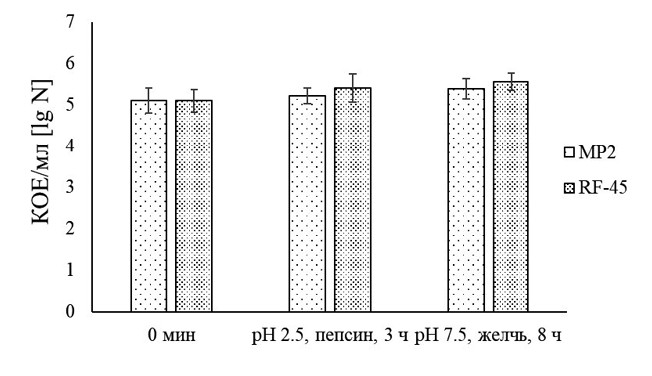
Способность штаммов B. subtilis МР2 и RF-45 подавлять рост не только условно-патогенных и патогенных бактерий, но и видов микромицетов Fusarium spp. является одной из основных характеристик пробиотиков, в связи с тем, что корма могут заражаться грибами-продуцентами микотоксинов, которые потенциально способствуют развитию дисбиотических изменений кишечной микробиоты сельскохозяйственных животных [11]. Наличие антимикробного потенциала изучаемых бацилл в отношении использованных в нашем исследовании тест-микроорганизмов безусловно связано с их способностью продуцировать ряд биологически активных метаболитов. Ранее нами было показано, что бациллярный штамм МР2 образует экзополисахариды, бактерио-цины сидерофоры и ферменты [28], а штамм RF-45 - гидролазы [27]. В литературе указывается, что уникальность представителей вида Bacillus subtilis заключается в том, что около 5 % их генома кодирует образование разных противомикробных соединений [33]. Антибактериальный и антигрибной потенциал данных спорообразующих бактерий связан с их способностью к синтезу летучих соединений (CO2, H2S, HCN, NH3, жирные кислоты, терпеноиды), поликетидов (диффицидин, бациллаен, макролактин), гидролитических ферментов (лактоназа, хитозаназа, целлюлаза, глюканаза, протеаза) и многих других метаболитов [11, 33]. Одним из основных факторов, который способен ограничивать применение в животноводстве штаммов микроорганизмов - потенциальных кандидатов в пробиотики, является устойчивость последних к пищеварительным стрессам [10, 12]. Некоторые штаммы, обладающие пробиотическими свойствами, утрачивают существенную часть (до 90%) своего функционального потенциала вследствие воздействия на них пищеварительных ферментов и кислот желудка, высокой осмолярности среды, недостатка источников питания, солей желчных кислот кишечника животного [5, 37]. После последовательного инкубирования спор B. subtilis МР2 и RF-45 в питательной среде с пепсином (рН 2,5) в течение 3 ч и бычьей желчью (рН 7,5) в течение 8 ч их жизнеспособность находилась на уровне контроля (концентрации спор бактерий в начале нашего исследования) (рисунок 2).
Рис. 2. Жизнеспособность спор штаммов B. subtilis МР2 и RF-45 в условиях in vitro, имитирующих процесс их транзита по пищеварительной системе животного (различия между значениями концентрации спор бацилл статистически не значимы (р>0,05)) Обеспечение колонизационной резистентности слизистой оболочки кишечника по отношению к возбудителям кишечных инфекций животного является значимым свойством пробиотиков [22, 35]. Нами показано, что споры исследуемых штаммов бацилл обладали способностью адгезироваться на клетках линии НТ-29. При этом наиболее высокий показатель адгезии выявлен у B. subtilis МР2: после инкубации в течение 2 ч при 37,0°С количество адгезированных на клетках колоректального рака жизнеспособных его спор было выше в 1,87 раза относительно значений данного показателя спор штамма RF-45 (табл. 2). Таблица 2 Сравнительная характеристика некоторых пробиотических свойств бациллярных
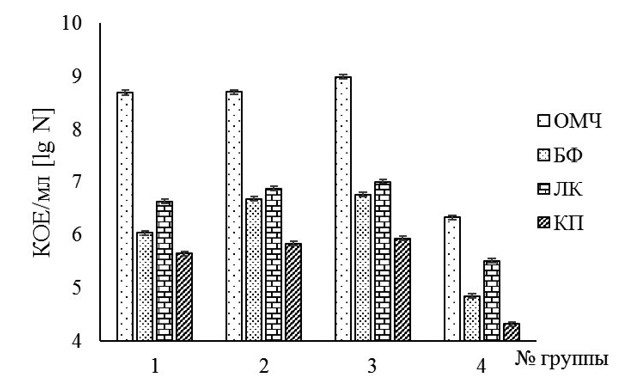
Примечание: «-» - отсутствие признака; * - результаты исследования представлены в более ранней нашей работе [28]; различия статистически значимы при p<0,05 В изученной нами литературе указано, что по сравнению с пробиотическими микроорганизмами, характеризующимися низким уровнем адгезии, высокоадгезивные бактерии, закрепляясь на поверхности колоноцитов, более эффективно выполняют свои функциональные свойства, тем самым, оказывают положительное воздействие на рост организма животного и устойчивость последнего к различным инфекционным агентам. [2]. Несмотря на то, что штаммам Bacillus subtilis присвоен статус QPS Qualified Presumption of Safety), их безопасность должна быть подтверждена в исследованиях in vitro и in vivo [11, 35]. В наших исследованиях безопасность B. subtilis МР2 и RF-45 была протестирована по направлению поиска факторов патогенности и генов, кодирующих энтеротоксины и цитотоксин K. Оба изучаемых штамма бацилл не характеризовались гемолитической активностью, а также не несли гены синтеза токсинов (hbl, nhe и cytK) (табл. 2) [29], что указывает о их потенциальной безопасности. Схожие результаты были получены зарубежными исследователями, которые не выявили у изолированных из кимчи и почвы штаммов B. subtilis P223 и BS50 генов, ответственных за продукцию энтеротоксинов и цитотоксина K [34, 35]. Необходимо отметить, что наличие активности гидролитических ферментов (ксиланазы, целлюлазы, пектиназы, амилазы, фитазы, протеазы и липазы) у B. subtilis МР2 и RF-45 [27, 28] свидетельствует о их возможной способности нормализовать процессе пищеварения: повышать перевариваемость (гидролиз) компонентов рациона, содержащих некрахмалистые полисахариды (антипита-тельные факторы), способствуя увеличению всасывания питательных веществ кишечником сельскохозяйственных животных. Важным этапом при разработке пробиотиков является оценка их эффективности на модельных животных. В настоящей работе изучали эффективность B. subtilis МР2 и/или RF-45 при нормализации нарушений микроэкологии кишечника у белых мышей с дисбиозом, индуцированным антибиотиком гентамицином. Для инициации у животных дисбиоза животным вводили антибиотик per os в дозе 5,8 мг/ сутки в течение 7 дней. В результате применения гентамицина отмечали существенное снижения содержания основных представителей (бифидобактерий (БФ), лактобактерий (ЛК) и кишечной палочки (КП)), а также общего количества микроорганизмов (ОМЧ) кишечной микробиоты животных опытных и контрольной групп (табл. 3). Таблица 3 Численность микроорганизмов (КОЕ/г [lg N]) в содержимом кишечника белых мышей гентамицин-индуцированным дисбиозом
Примечание: различия статистически значимы при p<0,05 Установлено, что раздельное или совместное выпаивание спор бациллярных штаммов приводило к повышению численности ОМЧ, БФ, ЛК и КК в содержимом кишечника животных с гента-мицин-индуцированным дисбиозом. При этом в группе мышей, которые получали суспензию спор штамма RF-45, содержание кишечной палочки было больше в 1,02 раз, бифидобактерий - в 1,12 раза, лактобактерий - 1,04 раза относительно значений указанного показателя группы животных, получавших суспензию спор штамма МР2 (рисунок 3).
Рис. 3. Сравнительная оценка эффективности B. subtilis МР2 и/или RF-45 при нормализации нарушений микроэкологии кишечника у белых мышей с гентамицин-ассоциированным дисбиозом (различия между значениями ОМЧ в содержимом кишечника животных 1 группы и ОМЧ в содержимом кишечника животных 2 группы не значимы (р>0,05)) В ряде работ отечественных и зарубежных исследователей показано, что штаммы Bacillus subtilis способны стимулировать рост бактериальных клеток представителей семейства Lactobacillaceae [26, 30, 31]. Некоторыми исследователями подтверждена взаимосвязь вышеуказанного эффекта со способностью Bacillus subtilis образовывать циклические дипептиды [25] и различные белки (субтилизин, каталаза, супероксиддисмутаза, амилаза и протеаза) [26, 29]. Более низкая эффективность B. subtilis МР2 при нормализации нарушений микроэкологии кишечника у мышей с дисби-озом, по-видимому, обусловлена пониженным пробиотическим потенциалом бациллы. Полученные нами данные указывают на более высокую эффективность полиштаммовых пробиотиков по сравнению с моно-штаммовыми пробиотиками как средствами терапии кишечных инфекций животных, что, вероятно всего, связано со способностью входящих в их состав различных штаммов обеспечивать разные способы воздействия, приводя к синергетическому эффекту. Заключение. Таким образом, штаммы B. subtilis МР2 и RF-45 обладали антимикробным потенциалом против патогенных и условно-патогенных бактерий и токсинпродуцирующих микромицетов, что может быть связано с действием биологически активных метаболитов, включая гидролитических ферментов. Споры обоих бацилл сохраняли жизнеспособность в условиях in vitro, имитирующих процесс их транзита по пищеварительной системе животного, характеризовались способностью адгезироваться на клетках линии НТ-29 и эффективностью при нормализации нарушений микроэкологии кишечника у мышей с гентамицин-ассоциированным дисбиозом. Вегетативные клетки исследуемых бациллярных штаммов не проявляли гемолитическую активность, а также не несли гены, ответственные за синтез энтеротоксинов и цитотоксина K, указывая о их потенциальной безопасности. Согласно полученным нами данным, можно заключить, что штаммы B. subtilis МР2 и RF-45 являются перспективными кандидатами в пробиотики для животноводства. Работа поддержана грантами Президента РФ МК-2439.2022.5 и РНФ № 23-26-00161. Список литературы: 1. Бактериальное сообщество слепых отростков кишечника цыплят-бройлеров на фоне питательных рационов различной структуры / В. И. Фи-синин, Л. А. Ильина, Е. А. Йылдырым [и др.] // Микробиология. 2016. Т. 85. № 4. С. 472-480. 2. Влияние адгезивной активности бактерий Lactobacillus paracasei B-11821 на эффективность биопрепарата, предназначенного для использования в свиноводстве / Н. В. Позолотина, И. В. Дармов, И. В. Маракулин [и др.] // Ученые записки Казанского университета. Серия: Естественные науки. 2018. Т. 160. № 1. С. 54-66. 3. Влияние антибиотиков, использующихся в животноводстве, на распространение лекарственной устойчивости бактерий (обзор) / И. С. Сазы-кин, Л. Е. Хмелевцова, Е. Ю. Селиверстова [и др.] // Прикладная биохимия и микробиология. 2021. Т. 57. № 1. С. 24-35. 4. Выделение, очистка и изучение физикохимических свойств кси-ланазы штамма Bacillus subtilis 9 / Л. Р. Валиуллин, Р. С. Мухаммадиев, Р. С. Мухаммадиев [и др.] // Достижения науки и техники АПК. 2021. Т. 35. № 10. С. 66-71. 5. Выживаемость микроорганизмов пробиотиков в желудочно-кишечном тракте экспериментальных животных / И. В. Дармов, И. Ю. Чичерин, И. П. Погорельский [и др.] // Журнал инфектологии. 2012. Т. 4. № 1. С. 68-74. 6. Динамика антибиотикочувствительности штаммов Enterococcus faecium на молочно-товарных фермах в районах с разным уровнем загрязнения агробиоценозов / И. М. Донник, О. А. Быкова, Я. Ю. Лысова [и др.] // Ветеринария Кубани. 2019. № 1. С. 7-10. 7. Исследование цитотоксичности молочнокислых и пропионовокислых бактерий в тесте in vitro / Р. С. Мухаммадиев, Р. С. Мухаммадиев, Е. В. Скворцов, [и др.] // Ветеринарный врач. 2019. № 4. С. 17-20. 8. Лактобациллы: правовое регулирование и перспективы создания препаратов нового поколения / Р. А. Юнес, Е. У. Полуэктова, Т. В. Белкина [и др.] // Прикладная биохимия и микробиология. 2022. Т. 58. № 5. С. 520-534. 9. Молочнокислые и пропионовокислые бактерии: формирование сообщества для получения функциональных продуктов с бифидогенными и гипотензивными свойствами / А. В. Бегунова, И. В. Рожкова, Е. А. Зверева [и др.] // Прикладная биохимия и микробиология. 2019. Т. 55. № 6. С. 566-577. 10. Молочнокислые и спорообразующие бактерии: формирование сообществ как основы функциональных добавок с пробиотическими свойствами для птицеводства / Р. С. Мухаммадиев, Р. С. Мухаммадиев, Л. Р. Валиуллин [и др.] // Ветеринария Кубани. 2023. № 2. С. 30-36. 11. Новые штаммы Bacillus subtilis как перспективные пробиотики / Г. Ф. Хадиева, М. Т. Лутфуллин, Н. К. Мочалова [и др.] // Микробиология. 2018. Т. 87. № 4. С. 356-365. 12. Новые штаммы Lactobacillus acidophilus как перспективные пробиотики для птицеводства / Л. Р. Валиуллин, Р. С. Мухаммадиев, Р. С. Мухам-мадиев [и др.] // Ветеринария Кубани. 2022. № 6. С. 16-21. 13. Новые штаммы микроорганизмов как перспективные добавки с функциональными свойствами для птицеводства / Р. С. Мухаммадиев, Р. С. Мухаммадиев, А. И. Яруллин [и др.] // Актуальные проблемы аграрной науки: прикладные и исследовательские аспекты: материалы III Всероссийской (национальной) научно-практической конференции. Нальчик: ФГБОУ ВО «Кабардино-Балкарский государственный аграрный университет имени В.М. Кокова», 2023. С. 98-101. 14. Оптимизация параметров совместного культивирования Bacillus subtilis GA27 и Bacillus subtilis RF-45 для возможности создания пробиотиков, метапробиотиков и метабиотиков для птицеводства/ Р. С. Мухамма-диев, Р. С. Мухаммадиев, Л. Р. Валиуллин [и др.] // Ветеринария Кубани. 2023. № 3. С. 32-38. 15. Параметры острой токсичности и кожно-раздражающего потенциала кормовой композиции с метапробиотическими свойствами/ Г. Л. Латыпов, А. С. Мухаммадиева, Л. Р. Валиуллин [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2023. Т. 253. № 1. С. 174-179. 16. Пробиотики на основе бактерий рода Bacillus в птицеводстве / Н. В. Феоктистова, А. М. Марданова, Г. Ф. Хадиева [и др.] // Ученые записки Казанского университета. Серия Естественные науки. 2017. Т. 159. № 1. С. 85-107. 17. Севастьянова, Т. В. Функциональные кормовые добавки для сельскохозяйственных животных и их влияние на показатели продуктивности / Т. В. Севастьянова, Б. В. Уша // Аграрная наука. 2021. № S4. С. 99-103. 18. Сравнительная характеристика кишечного микробиома местного крупного рогатого скота и скота абердин-ангусской породы, импортированного в Казахстан/ А. Т. Даугалиева, С. Т. Даугалиева, М. А. Кинеев [и др.] // Ветеринария сегодня. 2022. Т. 11. № 1. С. 53-60. 19. Сравнительная экспериментальная оценка эффективности современных пробиотиков, пребиотиков, синбиотиков и метабиотиков при коррекции нарушений микробиоценоза кишечника у животных с антибиотико-ассоциированным дисбиозом / И. Ю. Чичерин, И. П. Погорельский, И. Г. Лундовских [и др.] // Экспериментальная и клиническая гастроэнтерология. 2016. № 7. С. 106-120. 20. Ферментативная активность гидролаз штаммов микроорганизмов, перспективных для создания на их основе кормовых добавок и биологических консервантов / Р. С. Мухаммадиев, Р. С. Мухаммадиев, И. Г. Каримуллина [и др.] // Состояние, проблемы и перспективы развития современной науки: материалы национальной научно-практической конференции. Брянск: Брянский государственный аграрный университет (Кокино), 2021. С. 127-133. 21. Antagonistic properties and biocompatibility as important principles for development of effective and biosafety probiotic drugs/ Rish.S. Mukhammadiev, A.S. Mukhammadieva, E.V. Skvortsov et al. // IOP Conf. Ser. Earth Environ. Sci. 2021. 663. 012008. 22. Antioxidant effects of live and heat-killed probiotic Lactobacillus plantarum Ln1 isolated from kimchi/ H.J. Jang, M.W. Song, N.K. Lee et al. // J. Food Sci. Technol. 2018. 55(8). 3174-3180. 23. Bacillus subtilis M6 improves intestinal barrier, antioxidant capacity and gut microbial composition in AA broiler/ L. Ji, L. Zhang, H. Liu, J. Shen, Y. Zhang, L. Lu, X. Zhang, X. Ma// Front. Nutr. 2022. 9. 965310. DOI: 10.3389/ fnut.2022.965310. 24. Carriage of extended-spectrum в-lactamases in pig farmers is associated with occurrence in pigs/ W. Dohmen, M.J. Bonten, M.E. Bos, S. van Marm, J. Scharringa, J.A. Wagenaar, D.J. Heederik// Clin. Microbiol. Infect. 2015. 21(10). 917-923. DOI: 10.1016/j.cmi.2015.05.032. 25. Effective bifidogenic growth factors cyclo-Val-Leu and cyclo-Val-Ile produced by Bacillus subtilis C-3102 in the human colonic microbiota model/ M. Hatanaka, H. Morita, Y. Aoyagi, K. Sasaki, D. Sasaki, A. Kondo, T. Nakamura// Sci. Rep. 2020. 10(1). 7591-7600. DOI:10.1038/s41598-020-64374-w. 26. Evaluation of probiotic and prebiotic-like effects of Bacillus subtilis BN on growth of lactobacilli/ M. Horie, T. Koike, S. Sugino, A. Umeno, Y. Yoshida// J. Gen. Appl. Microbiol. 2018. 64(1). 26-33. DOI: 10.2323/jgam.2017.03.002. 27. Exploring the potential of Bacillus subtilis as an additive for decontamination of feed/ L. Valiullin, R. Mukhammadiev, M. Sevostyanov, D. Demin, I. Karimullina, A. Mukhammadieva, V. Gumerov, D. Sorokina, A. Yarullin, R. Mukhammadiev// E3S Web of conferences. 2023. 462. 01021. DOI: 10.1051/e3sconf/202346201021. 28. Formation of the bacterial community as the basis of probiotic supplement for livestock/ L.R. Valiullin, R.S. Mukhammadiev, V.G. Gumerov, B.A. Sadykov, R.S. Mukhammadiev, D.A. Sorokina, E.Yu. Tarasova, A.S. Mukhammadieva// BIO Web of conferences. 2024. 105. 04001. DOI:10.1051/bioconf/202410504001. 29. Improved growth and viability of lactobacilli in the presence of Bacillus subtilis (natto), catalase, or subtilisin/ T. Hosoi, A. Ametani, K. Kiuchi, S. Kaminogawa// Can. J. Microbiol. 2000. 46(10). 892-897. DOI: 10.1139/w00-070. 30. Kimelman H., Shemesh M. Probiotic bifunctionality of Bacillus subtilis-rescuing lactic acid bacteria from desiccation and antagonizing pathogenic Staphylococcus aureus// Microorganisms. 2019. 7(10). 407-423. DOI: 10.3390/microorganisms7100407. 31. Mazkour S., Shekarforoush S., Basiri S. The effects of supplementation of Bacillus subtilis and Bacillus coagulans spores on the intestinal microflora and growth performance in rat// Iran. J. Microbiol. 2019. 11(3). 260-266. 32. Occurrence of Salmonella enterica and Escherichia coli in raw chicken and beef meat in northern Egypt and dissemination of their antibiotic resistance markers/ A.A. Moawad, H. Hotzel, O. Awad, H. Tomaso, H. Neubauer, H.M. Hafez, H. El-Adawy// Gut Pathog. 2017. 9. 57-70. DOI: 10.1186/s13099-017-0206-9. 33. Overview of the antimicrobial compounds produced by members of the Bacillus subtilis group/ Caulier S, Nannan C, Gillis A, Licciardi F, Bragard C, Mahillon// J. Front. Microbiol. 2019. 10. 302-321. DOI: 10.3389/ fmicb.2019.00302. 34. Preclinical safety assessment of Bacillus subtilis BS50 for probiotic and food applications/ L.M. Brutscher, C. Borgmeier, S.M. Garvey, J.L. Spears// Microorganisms. 2022. 10(5). 1038-1059. DOI: 10.3390/ microorganisms10051038. 35. Probiotic characterization of Bacillus subtilis P223 isolated from kimchi/ H.L. Jeon, N.K. Lee, S.J. Yang, W.S. Kim, H.D. Paik// Food Sci. Biotechnol. 2017. 26(6). 1641-1648. DOI: 10.1007/s10068-017-0148-5. 36. Supplementation of Bacillus subtilis GM5 enhances broiler body weight gain and modulates cecal microbiota/ G. Hadieva, M. Lutfullin, D. Pudova, Y. Akosah, E. Shagimardanova, N. Gogoleva, M. Sharipova, A. Mardanova// 3 Biotech. 2021 11(3). 126-139. DOI: 10.1007/s13205-020-02634-2. 37. Survival of probiotic strains of microorganisms under imitating digestion in the stomach and intestines of farm animals/ Rish.S. Mukhammadiev, Rin.S. Mukhammadiev, E.V. Skvortsov, L.R. Valiullin, A.P. Glinushkin, V.P. Kalinitchenko// IOP Conf. Ser. Earth Environ. Sci. 2021. 663. 012038. DOI:10.1088/1755-1315/663/1/012038. 38. Tenea G.N., Gonzalez G.L., Moreno J.L. Probiotic characteristics and antimicrobial potential of a native Bacillus subtilis strain Fa17.2 rescued from wild Bromelia sp. flowers// Microorganisms. 2022. 10. 860-876. DOI: 10.3390/microorganisms10050860. 39. Viswanathan V.K. Off-label abuse of antibiotics by bacteria// Gut Microbes. 2014. 5(1). 3-4. DOI: 10.4161/gmic.28027. Резюме. В настоящей работе проведена сравнительная оценка свойств спорообразующих штаммов B. subtilis МР2 и RF-45, их потенциала как кандидатов в пробиотики для животноводства. Исследуемые бациллы обладали антимикробным потенциалом против бактерий S. aureus, E. coli и S. enterica - возбудителей различных инфекций сельскохозяйственных животных, а также токсинпродуцирующих микромицетов F. graminearum, F. moniliforme и F. sporotrichioides. По сравнению с бациллярным штаммом МР2, B. subtilis RF-45 на 8,18-18,07 и 16,74-28,10 % эффективнее ингибировал рост тест-бактерий и микромицетов соответственно. Установлено, что после последовательного выдерживания спор обоих бацилл в среде с пепсином (рН 2.5) в течение 3 ч и бычьей желчью (рН 7,5) в течение 8 ч их жизнеспособность находилась на уровне контроля. Наиболее высокий показатель адгезии выявлен у штамма МР2: после инкубации в течение 2 ч при 37,0°С количество адгезированных на клетках НТ-29 жизнеспособных его спор было выше в 1,87 раза относительно значений данного показателя спор штамма RF-45. Вегетативные клетки обоих бацилл не проявляли гемолитическую активность, а также не несли гены, ответственные за синтез энтеротоксинов и цитотоксина K, указывая о их потенциальной безопасности. Раздельное или совместное выпаивание спор исследуемых бацилл приводило к повышению численности кишечной палочки, бифидо-и лактобактерий в содержимом кишечника белых мышей с дисбиозом, индуцированным антибиотиком гентамицином. При этом в группе мышей, которые получали суспензию спор штамма RF-45, содержание кишечной палочки было больше в 1,02 раз, бифидобактерий - в 1,12 раза, лактобактерий - 1,04 раза относительно значений указанного показателя группы животных, получавших суспензию спор штамма МР2. Сделано заключение, что штаммы B. subtilis МР2 и RF-45 являются перспективными кандидатами в пробиотики для животноводства. Ключевые слова: Bacillus subtilis, антимикробный потенциал, устойчивость, желчь, пепсин, адгезия на клетках, безопасность, нарушения микроэкологии кишечника, эффективность, пробиотики, животноводство. Сведения об авторах: Мухаммадиев Ринат Салаватович, кандидат биологических наук, старший научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии», научный сотрудник лаборатории кормов и кормовых добавок ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, Научный городок-2; тел.: 8-987-4214127; е-mail: tanirtashir@mail.ru. Каримуллина Ильсияр Габделгазизовна, кандидат биологических наук, старший научный сотрудник лаборатории вирусологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, Научный городок-2; тел.: 8-904-7699225; е-mail: 89047699225@mail.ru. Шангараев Рафкат Искандарович, кандидат ветеринарных наук, научный сотрудник лаборатории молекулярно-генетического анализа ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, Научный городок-2; тел.: 8-917-22883344; е-mail: rafkat.shangaraev@mail.ru. Мухаммадиева Алина Сергеевна, кандидат ветеринарных наук, младший научный сотрудник лаборатории культур клеток и питательных сред ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, Научный городок-2; тел.: 8-917-2396095; е-mail: alinasakura_mail.ru@mail.ru. Акбашев Ильгизар Расилович, кандидат ветеринарных наук, научный сотрудник лаборатории вирусологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, Научный городок-2; тел.: 8-950-9474056; е-mail: ilgizar.92@mail.ru. Сорокина Диана Анатольевна, младший научный сотрудник лаборатории вирусологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, Научный городок-2; тел.: 8-927-8875729; е-mail: diana-sorokina2013@mail.ru. Хусаинова Гульнара Ильдусовна, кандидат биологических наук, старший научный сотрудник лаборатории вирусологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, Научный городок-2; тел.: 8-917-2627283; е-mail: GulnaraI13@yandex.ru. Ответственный за переписку с редакцией: Мухаммадиев Ришат Салаватович, кандидат биологических наук, научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии», научный сотрудник лаборатории кормов и кормовых добавок ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, Научный городок-2; тел.: 8-939-3728789; e-mail: tashir9891@mail.ru
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|