|
||||

Влияние антимикробных добавок различного происхождения на микробиом цыплят-бройлеровУДК 619:579.62:636.5/6:577.18 Логинов Е. А., Кривоногова А. С., Исаева А. Г., Лысова Я. Ю., Лысов А. В., Безбородова Н. А. Федеральное государственное бюджетное Запрет на использование кормовых антибиотиков (antibiotic growth promoters, AGPs) в животноводстве и птицеводстве способствует росту популярности природных антимикробных средств и стимуляторов роста [7]. Растет популярность кормовых добавок, таких как пробиотики, пребиотики, симбиотики, органические кислоты, эфирные масла, ферменты, иммуностимуляторы и фитобиотические добавки (травы, эфирные масла, живицы, экстрагированные метаболиты различных видов растений), которые, по данным различных исследователей, положительно влияют на конверсию корма, биодоступность и усвояемость нутриентов, повышают общую резистентность организма, нормализуют работу иммунной системы, улучшают состояние кишечного микробиома, снижают количество патогенов, оказывают антиоксидантное, противовоспалительное и антистрессовое действие [1, 5, 7, 8, 13]. В качестве пробиотиков наиболее часто используют бактерии родов Bacillus, Bifidobacterium, Enterococcus, Lactobacillus, Pediococcus и Streptococcus, а также дрожжей Saccharomyces [8]. Основны ми механизмами действия пробиотиков считаются конкурентное исключение, бактериальный антагонизм и стимуляция иммунной системы, которые реализуются за счет продукции метаболитов с антимикробной активностью - органических кислот, бактерио-цинов, антибиотиков, перекиси водорода [2, 3, 5, 9]. Многочисленные работы в области фитофармакологии посвящены поиску биологически активных метаболитов растений и изучению их действия на физиологические процессы животных и человека. В промышленном животноводстве фитобиотики используются для воспроизведения эффектов, запрещенных AGP, включая увеличение мышечной массы, иммуномодуляцию, профилактику инфекционных заболеваний и улучшение качества продуктов животного происхождения [4, 6]. Однако из-за сложного состава растительных средств, разнообразия и широкого спектра биологических эффектов бывает невозможно обеспечить высокую селективность их действия и подобрать дозировку, адекватную конкретной задаче. Один из перспективных путей использования пробиотиков и растительных добавок - их сочетанное применение с антибиотиками: в качестве дополнения к антимикробным терапевтическим схемам, что позволяет уменьшить негативные побочные эффекты, например, нефро- и гепатотоксичность, снизить количество резистентных патогенов в микробиомах животных, повысить общую устойчивость организма и нормализовать работу иммунной системы [11, 13]. Целью исследования являлся анализ изменения микробиоты цыплят-бройлеров на фоне введения в рацион фитобиотика и пробиотика в сравнении со схемой, включающей кормовую добавку вирджиниамицин. Материалы и методы исследований. Эксперимент проводили на цыплятах-бройлерах кросса Росс 308: 40 клинически здоровых цыплят суточного возраста были разделены на 4 группы (№№ 1, 2, 3 - опытные, № 4 - контрольная) и посажены в однотипные изолированные друг от друга боксы с контролируемым микроклиматом, где содержали в одинаковых технологических условиях до убоя в возрасте 37 суток. Перед посадкой цыплят боксы были продезинфицированы, в контрольных смывах рост микрофлоры отсутствовал. В течение эксперимента температура, влажность, скорость воздухообмена и освещенность поддерживались на уровнях, рекомендованных для кросса Росс 308. Рацион - корма промышленного производства ПК-5, ПК-6М в соответствии с возрастом; воду питьевую подавали через поилки колокольного типа. За сутки до убоя кормление было прекращено. В период с 8 по 21 сутки цыплятам группы № 1 вводили в рацион кормовую добавку, содержащую вирджиниамицин, из расчета 0,5 мг/кг массы тела птицы однократно в сутки в течение 14 дней. В группе № 2 цыплята получали пробиотическую добавку, содержащую метаболитный комплекс B. subtilis в рекомендованном производителем количестве, эквивалентном 1 кг/т корма. В группе № 3 цыплятам выпаивали фитобиотическую комплексную добавку на основе водорастворимых и жирорастворимых биологически активных растительных метаболитов Taraxacum officinale, Avena sativa, Trifolium pratense, Solanum tuberosum, полученных паровой дистилляцией и химической экстракцией растительного сырья. Суточная доза фитобиотика составляла - 0,5 мл/голову, применяли в течение 14 дней, с 8 по 21 сутки включительно. Цыплята контрольной группы № 4 никаких добавок не получали. Отбор проб для микробиологического анализа проводили на 1-е сутки перед посадкой цыплят в боксы, для определения фонового состояния микробиоты; на 21-е сутки - после окончания применения добавок; на 36 сутки - после прекращения кормления и на 37 сутки, перед убоем. В каждой группе брали кал от цыплят в стерильные контейнеры, смывы - в Swab-системы с транспортной средой Эймса (ООО «Полигем», г. Дубна). Бактериологические исследования проводили с использованием разведений 10-1-10-10 и посевов на стандартные жидкие и плотные питательные среды производства ГКПМ-Оболенск: МПА, агары Плоскирева, Левина, Вильсон-Блера, Мюллера, Сабуро, энтерококк-агар, среда Эндо, лактобакагар, бифидум-среда, це-тримидный агар, среда № 10, магниевая среда, Китта-Тароцци, среда для выделения стрептококков и др. Посев проводили на чашки с агаризованными питательными средами по 0,1 мл, в пробирки - по 1,0 мл. Для идентификации выросших колоний микроорганизмов анализировали их культуральные, морфологические свойства в соответствии со стандартными бактериологическими методиками, проводили биохимические тесты (посев на среды Гисса с сахарами; применение различных тест-систем (ООО «НПО Диагностические системы», г. Нижний Новгород). Определение фенотипической чувствительности к вирджиниа-мицину выполняли методом диффузии в агаре на среде Мюллер-Хинтон II, измерение зон подавления роста проводили с помощью штангенциркуля, оценку проводили, используя EUCAST: Clinical breakpoints (v14.0). Отбор проб на молекулярно-генетическое исследование проводили в 1-е и 37-е сутки, анализировали наличие генов резистентности к антибиотикам (antibiotic resistance genes, ARGs) в образцах подстилки, помёта цыплят в группах №№ 1-4. ДНК выделяли с помощью наборов «Diatom DNA Prep 200» (ООО «ИзоГен», Москва). ПЦР-диагностику проводили с применением тест-систем «Резистом. ESBL - E. coli. Набор реагентов для выявления ДНК Escherichia coli, blaCTX-M, bla OXA-10 генов резистентности ГОБ к цефалоспоринам», «Резистом. MRSA. Набор реагентов для выявления и дифференциации ДНК Staphylococcus aureus, Staphylococcus species и MecA гена резистентности Staphylococcus species к бета-лактамам», «Резистом. CRE -Klebsiella. Набор реагентов для выявления ДНК Klebsiella pneumonia, blaKPC u blaOXA - 48 генов резистентности ГОБ к кар-бапенемам», «Резистом.УРЕ type V. Набор реагентов для выявления ДНК E. faecalis, E. faecium и типирования VanA/VanB генов резистентности Enterococcus к гликопептидам», «Резистом. CRE-Enterobacter. Набор реагентов для выявления ДНК Enterobacter species, blaGES генов резистентности ГОБ к карбапенемам и blaDHA генов резистентности ГОБ к защищенным пенициллинам и цефалоспоринам», «Ветскрин. Протепол. Набор реагентов для выявления ДНК Proteus species (Proteus cibarius, Proteus mirabilis, Proteus penneri, Proteus vulgaris)», «Ветскрин. Стреп-топол - В. Набор реагентов для выявления ДНК Streptococcus agalactiae», «РЕЗИСТОМ. ErmB. Набор реагентов для выявления ErmB генов резистентности Streptococcus spp. и Staphylococcus spp. к макролидам, линкозамидам, стрептограминам» (ООО «Ли-тех», Россия). Амплификацию в режиме реального времени осуществляли на приборе QuantStudio 5 (США). Для статистической обработки данных использовали стандартный пакет анализа Microsoft Exсel 2010. Анализ отдельных массивов данных выполняли в программе Statistica 10. Исследование проводили в рамках выполнения Государственного задания № 0532-2021-0004 «Разработка методологических подходов к мониторингу, контролю и сдерживанию антибиотикорезистент-ности оппортунистических микроорганизмов в животноводстве» Результаты исследований и их обсуждение. Цыплята опытной группы № 1 получали кормовую добавку, имеющую в составе вирджиниамицин - антибиотик класса стрептограминов, применяющийся в животноводстве и птицеводстве для ускорения роста животных, профилактики и лечения инфекций. В группе № 2 птице давали пробиотик на основе метаболитов Bacillus subtilis, в группе № 3 - фитобиотик. По результатам микробиологического анализа биоматериала установили, что количество КОЕ Bifidobacterium spp. в пробах из всех групп снизилось на порядок, количество Lactobacillus spp. в опытных группах №№ 1-3 оставалось на уровне 107 в течение всего периода выращивания бройлеров, в контрольной группе № 4 уменьшилось с 108 (фон) до 107 (на 37 сутки). Возможно, это было связано с возрастными колебаниями в составе микрофлоры, с изменением рациона или другими факторами, но в целом изменение количества E. coli, Lactobacillus spp., Bifidobacterium spp. не имело значимых различий ни между опытными группами, ни в сравнении с контролем (табл. 1). Таблица 1 Количество микроорганизмов в пробах от цыплят-бройлеров до начала опыта и перед убоем в баллах (балл равен степени 10 количества колониеобразующих клеток в 1 г образца)
Примечание: * - E. coli непатогенная, представитель нормофлоры; ** - E. coli со слабой ферментативной активностью (условно-патогенная) Среди условно-патогенных бактерий выраженную динамику отметили в количестве стафилококков - их количество выросло с 102 до 105 во всех группах, и клостридий, которых в первые сутки не выявляли, а на 37 сутки обнаружили во всех группах на уровне 102. В пробах цыплят из группы № 2, получавшей пробиотическую добавку, обнаружили снижение КОЕ Enterococcus spp. с 107 до 105, при этом в группах № 3 и № 4, наоборот, произошло увеличение на два порядка. Обращает на себя внимание рост количества клостридий к концу опыта во всех группах, что, наиболее вероятно, связано с их поступлением через корм. В целом, сравнение результатов микробиологического анализа проб, взятых на 1 и 37 сутки показало, что пробиотик (группа № 2) проявил схожий эффект с вирджиниамицином (группа № 1) вызвав снижение количества нормофлоры в среднем на 82%, и условно-патогенной микрофлоры - на 88-89% (табл. 2). Антимикробного действия у фитобиотика (группа № 3) не обнаружили, изменение количества микробных клеток в этой группе было на уровне значений контрольной группы № 4: рост количества условно-патогенных бактерий и дрожжей в 56 раз (группа № 3) и в 51 раз (группа № 4). Таблица 2 Количество представителей нормальной и условно-патогенной микрофлоры в пробах от цыплят-бройлеров на 1 и 37 сутки, (КОЕ/г)
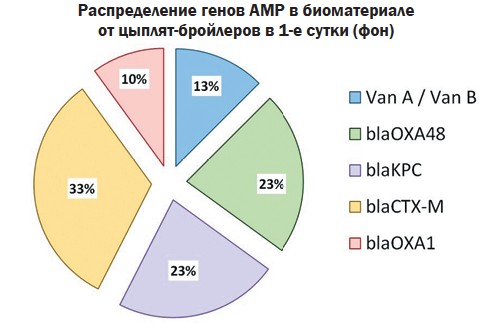
Перед началом эксперимента были взяты пробы на молекулярно-генетический анализ. Обнаружили, что все цыплята в суточном возрасте уже были контаминированы штаммами бактерий, имеющих гены резистентности к антибиотикам, что, по всей видимости, произошло во время вывода или в первые часы после него. При анализе выявили частотное преобладание генетических детерминант бета-лактамаз, ассоциированных с устойчивостью грам-отрицательных бактерий к цефалоспоринам, карбапенемам, монобактамам, пенициллинам, в том числе защищенным - суммарно blaOXA1, blaOXA48, blaKPC, blaCTX-M составили 87% от всех обнаруженных ARG. (рисунок 1).
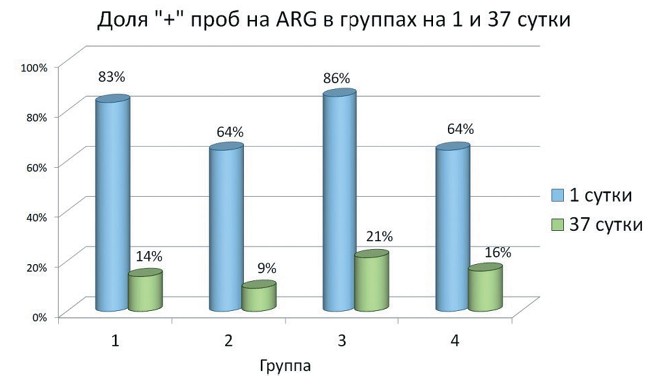
Рис. 1. Гены резистентности, обнаруженные в пробах от цыплят на 1 сутки Гены, связанные с устойчивостью грам-положительных бактерий к ванкомицину/тейкопланину присутствовали в меньшем количестве проб: vanA/vanB суммарно 13%. В настоящее время распространение АМР достигло такого высокого уровня, что штаммы, имеющие плазмидные факторы резистентности, обнаруживают при исследовании практически любого микробиома, связанного с человеком или сельскохозяйственными животными. Так, по данным Wozniak и соавт. (2021), гены blaKPC, кодирующие устойчивость к карбапенемам, обнаруживали в большинстве изолятов P. aeruginosa, E. coli, E. cloacae, K. pneumoniae, C. freundii в госпитальных микробиомах [10]. Еще в 20032007 гг. Н.К. Фурсовой и соавторами были получены данные о присутствии blaCTX-M в геномах 71% резистентных нозокомиальных Enterobacteriaceae, в том числе в 91% культур E. coli, 90% - Klebsiella spp., 38% - Enterobacter spp. [14]. На животноводческих объектах ситуация схожая, в 2016-2021 гг. изоляты, обнаруженные на молочных фермах, были контаминированы генами бета-лактамаз на 45-54% [12]. Распространение мобильных детерминант АМР на предприятиях животноводства и птицеводства обусловливает не только циркуляцию резистентных штаммов в микробиомах, но также и передачу агентов резистентности по технологическим цепочкам, включая контаминацию молодняка, и попадание в продукцию, окружающую среду и организм работников предприятий. При анализе микрофлоры из биоматериала, взятого на 37 сутки, обнаружили, что во всех группах снизилось количество положительных по ARG проб по сравнению с результатом анализа на 1 сутки (рисунок 2). При этом максимальная разница (69,4%) была отмечена в группе № 1, получавшей вирджиниамицин, и в группе № 3, получавшей фитобиотическую добавку (64,3%). В группе № 2 - 55,1%, а в контроле - 48,2%. Такая динамика, выявленная как в опытных, так и в контрольной группах, предположительно, связана с качественными и количественными изменениями кишечного микробиома цыплят в процессе выращивания. Однако нужно отметить, что на фоне приёма антибиотика эффект был наиболее выражен.
Рис. 2. Доля положительных по ARG проб при молекулярно-генетическом исследовании бактерий из биоматериала от цыплят-бройлеров Заключение. В проведенном нами эксперименте было обнаружено снижение количества условно-патогенных бактерий в биоматериале от цыплят-бройлеров, получавших добавку, содержащую антибиотик вирджиниамицин, и у цыплят, получавших пробиотик на основе метаболитов Bacillus subtilis. В группе, получавшей фитобиотик, результаты были сопоставимы с контролем, что свидетельствовало о неэффективности данной растительной композиции в конкретных условиях. Успешный опыт применения растительных препаратов и добавок в качестве альтернативы антибиотикам, полученный многими отечественными и зарубежными исследователями в рамках экспериментов и малых производственных опытов, может оказаться неэффективным в других условиях, на других животноводческих предприятиях, не универсален и не масштабируется на всю отрасль. При этом использование растительных добавок в качестве дополнения к антибио-тикотерапии позволяет нивелировать её негативные побочные эффекты, снизить токсическое действие на печень, почки и др. органы, что, несомненно, говорит в пользу фитобиотиков. Широко распространенные в птицеводстве пробиотики в нормальных условиях оказывают стабилизирующее действие на микробиом птицы и сдерживают рост условно-патогенной микрофлоры с эффективностью, сопоставимой с антибиотиками. Однако при развитии серьезного дисбиоза, при активном размножении патогенов в организме, иммунодефицитах и других отклонениях от физиологической нормы более эффективным является их включение в терапевтическую схему с антимикробными препаратами. Таким образом, наиболее перспективным видится профилактическое использование пробиотиков, либо как дополнение к антибиотикотерапии. В целом, применение фитобиотиков и пробиотиков при выращивании птицы не оказывает негативного действия, имеет ряд положительных эффектов, однако широкое их использование в качестве альтернативы антибиотикам требует дальнейшего изучения. Список литературы: 1. Abd El-Hack, Alternatives to antibiotics for organic poultry production: types, modes of action and impacts on bird’s health and production / Abd El-Hack, Mohamed & El-Saadony, Mohamed & Salem, Heba & Eltahan, Amira & Soliman, Mohamed & Youssef, Gehan & Taha, Ayman & Soliman, Soliman & Ezzat Ahmed, Ahmed & El-kott, Attalla & Alsyaad, Khalid & Swelum, Ayman // Poultry Science. - 2022. - 101. - 101696. 10.1016/j.psj.2022.101696 2. Cholewinska, P.The microbiome of the digestive system of ruminants - A review / Cholewinska P., Czyz K., Nowakowski P., Wyrostek A. // Anim. Health Res. Rev. -2020. - 21.-- Pp. 3-14. 3. Douillard, F.P. Comparative genomic analysis of the multispecies probiotic-marketed product VSL#3. Douillard, F.P.; Mora, D.; Eijlander, R.T.; Wels, M.; de Vos, W.M. PLoS ONE - 2018. - 1. - 3 e0192452. 4. Krysiak, K,. Overview of the Use of Probiotics in Poultry Production / Krysiak K, Konkol D, Korczynski M. // Animals (Basel). - 2021. - 31;11(6):1620. doi: 10.3390/ ani11061620. 5. Lambo, M.T., The Recent Trend in the Use of Multistrain Probiotics in Livestock Production: An Overview / Lambo M.T., Chang X, Liu D. // Animals (Basel). 2021. -26;11(10). - 2805. doi: 10.3390/ani11102805. 6. Ogbuewu, I., Meta-analysis of the influence of phytobiotic (pepper) supplementation in broiler chicken performance / Ogbuewu, I.; Okoro, V.; Mbajiorgu, C. // Trop. Anim. Health Prod. - 2020. - 52. - Pp. 17-30 7. Rizzo A., Antimicrobial Resistance and Current Alternatives in Veterinary Practice: A Review / Rizzo A., Piccinno M., Lillo E., Carbonari A., Jirillo F., Sciorsci R.L. // Curr Pharm Des. - 2023. -No.29(5), P.312-322. doi: 10.2174/13816128296662 30130144731. 8. Smialek, M. The Use of Probiotics in the Reduction of Campylobacter spp. Prevalence in Poultry / Smialek M., Kowalczyk J., Koncicki A. // Animals (Basel). - 2021 -10;11(5). -:1355. doi: 10.3390/ani11051355. PMID: 34068764 9. Soltani, S. Bacteriocins as a new generation of antimicrobials: Toxicity aspects and regulations / Soltani, S.; Hammami, R.; Cotter, P.D.; Rebuffat, S.; Said, L.B.; Gaudreau, H.; Bedard, F.; Biron, E.; Drider, D. Fliss, I. // FEMS Microbiol. Rev. -2021. -45. - fuaa039 10. Wozniak, A. A multispecies outbreak of carbapenem-resistant bacteria harboring the blaKPC gene in a non-classical transposon element/ Wozniak A, Figueroa C, Moya-Flores F, Guggiana P, Castillo C, Rivas L, Munita JM, Garda PC. - BMC Microbiol. -2021. - 9;21(1):107. doi: 10.1186/s12866-021-02169-3. 11. Беспамятных, Е. Н. Метаболические изменения в организме кур-несушек при применении антибиотика и фитобиотика / Е. Н. Беспамятных, А. С. Кривоного-ва, А.Г. Исаева, И.М. Донник, А.Е. Ченцова // Аграрный вестник Урала. - 2023. -№ 7(236). - С. 71-82. - DOI 10.32417/1997-4868-2023-236-07-71-82. 12. Исакова, М. Н. Антибиотикорезистентность клинических изолятов Escherichia coli, выделенных от животных / М. Н. Исакова, О. В. Соколова, Н. А. Безбородова [и др.] // Ветеринария сегодня. - 2022. - Т. 11, № 1. - С. 14-19. -DOI 10.29326/2304-196X-2022-11-1-14-19. 13. Тюрина, Д. Г. Применение антибиотиков в мясном птицеводстве и вопросы антибиотикорезистентности микроорганизмов / Д.Г. Тюрина, Е. Горфункель, Т. Грудинина, Е.А. Йылдырым, А.В. Дубровин, Л.А. Ильина, К. Калиткина, Е.С. Пономарева // Гастроэнтерология Санкт-Петербурга. - 2023. - № 3-4. - С. 12. 14. Фурсова, Н.К. Генетическое окружение генов blaCTX_M, локализованных на конъюгативных плазмидах нозокомиальных изолятов Enterobacteriaceae, выделенных в России в 2003-2007 гг./ Фурсова Н.К., Прямчук С.Д., Абаев И.В., Ковалев Ю.Н., Шишкова Н.А., Печерских Э.И., Коробова О.В., Асташкин Е.И., Пачкунов Д.М., Светоч Э.А., Сидоренко С.В. // Антибиотики и Химиотерапия. - 2010 - 55(11-12). - с.3-10. Резюме. Отказ от кормовых антибиотиков в птицеводстве поспособствовал поиску альтернативных способов предупреждения инфекций, сохранения здоровья и повышения продуктивности. Появляются новые сообщения об успешном применении фитобиотиков и пробиотиков для подавления роста патогенных микроорганизмов у продуктивной птицы. При этом на эффективность таких добавок сильно влияют внешние факторы - от технологии содержания до индивидуальных особенностей физиологии пищеварительной системы. Изучали изменение микробиома цыплят-бройлеров на фоне приёма антибиотика вирджиниамицина, пробиотика на основе B. subtilis и фитобиотика, содержащего метаболиты T. officinale, A. sativa, T.pratense, S. tuberosum. В биоматериале от цыплят анализировали количество E.coli, Lactobacillus spp., Bifidobacterium spp., Staphylococcus spp., Enterococcus spp., Proteus spp., Clostridium spp., а также дрожжей и плесневых грибов, изучали контаминацию бактерий генами blaOXA1, blaOXA48, blaKPC, blaCTX-M, vanA-vanB. Использованные добавки не повлияли на количество лактобактерий и бифидобактерий. Значимое снижение количества условно-патогенных микроорганизмов было выявлено в группах, получавших антибиотик и пробиотик. Также выявили, что микрофлора цыплят в суточном возрасте была контаминирована генами резистентности, причем преобладали гены группы bla, суммарно составлявшие 87% от всех обнаруженных ARGs. На 37 сутки отметили снижение частоты положительных по ARG проб, наиболее выраженное в группе, получавшей антибиотик. Фитобиотик в данных условиях показал низкую эффективность по сравнению с антибиотиком и пробиотиком. Критический уровень антимикробной резистентности (АМР) в птице водческих микробиомах ведет к попыткам заменить антибиотики препаратами и добавками растительного или микробного происхождения. Однако рецептуры этих средств, дозировки и условия применения требуют дальнейшего изучения и поиска способов повышения их эффективности. Ключевые слова: птицеводство, бройлеры, антибиотик, фитобиотик, пробиотик, условно-патогенная микрофлора, антимикробная резистентность, микробиом, гены резистентности, Escherichia coli. Сведения об авторах: Логинов Егор Александрович, старший специалист отдела ветеринарно-лабораторной диагностики с испытательной лабораторией лаборатории биологических технологий ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: loginov.ea19@gmail.com. Кривоногова Анна Сергеевна, доктор биологических наук, доцент, ведущий научный сотрудник отдел ветеринарно-лабораторной диагностики с испытательной лабораторией лаборатории биологических технологий ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: tel-89826512934@yandex.ru. Исаева Альбина Геннадьевна, доктор биологических наук, доцент, ведущий научный сотрудник отдела ветеринарно-лабораторной диагностики с испытательной лабораторией лаборатории биологических технологий ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: isaeva.05@bk.ru. Лысова Яна Юрьевна, старший научный сотрудник отдела ветеринарно-лабораторной диагностики с испытательной лабораторией лаборатории микробиологических и молекулярно-генетических методов исследования ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: mikroba.urnivi@mail.ru. Лысов Алексей Викторович, кандидат ветеринарных наук, ведущий научный сотрудник отдела ветеринарно-лабораторной диагностики с испытательной лабораторией ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: boris.wet@mail.ru. Ответственный за переписку с редакцией: Безбородова Наталья Александровна, кандидат ветеринарных наук, старший научный сотрудник отдела геномных исследований и селекции животных ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: n-bezborodova@mail.ru.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|