|
||||

Выявление ДНК mycoplasma hyopneumoniae в образцах бронхоальвеолярного лаважа и слюны свинейУДК 619:616.98:579.62:57.083.12 Раев С.А., Стаффорд В.В., Южаков А.Г., Комина А.К., Стрельцова Я.Б., Кучерук О.Д., Mycoplasma hyopneumoniae (M. hyo) - возбудитель энзоотической пневмонии свиней (далее, ЭПС), первичный патоген комплекса респираторных болезней свиней (далее, КРБС), который имеет повсеместное распространение, особенно в регионах с интенсивным свиноводством. Из клинических признаков, которые связывают непосредственно с данным возбудителем, выделяют кашель и катаральную бронхопневмонию. В конечном счете, это приводит к снижению таких производственных показателей как сохранность, среднесуточный прирост массы тела и коэффициент конверсии корма. Источником возбудителя являются больные и переболевшие животные (чаще свиньи на стадии откорма), подсосные поросята могут инфицироваться от матерей. Основной путь заражения - воздушно-капельный [1, 4, 10, 14, 16].
Первичный диагноз на ЭПС часто ставят при обнаружении характерных поражений краниовентральной доли легких при патологоанатомическом осмотре. «Золотым стандартом» лабораторной диагностики является выделение чистой культуры возбудителя на жидкой питательной среде Фрииса. В связи с трудоемкостью, а также длительностью данной методики в рутинных диагностических исследованиях используют главным образом иммуноферментный анализ (ИФА), направленный на выявление антител к возбудителю, а также полимеразную цепную реакцию [11, 13, 20].
Поскольку местом размножения M. hyo является реснитчатый эпителий бронхов, то обнаружение возбудителя возможно в таком материале как слюна, смывы (лаважи) и мазки из гортани, трахеи, бронхов и легких, также возможно использование кусочков легких. При этом определение оптимального вида биоматериала по-прежнему является предметом исследований. Так анализ данных, полученных с 2004 по 2016 гг. в США, показал, что наиболее часто ДНК возбудителя выявляется в легких в 33% случаев (инцидентность, с которой выявлен, по крайней мере, один положительный результат при исследовании легких), затем следуют бронхиальные, бронхоальвеолярные лаважи и трахеальные смывы (64, 49 и 34%, соответственно). В слюне ДНК возбудителя была обнаружена лишь в 8% из 25 случаев. Преимущества ларинготрахеальных смывов по сравнению со слюной были продемонстрированы при воспроизведении экспериментальной инфекции. В своих предыдущих исследованиях, посвященных мониторингу M. hyo, нами использовался бронхиоальвеолярный лаваж, однако в связи с нарастающей популярностью диагностических исследований слюны, как основного материала для обнаружения спектра возбудителей КРБС, возникла необходимость проведения соответствующих сравнительных исследований [3, 5, 6, 7, 8, 9, 12, 15, 17, 19].
В связи с относительно медленным распространением M. hyo среди животных в ограниченной популяции зачастую используется кросс-секционный подход для отбора материала, подразумевающий использование разновозрастных животных в единый момент времени. В условиях относительно короткого технологического цикла в промышленном свиноводстве данная методика также успешно себя зарекомендовала [2, 18].
Цель работы - провести диагностические исследования слюны и бронхиоальвеолярного лаважа, направленные на выявление ДНК M. hyo кросс-секционным методом.
Материалы и методы исследований. Исследования были проведены в 3 свинокомплексах промышленного типа, расположенных в Уральском и Сибирском федеральных округах. Все свинокомплексы на момент проведения исследований являлись неблагополучными в отношении КРБС, что проявлялось респираторным дистрессом, наиболее выраженном у поросят на откорме. Биологический материал отбирали от поросят различного возраста, а также свиноматок. В качестве материала для ПЦР исследований были использованы брон-хиоальвеолярный лаваж и слюна (n=10 для каждой возрастной группы). Сыворотка крови была использована для обнаружения антител к M. hyo (n=10 для каждой возрастной группы).
Для обнаружения ДНК M. hyo была использована ПЦР тест-система [3]. Для выявления антител к M. hyo в сыворотке крови свиней был использован соответствующий ИФА-набор «Микоплазма Серотест» (ООО «Ветбиохим», г. Москва). Постановку реакций, учет и интерпретацию полученных результатов проводили согласно рекомендациям производителей. Статистическую обработку результатов проводили общепринятыми методами с использованием компьютерной программы MS Excel 2010. Все исследования были проведены в лаборатории эпизоотологии, диагностики и профилактики вирусных болезней свиней ФГБНУ ФНЦ ВИЭВ РАН.
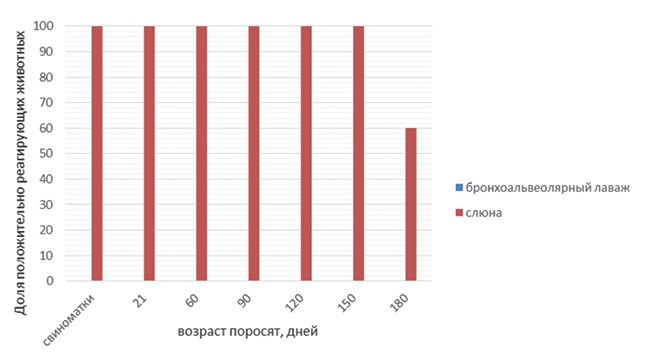
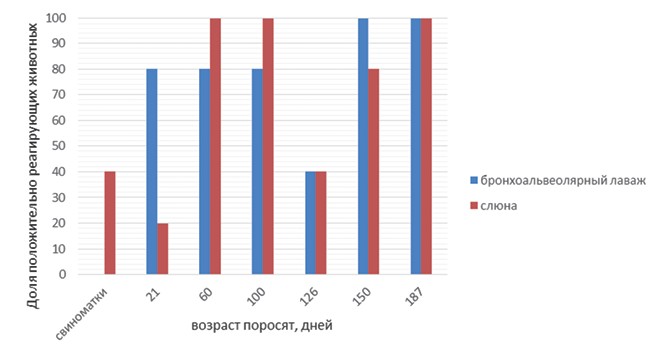
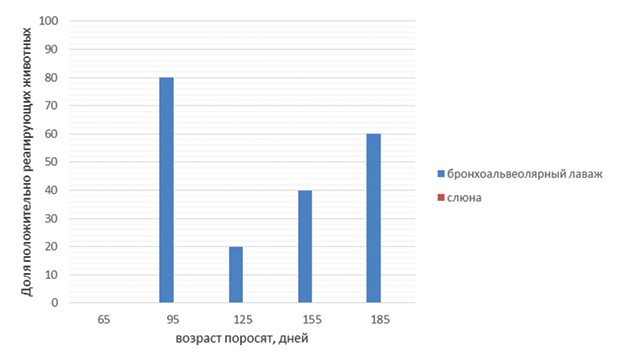
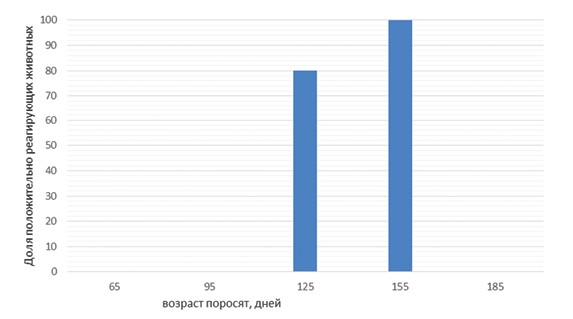
Результаты исследований и их обсуждение. Сравнение различных материалов для исследования привело к неожиданным результатам. В свинокомплексе № 1 (рисунок 1) ДНК возбудителя была выявлена у подавляющего числа исследованных животных. При этом ни в одном из образцов бронхиоальвеолярного лаважа положительных результатов зафиксировано не было. В свинокомплексе № 2 (рисунок 3) уровень выявляемости M. hyo в слюне и бронхиоальвеолярном лаваже был идентичен: доля положительных результатов при обобщении данных по всем группам животных составила 69%. Однако при анализе данных, полученных при изучении возрастных групп животных, было обнаружено, что в бронхиоальвеолярном лаваже свиноматок возбудитель отсутствовал, в то время как в слюне он был выявлен в 40% образцов. Наконец, в свинокомплексе № 3 (рисунок 5) были получены результаты, противоположные таковым из свинокомплекса № 1. Ни в одном из образцов слюны ДНК микоплазмы выявлена не была, в то время как доля положительных образцов бронхиоальвео-лярного лаважа составила 40%. Таким образом, различия в частоте обнаружения ДНК M. hyo в исследованных материалах находятся вне зависимости от общего уровня инфицированности животных в данных свинокомплексах (данные ПЦР исследований без учета вида биоматериала).
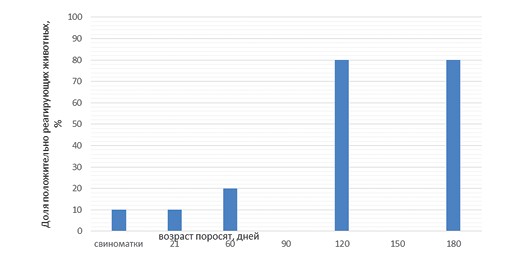
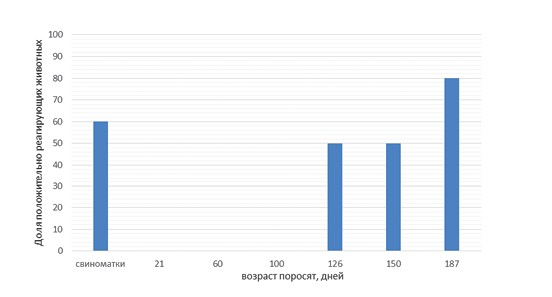
Анализ данных серологического статуса (рисунок 2, 4, 6) также не позволил обнаружить значительных различий между исследованными свинокомплексами. Во всех случаях максимальный уровень серопозитивных животных наблюдался в периоде откорма (40, 45 и 45% в свинокомплексах № 1, 2 и 3, соответственно). Таким образом, различия, обнаруженные в результатах сравнительного исследования по обнаружению ДНК M. hyo в слюне и бронхиоальвеолярном лаваже, не позволяют сделать заключение о том, что один из исследуемых материалов имеет явные преимущества, которые бы проявлялись во всех исследованных свинокомплексах. Можно предположить, что, кроме особенностей отбора проб в исследованных свинокомплексах, на характер выявления ДНК возбудителя оказали влияние индивидуальные особенности штаммов M. hyo (устойчивость к факторам внешней среды, скорость колонизации и последующего поражения реснитчатого эпителия, приводящего к снижению концентрации возбудителя).
Рис. 1. Результаты ПЦР исследований образцов бронхоальвеолярного лаважа и слюны (свинокомплекс № 1)
Рис. 2. Выявление антител к Mycoplasma hyopneumoniae (свинокомплекс № 1)
Рис. 3. Результаты ПЦР исследований образцов бронхоальвеолярного лаважа и слюны (свинокомплекс № 2)
Рис. 4. Выявление антител к Mycoplasma hyopneumoniae (свинокомплекс № 2)
Рис. 5. Результаты ПЦР исследований образцов бронхоальвеолярного лаважа и слюны (свинокомплекс № 3)
Рис. 6. Выявление антител к Mycoplasma hyopneumoniae (свинокомплекс № 3) Работа выполнена в соответствии с утвержденным планом НИР ФГБНУ ФНЦ ВИЭВ РАН на 2021 год.
Список литературы:
Резюме. Mycoplasma hyopneumoniae - возбудитель энзоотической пневмонии свиней, первичный патоген комплекса респираторных болезней свиней, который имеет повсеместное распространение, особенно в регионах с интенсивным свиноводством. Исследования были проведены в трёх свинокомплексах промышленного типа, расположенных в Уральском и Сибирском федеральных округах. Биологический материал отбирали от поросят различного возраста, а также свиноматок. В качестве материала для ПЦР исследований были использованы бронхиоальвеолярный лаваж и слюна (n=10 для каждой возрастной группы). Сыворотка крови была использована для обнаружения антител к M. hyo (n=10 для каждой возрастной группы). В результате исследований было показано, что в условиях различных свинокомплексов доля положительных образцов в изучаемых биоматериалах варьирует в широких пределах. В свинокомплексе № 1 положительные пробы были представлены исключительно образцами слюны. Напротив в свинокомплексе № 3 все 45% положительных проб от общего числа исследованных пришлись на долю образцов бронхиоальвеолярного лаважа. Лишь диагностические исследования проведенные в свинокомплексе № 2 позволили выявить сопоставимые (и в целом равные) доли положительных образцов для обоих видов биоматериала. Таким образом, различия, обнаруженные в результатах сравнительного исследования по обнаружению ДНК M. hyo в слюне и бронхиоальвеолярном лаваже не позволяют сделать заключение о том, что один из исследуемых материалов имеет явные преимущества, которые бы проявлялись во всех исследованных свинокомплексах. Выявление антител к возбудителю также не позволило выявить значимых отличий среди исследованных свинокомплексов. Следовательно, при проведении ПЦР исследований следует использовать оба материала.
Ключевые слова: свиньи, свинокомплекс, энзоотическая пневмония свиней, Mycoplasma hyopneumoniae, распространенность, мониторинг, бронхоальвеолярный лаваж, слюна, сыворотка крови, ПЦР.
Сведения об авторах:
Раев Сергей Алексеевич, кандидат биологических наук, ФГБНУ ФНЦ ВИЭВ РАН; 109428, г. Москва, Рязанский проспект, 24, к. 1.
Южаков Антон Геннадьевич, кандидат биологических наук, старший научный сотрудник ФГБНУ ФНЦ ВИЭВ РАН; 109428, г. Москва, Рязанский проспект, 24, к. 1.
Комина Алина Констатиновна, младший научный сотрудник ФГБНУ ФНЦ ВИЭВ РАН; 109428, г. Москва, Рязанский проспект, 24, к. 1.
Стрельцова Яна Борисовна, младший научный сотрудник ФГБНУ ФНЦ ВИЭВ РАН; 109428, г. Москва, Рязанский проспект, 24, к. 1.
Кучерук Оксана Дмитриевна, кандидат ветеринарных наук, ведущий научный сотрудник ФГБНУ ФНЦ ВИЭВ РАН; 109428, г. Москва, Рязанский проспект, 24, к. 1.
Аноятбеков Музафарбек, доктор ветеринарных наук, ФГБНУ ФНЦ ВИЭВ РАН; 109428, г. Москва, Рязанский проспект, 24, к. 1.
Алипер Тарас Иванович, доктор биологических наук, профессор, заведующий лабораторией эпизоотологии, диагностики и профилактики вирусных болезней свиней ФГБНУ ФНЦ ВИЭВ РАН; 109428, г. Москва, Рязанский проспект, 24, к. 1.
Ответственный за переписку с редакцией: Стаффорд Виктория Васильевна, кандидат биологических наук, ведущий научный сотрудник сектора патаморфологии ФГБНУ ФНЦ ВИЭВ РАН; 109428, г. Москва, Рязанский проспект, 24, к. 1; тел.: 8-926-4382045; e-mail: stafford.v.v@gmail.com.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|