|
||||

Получение рекомбинантного капсидного белка VP60 вируса геморрагической болезни кроликов и изучение его антигенной и иммуногенной активностиУДК 619:616.98:578.56 Мухин А.Н., Алексеев К.П., Москвина А.С., Верховский О.А. АНО «Научно-исследовательский Введение. Вирусная геморрагическая болезнь кроликов (далее, ВГБК; синонимы «некротический гепатит», «геморрагическая пневмония» кроликов) - остропротекающая высококонтагиозная болезнь, характеризующаяся явлениями геморрагического диатеза во всех органах, в особенности в легких и печени.
Возбудителем ВГБК является вирус геморрагической болезни кроликов (rabbit hemorrhagic disease virus), относящийся к семейству Caliciviridae, роду Lagovirus.
В настоящее время выделяют 4 геногруппы лаговирусов, две патогенные: GI1 (GI1e-GI1d) и GI2, и две непатогенные: GI3 и GI4 [7]. Наибольшую опасность для кроликов в Российской Федерации представляют вирусы генотипа GI1 (ранее RHDV1 или RHDVа) [3].
Вирулентность этих вирусов для кроликов чрезвычайно высока, инкубационный период составляет 48-72 часа. Клинически болезнь почти не проявляется. Обычно внешне здоровые кролики делают несколько судорожных движений конечностями и погибают. Лишь у отдельных особей наблюдалось легкое угнетение, отсутствие аппетита и за 1-2 часа до гибели истечения из носа. Смертность может достигать 100% [8].
Для профилактики ВГБК в Российской Федерации применяют инактивированные тканевые вакцины, представляющие собой суспензию печени кроликов, инфицированных вирулентными штаммами вируса геморрагической болезни кроликов. Изготовление таких вакцин трудоемкий и дорогостоящий процесс, сопряженной с использованием животных и соблюдением мер биологической безопасности при работе с вирулентным вирусом.
В настоящее время в ветеринарной практике все чаще применяются субъединичные рекомбинантные вакцины на основе белков вируса, полученных в бакулорвирусной системе экспрессии генов [2].
Геном представлен одной молекулой РНК+, состоящей из 7 437 н.о. Вирусный капсид состоит из главного структурного белка VP60, кодируемого последовательностью нуклеотидов открытой рамки считывания 1 (ORF-1) и минорного белка VP-2. Антитела к главному капсидному белку являются протективными, что позволяет использовать рекомбинантный VP60 в качестве субъединичной вакцины против геморрагической болезни кроликов.
Несмотря на то, что получение в эукариотической или бакуловирус-ной системе экспрессии генов рекомбинантного главного капсидного белка RHDV и определение его иммуногенной активности, было показано рядом авторов [1, 4, 5, 6, 9, 10, 11, 12], коммерчески доступной вакцины на его основе не существует.
Целью данного исследования является получение рекомбинантного VP60 вируса геморрагической болезни кроликов и изучение его антигенной и иммуногенной активности для кроликов.
Материалы и методы исследований. В качестве экспрессирующего вирусного вектора использовали вирус ядерного полиэдроза AcNPV. РНК вируса геморрагической болезни кроликов была изолирована из 10% суспензии печени кролика, зараженного штаммом «Во-ронежский-87» (геногруппа GI1) с гемагглютинирующей активностью 1:2048 (104 ЛД50/см3).
Для репродукции рекомбинантного вируса ядерного полиэдроза использовали культуру клеток насекомых (Spodoptera frugiperda) Sf-9. Клетки выращивали в роллерах (10-20 об./мин.) в условиях суспензии, с использованием среды «EX-Cell 420» (Sigma-Aldrich, США) при 27°С. Посевная концентрация клеток составляла 0,5*106 клеток/см3. Концентрацию и жизнеспособность клеток определяли в камере Горяева с использованием трипанового синего.
В работе была использована система бакуловирусной экспрессии Bac-to-Bac (Invitrogen, США). Конструирование рекомбинантного баку-ловируса осуществляли согласно рекомендациям производителя. На первом этапе амплифицированный с вирусной РНК ген VP60, фланкированный последовательностями узнавания эндонуклеаз рестрикции, клонировали методом рестрикции-лигирования в трансферный вектор pFastBacHT. Трансферный вектор содержит экспрессионную кассету, в которой помимо гена vp60 находится ген устойчивости к гентамицину и фланкирующие последовательности транспозона Tn7. Рекомбинантная трансферная плазмида pFastBacHT-vp60 была использована для трансформации клеток E. coli DH10Bac (Invitrogen, США), которые содержат модифицированный бакуловирусный геном в виде большой плазмиды с устойчивостью к тетрациклину и вектор-помощник, кодирующий фермент транспозазу, с устойчивостью к ка-намицину. В трансформированных клетках DH10Bac транспозаза осуществляет сайт-специфический перенос экспрессионной кассеты из трансферного вектора в модифицированный бакуловирусный геном. Первичный отбор рекомбинантных клонов происходил на основании цветного теста, затем отобранные неокрашенные колонии проверяли методом ПЦР с олигонуклеотидами, один из которых специфичен к ба-куловирусному геному, а второй к экспрессионной кассете.
Положительные в ПЦР рекомбинантные клоны были использованы для выделения ДНК с последующим определением нуклеотидной последовательности гена VP60 методом секвенирования.
Выделение и очистку рекомбинантной ДНК Бак-УР60 осуществляли методом щелочного лизиса согласно рекомендациям производителя системы экспрессии (Invitrogen, США). Затем ее использовали для химической трансфекции культуры клеток насекомых Sf-9 (в концентрации 1-1,2*106клеток/см3) c помощью катионных липосомных частиц CellFectin (Invitrogen, США). Через 4 суток полученным рекомбинантным бакуловирусом вируса ядерного полиэдроза (AcORF-1) (0 пассаж) с множественностью заражения 2 БОЕ/см3 снова заражали культуры клеток насекомых Sf-9. После проявления признаков ЦПД (3-5 суток после инфицирования) культуральную жидкость центрифугировали 10 мин. при 3000 об/мин, а полученный супернатант был использован в качестве исходной матричной расплодки (Masterseed) вируса. Активность Masterseed, а также Workingseed рекомбинантных вирусов определялась по уровню экспрессии рекомбинантного белка.
Наличие экспрессии и специфичность рекомбинантного белка определяли методами электрофореза белков в полиакриламидном геле с додецилсульфатом натрия (ПААГ-ДСН) по методу Laemmli (1970) и иммуноблотинга.
Электрофорез проводили в пластинах полиакриламидного геля размером 70*100*0,75 на приборе Mini-PROTEAN II (Bio-Rad, США) в восстанавливающих условиях при постоянном напряжении 200 V. Разделяющий гель содержал 12% акриламида, 0,5% N.N-метилен-бис-акриламида, 0,375 М трис-HCl pH 8,8 и 0,1% ДСН. Фокусирующий гель содержал 4% акриламида, 10% N.N-метилен-бисакриламида в 0,125 М трис-HCl буфере pH 6,8. Для полимеризации в оба геля вносили по 0,025% персульфата аммония и 0,075% TEMED. Электродный буфер содержал 0,025 М трис-HCl, 0,192 М глицина, pH 8,3 и 0,1% ДСН. Все испытуемые пробы содержали лизирующий буфер с восстановителем (0,25 М трис-HCl, pH 6,8, 8% ДСН, 20% в-меркаптоэтанола, 40% глицерина) и были прогреты в течение 5 минут при 100°С.
Заливку геля и подготовку аппарата для электрофореза к работе проводили согласно рекомендациям изготовителя. Белки в гелях окрашивали 0,3% coomassie blue R250.
Для постановки иммуноблоттинга после электрофоретического разделения recVP60 переносили на мембрану «Immobilon-NC» (Millipore, США) в «полусухой» буферной системе на приборе Multiphor II (LKB, Швеция) при постоянной силе тока 200 мА в течение 1 часа при комнатной температуре. В буфер для переноса входили 0,025 М трис-HCl, 0,193 М глицин, 20% метанол, рН 8,35. Эффективность переноса оценивали после окраски одной мембраны-реплики 0,1% раствором амидо-черного.
Несвязавшиеся с белками участки мембраны блокировали инкубированием в растворе ФСБТ, содержащем 3% Gelatine Blocking Grade (Gerbu, ФРГ) в течение 16 часов при +4°С. После этого мембраны отмывали 4 раза в ФСБТ и 4 раза в ФСБ.
Для идентификации белка recVP60 мембраны инкубировали с моноклональными антителами к структурному белку капсида вируса гемморагической болезни кроликов мечеными пероксидазой хрена (Ingenaza, Испания) в растворе ФСБТ, содержащем 3% Gelatine Blocking Grade (в разведении 1:100). В качестве субстратного раствора использовали 3,3'-диаминобензидин (Sigma-Aldrich, США) (0,05% раствор в ФСБ) и 0,01% H2O2. Окрашивание останавливали промыванием мембраны в воде.
В качестве белков-маркеров молекулярной массы использовали PageRuler Plus Prestained Protein Ladder (Thermo Scientific, США).
Уровень экспресии и относительное содержание recVP60 в лизате клеток насекомых Sf-9 определяли в ИФА с помощью набора INgezim RHDV DAS 1.7.RHD.K.2 (Ingenaza, Испания).
Суспензию клеток центрифугировали 10 мин при 3000 об/мин (4°С). После удаления супернатанта к осадку клеток добавляли лизирующий буфер - ФБР, содержащий 0,001 М фенилметилсульфонилфтори-да и 1% NP-40 (3 мл буфера на 1*107 клеток). Осадок ресуспендирова-ли, замораживали при -70°С, оттаивали при комнатной температуре, проводили ультразвуковую дезинтеграцию и центрифугировали 30 мин при 10 000 об/мин, полученный антиген использовали для анализа. Контролем служил аналогично полученный материал из клеток, инфицированных AcNPV без вставки.
Очистку recVP60 проводили методом афинной хромотографии на смоле HIS-SelectR HF Nickel Affinity Gel (Sigma-Aldrich, США) в денатурирующих условиях с 8М мочевиной.
Полученные препараты подвергали диализу против PBS.
Определение концентрации общего белка в очищенных препаратах проводили с помощью набора PierceTM BCA Protein Assay Kit (Thermo Scinetific, США).
Реакцию гемагглютинации (РГА) ставили с эритроцитами человека микрометодом по общепринятой методике. В качестве положительного контроля использовали 10% суспензию печени кролика зараженного штаммом ВГБК «Воронежский-87».
Для определения антигенной активности recVP60 были использованы советская шиншилла, ранее не вакцинированные кролики в возрасте 2-2,5 месяцев, которых разбили на две группы по 10 и 5 голов, соответственно. Животным первой группы вводили подкожно очищенный recVP60 в дозе 50 мкг. Животных второй (контрольной) группы не иммунизировали. До вакцинации и на 21 день после у животных брали сыворотки крови, которые исследовали на наличие специфических антител к ВГБК в ИФА и РТГА.
Для выявления антител к ВГБК в ИФА использовали набор INgezim RHDV 1.7.RHD.K.1 (Ingenaza, Испания).
Реакцию торможения гемагглютинации (РТГА) ставили с эритроцитами человека микрометодом по общепринятой методике. В качестве антигенов использовали 10% суспензию печени кролика зараженного штаммом ВГБК «Воронежский-87» и recVP60 в дозе 4 ГАЕ\0,025 см3.
На 21 сутки после иммунизации кроликов заражали вирулентным штаммом «Воронежский-87» ВГБК в дозе 1000 ЛД50. Иммуногенную активность recVP60 для кроликов вычисляли по формуле:
ИА= (ЛК - ЛВ) / ЛК х 100%,
где ИА - иммуногенная активность, ЛК - летальность в контрольной группе (%), ЛВ - летальность среди вакцинированных животных (%).
Для выявления антигена ВГБК в патологическом материале использовали ИФА тест-систему INgezim RHDV DAS 1.7.RHD.K.2 (Ingenaza, Испания). Результаты исследований и их обсуждение. В результате проведенных работ был получен рекомбинантный вирус ядерного полиэдроза, содержащий ген ORF-1 RHDV (Gl1). Полученные конструкции секвенировали для проверки идентичности нуклеотидной последовательности вставки ORF1 гену ORF1 штамма «Воронежский-87», доступному в базе данных Genbank.
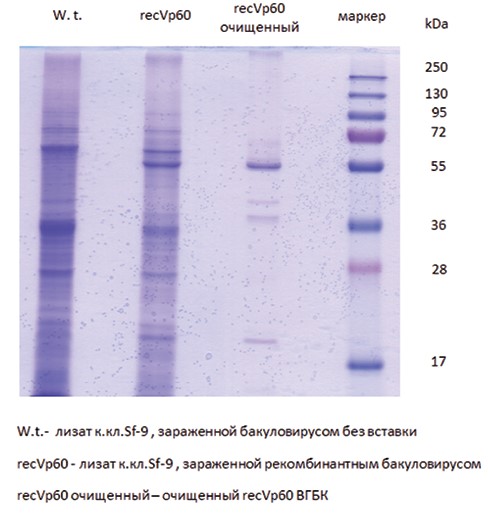
При заражении клеток Sf-9 рекомбинантным бакуловирусом отмечали экспрессию структурного белка VP60 RHDV. На электрофореграмме видна полоса, соответствующая белку молекулярной массой около 60 kDa (рисунок 1).
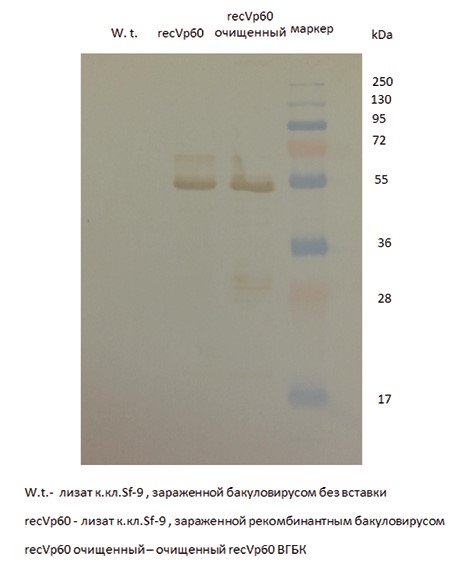
Рис. 1. Определение молекулярной массы и степени очистки полученного recVP60 RHDV методом электрофореза в ПААГ Идентификация методом иммуноблотинга показала, что данная полоса окрашивается моноклональными антителами к структурному белку капсида вируса гемморагической болезни кроликов (рисунок 2).
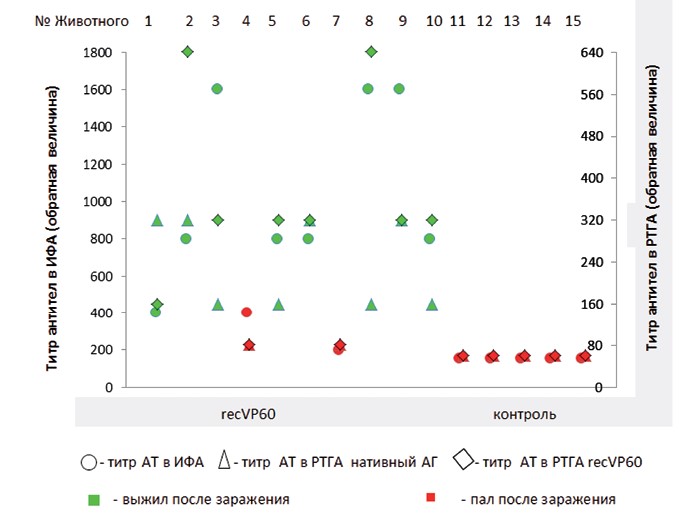
Рис. 2. Определение специфичности полученного recVP60 RHDV методом иммуноблотинга Определение уровня экспрессии recVP60 методом титрования антигена в ИФА показало, что максимальное относительное накопление антигена в исследуемом лизате клеток происходит на 3-4-е сутки после заражения культуры клеток рекомбинантным бакуловирусом и составляет 1:1600. После очистки 1 г клеточного осадка было получено 5 мл препарата recVP60 с концентрацией общего белка 200 мкг/мл. Гемагглю-тинирующая активность очищенного препарата recVP60 концентрацией 50 мкг/мл составила 1:32000. Очищенный препарат recVP60 вводили кроликам в дозе 50 мкг. Результаты изучения антигенной и иммуногенной рисунке 3.
Рис. 3. Результаты исследования антигенной и иммуногенной активности recVP60 RHDV на кроликах До вакцинации животные были серонегативны в отношении вируса геморрагической болезни кроликов: уровень антител в ИФА составил <1:200 (1:200 минимальное разведение сыворотки, используемое в тест-системе ИФА), в РТГА с нативным антигеном и recVP60 уровень антител был <1:40 (1:40 минимальное разведение сыворотки, используемое в РТГА, торможение агглютинации в разведение 1:40 и ниже принимали за неспецифическое).
Введение кроликам recVP60 RHDV вызывало у животных образование специфических антител, выявляемых в ИФА и РТГА. Уровень антител в ИФА составил 1:200-1:1600, в РТГА с нативным антигеном 1:80-1:320, в РТГА с рекомбинантным антигеном 1:80-1:640. При этом животные с уровнем антител в ИФА 1:800 и выше (в РТГА 1:160 и выше) были устойчивы к контрольному заражению вирулентным штаммом вируса геморрагической болезни кроликов.
У всех контрольных (невакцинированных) (летальность - 100%) и двух вакцинированных животных (летальность - 20%) через 48-72 часов после заражения отмечали характерные клинические признаки геморрагической болезни кроликов и гибель в течение 2-4 суток.
При проведении патоморфологических исследований у погибших животных наблюдали множественные геморрагии, поражения печени, селезенки, почек. Исследование в ИФА проб печени погибших кроликов показало наличие вируса геморрагической болезни кроликов.
У одного погибшего кролика из опытной группы уровень антител на момент контрольного заражения был 1:200 и 1:80, у второго 1:400 и 1:80 в ИФА и РТГА, соответственно. При этом еще один кролик с титром антител в ИФА 1:400 (1:160-1:320 в РТГА) выжил.
Таким образом, животные с уровнем антител, выявляемых в ИФА 1:800 и выше (в РТГА 1:160 и выше), были устойчивы к контрольному заражению в 100% случаев, а антитела, обнаруженные в ИФА в титре 1:400, защитили только 50% кроликов. Иммуногенная активность recVP60 составила 80%. Заключение. В результате проведенной нами работы получен рекомбинантный структурный белок VP60 вируса геморрагической болезни кроликов. Данный белок обладает агглютинирующей активностью, по-видимому, за счет образования вирусоподобных частиц. Рекомбинантный VP60 RHDV, вводимый кроликам в дозе 50 мкг, вызывал у животных синтез специфических антител, выявляемых в ИФА и РТГА, и защищал при контрольном заражении вирулентным штаммом «Воронежский-87» в дозе 1000 ЛД50 80% вакцинированных животных. Полученные результаты свидетельствуют о возможности использования recVP60 RHDV в качестве специфического компонента субъединичной вакцины против геморрагической болезни кроликов, вызываемой штаммами геногруппы GI1.
Список литературы:
Резюме. Вирусная геморрагическая болезнь кроликов - остропротекаю-щая высококонтагиозная болезнь, характеризующаяся явлениями геморрагического диатеза во всех органах, в особенности в легких и печени. Возбудителем ВГБК является вирус геморрагической болезни кроликов, относящийся к семейству Caliciviridae, роду Lagovirus. В настоящее время выделяют 4 ге-ногруппы лаговирусов, две патогенные: GI1 (GI1e-GI1d) и GI2, и две непатогенные: GI3 и GI4. Наибольшую опасность для кроликов в Российской Федерации представляют вирусы генотипа GI1. Вирулентность этих вирусов для кроликов чрезвычайно высока, инкубационный период составляет 48-72 часа. Клинически болезнь почти не проявляется. Смертность может достигать 100%. Для профилактики ВГБК в Российской Федерации применяют инактивированные тканевые вакцины, представляющие собой суспензию печени кроликов, инфицированных вирулентными штаммами вируса геморрагической болезни кроликов. В настоящее время в ветеринарной практике все чаще применяются субъединичные рекомбинантные вакцины на основе белков вируса, полученных в бакуловирусной системе экспрессии генов. Авторами получен рекомбинантный VP60 вирус геморрагической болезни кроликов генотипа GI1 в бакуловирусной системе экспрессии генов и изучена его антигенная и иммуногенная активность для кроликов. Установлено, что рекомбинантный капсидный белок VP60 вируса геморрагической болезни, вводимый кроликам в дозе 50 мкг, вызывает у животных синтез специфических антител, выявляемых при иммуноферментном анализе и в реакции торможения гемагглютинации, и защищает 80% животных при контрольном заражении вирулентным штаммом «Воронежский-87» в дозе 1000 ЛД50. Эти данные свидетельствует о возможности использования этого белка в качестве специфического компонента субъединичной вакцины против геморрагической болезни кроликов, вызываемой штаммами геногруппы GI1.
Ключевые слова: кролики, вирусная геморрагическая болезнь кроликов, рекомбинантный капсидный белок, бакуловирусная система экспрессии генов, антигенная активность, иммуногенная активность, защита, специфические антитела, рекомбинантная вакцина, вирулентный штамм.
Сведения об авторах:
Алексеев Константин Петрович, кандидат биологических наук, старший научный сотрудник АНО «Научно-исследовательский институт диагностики и профилактики болезней человека и животных»; 123098, г. Москва, ул. Гамалеи, 16; тел.: 8-495-7394216; e-mail: kalekseev@hotmail.com.
Москвина Анна Сергеевна, кандидат биологических наук, старший научный сотрудник АНО «Научно-исследовательский институт диагностики и профилактики болезней человека и животных»; 123098, г. Москва, ул. Гамалеи, 16; тел.: 8-495-7394216; e-mail: annamoskvina17@gmail.com.
Верховский Олег Анатольевич, доктор биологических наук, профессор, президент АНО «Научно-исследовательский институт диагностики и профилактики болезней человека и животных»; 123098, г. Москва, ул. Гамалеи, 16; тел.: 8-495-7394216; e-mail: info@dpri.com.
Селезнева Екатерина Валерьевна, микробиолог отдела контроля качества ООО «Ветбиохим»; 123098, г. Москва, ул. Гамалеи, 16; тел.: 8-495-1935493; e-mail: selja07@rambler.ru.
Черных Олег Юрьевич, доктор ветеринарных наук, директор ГБУ КК «Кропоткинская краевая ветеринарная лаборатория»; 352380, г. Кропоткин, ул. Красноармейская, 303; тел.: 8-918-4956659; e-mail: gukkvl50@kubanvet.ru.
Ответственный за переписку с редакцией: Мухин Алексей Николаевич, кандидат биологических наук, старший научный сотрудник АНО «Научноисследовательский институт диагностики и профилактики болезней человека и животных»; 123098, г. Москва, ул. Гамалеи, 16; тел.: 8-495-7394216; e-mail: amuhin@yahoo.com.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|