|
||||

Оценка морфологии эритроцитов после введения пропофолаМатвеева М.В., Уша Б.В., Крюковская Г.М. Эритроцит — один из важнейших элементов крови, который представляет собой сложноорганизованную структуру, V изменение которой с одной стороны вызывает нарушение функции клетки, приводящей к снижению ее способности переносить кислород, а с другой стороны - к возможности свободно перемещаться по гемокапиллярам, обеспечивая каждый орган адекватным количеством кислорода. Нарушение структуры эритроцитов, как правило, приводит к развитию анемии заканчивающейся кислородным голоданием тка-ней, проявляющейся расстройством функций центральной нервной системы и гемодинамики [1, 3, 4]. Изменения структуры эритроцита может происходить под действием эндогенных факторов, таких как заболевание кроветворных органов, или экзогенных факторов, которыми чаще всего являются различные ксенобиотики, в частности лекарственные средства, влияющие на гемопоэз или непосредственно на мембрану эритроцитов. С использованием световой фазово-контрастной микроскопии нативных препаратов клеток крови может быть получена информация о поверхностной геометрии эритроцитов. Исследование цитоархитектоники эритроцитов позволяет судить о структурно-функциональных свойствах их мембран. Это дает возможность использовать эритроцит в качестве доступной модели при исследовании процессов повреждения клеточных мембран (2). Влияние лекарственных средств, угнетающих центральную нервную систему, на состояние мембран эритроцитов практически не изучено. Тем более, изменение мембраны эритроцита может являться признаком дестабилизации мембран не только этих клеток, но и может характеризовать повреждение клеточных мембран организма в целом. Поэтому, оценка морфологии эритроцитов до и после наркоза будет являться еще одним важным критерием состояния организма и позволит клиническим фармакологам разработать алгоритм постоперационных терапевтических мероприятий. В настоящем исследовании мы попытались выявить особенности структурно-функционального состояния плазматических мембран эритроцитов у собак после анестезии пропофолом. Материалы и методы Опыт проводили на пяти семимесячных щенках однопометниках массой от 13,5 до 18,0 кг. Предварительно до опыта животных трехкратно дегельминтизировали препаратом Празител и проводили восстановительную терапию препаратом Хелсевит по 0,5 мл внутримышечно четырехкратно с интервалом 7 дней. 1 Пропофол в форме препарата Анестофола 1% раствора для инъекций вводили внутривенно пять дней подряд в дозе 0,6 мл/кг массы тела (6 мг/кг по пропофолу). Введение анестефола проводили без премедикации. Кровь у каждого животного отбирали до опыта и через 3, 5 и 15 дней после первого введения анестофола. Исследование на-тивных препаратов крови сразу после забора крови из вены Сафена проводили методом фазово-контрастной микроскопии на микроскопе Leica DM 1000 с использованием увеличения 1000 [1, 4]. Результаты исследования. Все собаки входили в наркоз и выходили из него плавно, без рвоты и апноэ, без резкого изменения температуры, пульса и дыхания при первых трех введениях. При дальнейшем применении препарата у трех опытных животных на пятое введении развивались признаки аллергической реакции, проявляющиеся отеком морды. Одновременно, у двух из трех животных отмечали рвоту. В этом случае собакам применяли димедрол и дексаметазон по 1,0 мл подкожно и фуросемид 1,0 мл внутримышечно. Следует отметить, что у двух из пяти подопытных животных не отмечались интеранаркозные и постнаркозные осложнения. Далее за весь период наблюдения в течение 21 дня после последнего введения анестофола рецидивов не наблюдали. При исследовании мазков крови до опыта у отдельных животных отмечали единичные эхиноциты, незначительный анизоцитоз (рисунок 1).
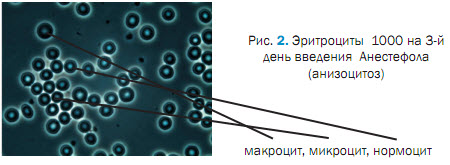
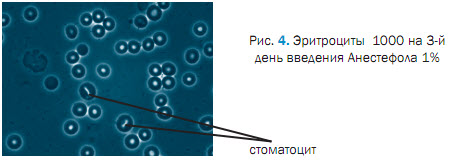
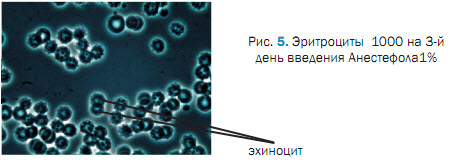
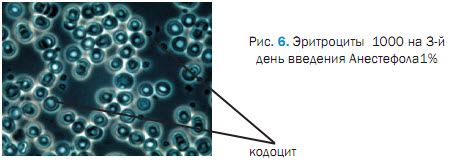
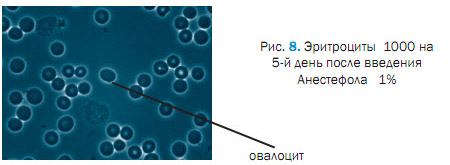
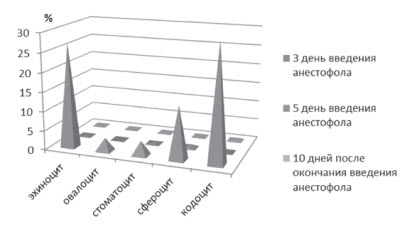
При исследования крови на после 3 введения Анестефола, отмечали изменения в морфологической картине крови проявляющиеся пойкилоцитозом, эхиноцитозом (27,01 ± 0,02 %), сфероцитозом (13,8 ± 0,04 %), кадоцитозом (30,0 ± 1,2 %) (рисунок 2, 3, 4, 5, 6). Представлены эхиноциты 1-го и 2-го и в незначительных количествах 3-го порядка. Шиповидные эритроциты менее деформируемы и имеют пониженную способность к агрегации. При потери эритроцитом (эхиноцит 3-го порядка) мембранного вещества отмечаются одиночные сферы на патологических эритроцитах [2,3,5]. В препаратах нативной крови одного щенка отмечали локальные участки плотной агрегации эритроцитов (рисунок 7). Несмотря на проявившуюся алергическую реакцию в виде отека морды у 3 из 5 собак после 5-го введения Анестефола в крови наблюдали только незначительный анизоцитоз и единичные кодоциты, эхиноциты. Следует отметить, что наблюдаемые эхиноциты соответствовали 1 и частично 2 порядка, т.е. без везикуляции и микрокламатоза мембранны. Также, отмечали в незначителном количестве (0,9±0,03 %) сфероциты и единичные элиптоциты. Цепочки агрегации эритроцитов не превышали физиологически допустимых концентраций, что соответствовало до наркозному периоду (рисунок 8).
Через 10 суток после последнего введения Анестефола морфология эритроцитов практически не отличалась от физиологической нормы. Таким образом, морфологическая характеристика эритроцитов имела положительную компенсаторную динамику в сравнении с 3 и 5 днями введения анестетика. Изменения эритроцитов находились в рамках характерных для клинически здоровых собак данного возраста (единичные овалоциты, умеренный аницитоз). Обобщенные данные по морфологии эритроцитов в период опыта представлены на рисунке 9.
Экстраполяция данных исследований структуры мембран эритроцитов при пятикратном введении 1% Анестефола позволили скринингово оценить морфо-функциональные изменения в организме щенков. Заключение. Причиной трансформации эритроцитов, как правило, являются либо непроникающие анионы, либо катионные ам-фифилы. Пропофол являясь высоколипофильным соединением может проникать через клеточную мембрану эритроцитов и способствовать образованию катионных амфифилов. Такие соединения приводят к ингибировариванию кальциевого насоса и вызывают характерные изменения формы клеток по кальций зависимому механизму, характеризующую последующую трансформацию эритроцита в стоматоцит. Кроме этого, изменение формы клетки можно объяснить агрегацией эритроцитарного белка спектрина, вызванной кальцием, и связанное с этим изменение конфигурации и площади клеточной мембраны. Нарушение взаимодействия между компонентами мембран эритроцитов (фосфолипидами, эфирами холестерина, триглицери-дами) под влиянием пропофола, видимо усиливает процессы пере-кисного окисления и приводит к изменению электрического заряда на поверхности мембраны. Такие изменения создают условия к нарушению электростатического отталкивания между клетками и возникновению агрегации эритроцитов, особенно при изменении их формы от дисковидной до сферической. Полученные результаты показали, что морфо-функциональ-ные изменения эритроцитов на введение пропофола носят фазовый характер, проявляются на ранних этапах и прогрессируют в первые несколько суток, а в дальнейшем, за счет включения компенсаторных механизмов, происходит восстановление клеточных мембран. Формирующийся синдром эритроцитарной мембранопатии приводит к усугублению постнаркозного периода и предрасполагает к осложнениям со стороны сердечно-сосудистой системы. Выявленные в процессе исследований изменения клеточных мембран эритроцитов на введение пропофола характеризуют временное развитие умеренной компенсируемой анемии, быстро восстанавливающейся после окончания введения анестетика. Чувствительность клеточных мембран эритроцитов к лекарственным средствам, в частности, к анестетикам, является важным показателем и может быть рекомендована в для оценки безопасности применяемых лекарственных средств. Предварительные скрининговые исследования архитектоники эритроцитов позволяют оценить физиологический статус животного, что дает возможность ветеринарному специалисту прогнозировать индивидуальный ответ пациента на введение анестетика, подобрать адекватную дозу препарата и разработать индивидуальный алгоритм постнаркозных терапевтических мероприятий. Список литературы
Резюме. Изучено влияние пропофола на особенности состояния плазматических мембран эритроцитов у собак после анестезии анестофолом. Опыты проводили на пяти-, семимесячных щенках, которым вводили пропофол внутривенно пять дней подряд в дозе 0,6 мл/кг массы тела в форме препарата Анестофол 1% раствора для инъекций. Состояние эритроцитов оценивали методом фазово-контрастной микроскопии на микроскопе Leica DM 1000 с использованием увеличения 1000 через 3, 5 и 15 дней после первого введения анестофола. Под влиянием анестофола у собак в первые три дня введения препарата отмечали изменение мембраны эритроцитов, проявляющиеся появлением в крови овалоцитов, кодоцитов, стоматоцитов, эхиноцитов и сфероцитов. Постепенно, за счет компенсаторных механизмов организма картина крови нормализовалась и через 10 дней после последнего введения анестофола соответствовала физиологической норме. Чувствительность клеточных мембран эритроцитов к лекарственным средствам, в частности, к анестетикам, является важным показателем и может быть рекомендована для оценки безопасности применяемых препаратов. Ключевые слова: эритроцит, стоматоцит, эхиноцит, овалоцит, сфе-роцит, анестофол, пропофол, анестезия, лекарственные средства, микроскоп. Сведения об авторах: Уша Борис Вениаминович, академик РАСХН, заведующий кафедрой незаразных болезней Московского государственного университета пищевых производств; 109316, Москва, ул. Талалихина, 3; тел.: +7 (499) 750-01-11; e-mail: vetsan@mgupp.ru. Крюковская Галина Михайловна, кандидат ветеринарных наук, доцент кафедры незаразных болезней Московского государственного университета пищевых производств; 109316, Москва, ул. Талалихина, 3; тел.: +7 (499) 750-01-11; e-mail: vetsan@mgupp.ru. Виолин Борис Викторович кандидат ветеринарных наук, заведующий отделом ФГБУ Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов; 123022 Москва, Звенигородское ш., 5; e-mail: b_viol@yahoo.com. Ответственный за переписку с редакцией: Матвеева Маргарита Владимировна, соискатель кафедры незаразных болезней Московского государственного университета пищевых производств; 109316, Москва, ул. Талалихина, 3; тел.: +7 (499) 750-01-11; e-mail margofree@yandex.ru. UDK 619: 616-076 ASSESSMENT OF MORPHOLOGY OF ERYTHROCYTES AFTER INJECTION OF PROPOFOL Matveeva M.V., Usha B.V., Kryukovskaya G.M., Violin B.V. Summary Influence of propofol on features of condition of plasmatic membranes of erythrocytes at dogs after anesthesia of Anestofol was studied. Experiments were made on five-seven months puppies to whom propofol was injected intravenously during five days in a dose of 0.6 ml/kg of body weight in the form of a medication Anestofol (1%). State of erythrocytes was estimated by method of phase and contrast microscopy on Leica DM 1000 microscope with the use of increase x1000 in 3, 5 and 15 days after the first introduction of Anestofol. Under influence of Anestofol at dogs in the first three days of introduction of the medication there was noted change of a membrane of the erythrocytes, being shown by emergence in blood of ellyptocytes, target cells, stomatocytes, echinocytes and spherecytes. Gradually at the expense of compensatory mechanisms of an organism the picture of blood was normalized and in 10 days after the last injection of Anestofol physiological standard was registered. Sensitivity of cellular membranes of erythrocytes to preparations, in particular, to anesthetics, is an important indicator and can be recommended for an assessment of safety of applied preperations. Keywords: erythrocyte, stomatocyte, echinocyte, ellyptocyte, spherecyte, Anestofol, propofol, anesthesia, preparations, microscope. References
Data on authors: Usha Boris V., Academician of the RAAS, Head of the Departament of Noncontagious Diseases of the Moscow State University of Food Productions; 3, Talalikhina st., Moscow, 109316; phone: 8 (499) 750-01-11; e-mail: vetsan@ mgupp.ru. Kryukovskaya Galina M., Ph.D. in Veterinary Medicine, Docent of the Department of Noncontagious Diseases of the Moscow State University of Food Productions; 3, Talalikhina st., Moscow, 109316; phone: 8 (499) 750-01-11; e-mail vetsan@mgupp.ru. Violin Boris V., Ph.D. in Veterinary Medicine, Head of the Department of the All-Russian State Center of Quality and Standardization of Medicines for Animals and Feed; 5, Zvenigorodskoye hgw., Moscow, 123022; e-mail: b_viol@ yahoo.com. Responsible for correspondence with the editorial board: Matveeva Margarita V., applicant of the Department of Noncontagious Diseases of the Moscow State University of Food Productions; 109316, Moscow, Talalikhina st., 3; phone: 8(499) 750-01-11; e-mail: margofree@yandex.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|