|
||||

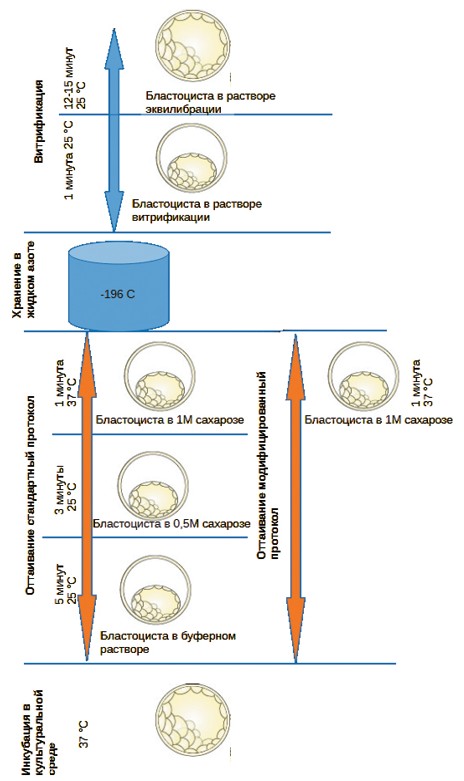
Одноступенчатый протокол оттаивания витрифицированных бластоцист крупного рогатого скотаУДК 619:636.2:611.013.31 Макутина В. А., Исаева А. Г., Кривоногова А. С., Моисеева К. В., Романова А. С. Федеральное государственное В настоящее время метод криоконсервации гамет и эмбрионов млекопитающих широко распространен в рутинной практике лабораторий вспомогательных репродуктивных технологий (далее, ВРТ) для лечения бесплодия человека, в научно-исследовательских работах на гаметах и эмбрионах млекопитающих для накопления биоматериала, а также в эмбриотрансфере сельскохозяйственных животных с высокой генетической ценностью. Консервация эмбрионов крупного рогатого скота (далее, КРС) чаще всего выполняется после вымывания эмбрионов, полученных при оплодотворении in vivo. В научно-исследовательских работах на лабораторных животных, а также при проведении вспомогательных репродуктивных технологий человека используют эмбрионы, полученные in vitro. Результативность искусственного процессинга клеток, прошедших весь цикл (дозревание гамет, оплодотворение, культивирование эмбриона) in vitro, в настоящее время не достигает уровня in vivo, так как затруднительно полностью имитировать все условия внутренней среды живого организма, а большое количество манипуляций приводит к высокому уровню стресса клеток, что негативно сказывается на их жизнеспособности. В научной литературе имеется много данных по культивированию биоматериалов лабораторных животных. Широкая практика ВРТ человека так же дает обширную информацию по особенностям in vitro оплодотворения, культивирования и криоконсервации гамет и эмбрионов человека. Однако исследований по сельскохозяйственным животным проводится сравнительно мало, а видовая специфичность клеток зачастую не позволяет применять ряд протоколов, адаптированных для лабораторных животных или человека к другим млекопитающим напрямую. Разработка и адаптация протоколов криоконсервирования-оттаивания необходима для накопления эмбрионов с отредактированным геномом для последующей подсадки животным-реципиентам, формирования криобанков или коллекций эмбрионов сельскохозяйственных животных с ценными хозяйственными признаками [1]. Для консервирования эмбрионов используют несколько методов, одним из наиболее удобных является витрификация. Метод витрификации позволяет сократить время криоконсервации в сравнении с медленным программируемым снижением температуры и обеспечивает хорошую выживаемость биоматериала, в том числе ооцитов млекопитающих. Первые данные об успешной витрификации эмбрионов мышей были представлены в 1985 г. [8]. На сегодняшний день разработано множество протоколов витрификации, специализированных наборов и крионосителей, позволяющих получать эффективные результаты при работе по рекомендуемому протоколу. Основное различие между ними заключается в используемых криопротекторах и их концентрации. Комбинация проникающих и непроникающих криопротекторов, таких как, диметилсульфоксид (далее, ДМСО), этиленгликоль (далее, ЭГ) и сахароза, вызывает эффект синергизма и позволяет с наибольшей результативностью заморозить биоматериал, в том числе ооциты/ зиготы млекопитающих. Необходимость использования больших концентраций криопротекторов требует поиска соединений, обладающих относительно невысокой токсичностью. Сахароза и другие подобные криопротекторы, не проникающие внутрь клетки, не могут обеспечить хорошую выживаемость эмбрионов при криоконсервации, поэтому их применяют вместе с проникающими внутрь клетки криопротекторами. В процессе витрификации происходит быстрое охлаждение раствора проникающих криопротекторов, в котором содержится биоматериал. При этом образуется стеклоподобное вещество, без формирования внеклеточных и внутриклеточных кристаллов льда [5]. Результативность метода также во многом обусловлена скоростью замораживания биоматериала. Однако не менее важна и скорость оттаивания [9]. В процессе оттаивания стеклоподобное состояние вещества должно перейти в жидкое. Чрезмерная скорость проникновения жидкости в клетку может привести к разрыву мембраны и гибели клетки. Как правило, в протоколах оттаивания используют пошаговое (трехэтапное) уменьшение концентрации сахарозы для снижения осмотического шока и набухания клеток. В настоящее время разработано несколько наборов для витрификации и оттаивания гамет и эмбрионов млекопитающих. Хотя в ветеринарной практике до сих пор применяется медленное программируемое замораживание, витрификация стала основным методом криоконсервации гамет и эмбрионов человека в медицинских репродуктивных технологиях. Выбор метода витрификации обусловлен доступностью и экономичностью данной технологии, а также высокой выживаемостью эмбрионов, криоконсервирован-ных данным способом, в сравнении с медленным программируемым замораживанием. Вместе с тем, протоколы витрификации и оттаивания, используемые в медицине, давно отработаны и стандартны. Однако в последние годы появился ряд исследований, которые ставят под сомнение эффективность используемых протоколов и предлагают скорректировать время нахождения биоматериала в растворах криопротекторов [2, 3, 6]. Быстрые протоколы были апробированы только на эмбрионах человека [3, 6] и мышиных ооцитах [2], причем во всех исследованиях продемонстрированы схожие или лучшие показатели по сравнению с контрольными группами. Толчком к исследованиям в этом направлении стала работа Gallardo 2019, в которой в ходе наблюдения in vitro за осмотическим поведением ооцитов показано, что обезвоживание при воздействии стандартных растворов криопротекторов происходит очень быстро: точка минимального объема клетки достигается за 60 секунд [4]. Следовательно, что дальнейшего продления времени воздействия растворов криопротекторов не нужно [4]. В нашем исследовании мы впервые применили одноступенчатую модификацию протокола для оттаивания витрифицированных бластоцист КРС, оценили уровень выживаемости и скорость реэкспансии бластоцист после разморозки. Материалы и методы исследований. Ооцит-кумулюсные комплексы отбирали из яичников коров постмортально на специализированном убойном пункте и транспортировали в лабораторию при температуре +37-38°С в течение 4 часов. Визуализируемые фолликулы от 2 до 8 мм аспирировали с помощью иглы 18G [7]. ОКК на время манипуляций вне инкубатора помещали в предварительно нагретую до 38,5°С буферную среду G-MOPS (Vitrolife). Для созревания ооцитов крупного рогатого скота BO-IVM (IVF-Bioscience) промышленного производства применяли специализированную среду. Среду покрывали минеральным маслом для кле- точных культур (Sage). Ооцит-кумулюсные комплексы помещали в среду созревания на 24-26 ч при уровне углекислого газа 6,5%, кислороде - 5,0% при температурном режиме 38,5°C [7]. Для экстракорпорального оплодотворения использовали крио-консервированные сперматозоиды быка, замороженные в пайеты объемом 0,5 мл. Пайеты размораживали на водяной бане с температурой 37°С в течение 30 секунд. Сперматозоиды обрабатывали в градиенте плотности (SpermGrad, Vitrolife) 3 мл 70% 15 минут при 400g. Осадок сперматозоидов после центрифугирования промывали буферной средой (Sperm Rinse, Vitrolife) с добавлением 3 МЕ гепарина в течение 10 минут при 200g [7]. Сперматозоиды помещали в среду для оплодотворения BO-IVF (IVF-Bioscience) с ооцит-кумулюсными комплексами в концентрации 1,0-2,0x106 подвижных сперматозоидов на 16-18 часов при 38,5°С, уровне углекислого газа 6,5 об.%, кислороде - 5,0 об.%. Среду BO-IVF закрывали минеральным маслом для клеточных культур (Sage) для предотвращения испарения и изменения осмолярности среды. Через 16-18 ч после инсеминации комплексы полностью очищали от кумулюсных клеток и сперматозоидов и переносили в среду культивирования (IVF-Bioscience) под минеральным маслом для клеточных культур (Sage). Эмбрионы были витрифицированы по стандартному протоколу с использованием набора Vitrification Media и пайет Cryotop (Kitazato) в соответствии с инструкцией производителя. Процедуру витрификации начинали с эквилибрации ооцитов в течение 12 минут в растворе с невысокой концентрацией проникающих криопротекторов (7,5% об/об ДМСО + 7,5% об/об ЭГ). После уравновешивания ооциты/зиготы помещали в среду для витрификации, содержащую (15% об/об ДМСО + 15% об/об ЭГ + 0,5 М сахароза) на 1 минуту. В среде витрификации ооциты находились не более 1 минуты до их погружения в жидкий азот, включая время нанесения на устройство для витрификации. Витрифицированные биоматериалы хранили в жидком азоте -196°С в сосудах Дьюара. Первую группу бластоцист размораживали с использованием набора Thawing Media (Kitazato) по инструкции производителя по методу многоступенчатой регидратации. Для оттаивания устройство для витрификации погружали в 1 мл среды, содержащей 1М сахарозу при температуре 37°С на 1 минуту. После ооциты/ зиготы переносили в 200 мкл среды со снижающейся концентрацией сахарозы 0,5 М на 3 минуты при 25°С, затем на 5 минут в 200 мкл буферного раствора HEPES M199 при 25°С. Общее время оттаивания составило 1 минуту при 37°С и 8 минут при 25°С (рисунок 1). После размораживания эмбрионы помещали в среду культивирования BO-IVC (IVF-Bioscience) под минеральное масло. Вторая группа бластоцист была разморожена по модифицированному протоколу одноступенчатой регидратации, при котором эмбрионы погружали в 1 мл среды, содержащей 1М сахарозы при температуре 37°С на 1 минуту (Liebermann, 2024). После чего эмбрионы сразу помещали в среду культивирования BO-IVC (IVF-Bioscience) под минеральное масло (рисунок 1). После оттаивания бластоцисты инкубировали в среде культивирования при уровне углекислого газа 6,5 %, кислороде - 5,0 % под минеральным маслом при температурном режиме 38,5°C. Покадровую съемку изображений проводили в системе Primo Vision (Vitrolife). Система была настроена на получение 1 снимка каждые 5 минут. Все полученные изображения сохраняли для последующего анализа реэкспансии бластоцист. Статистический анализ проводили с использованием Microsoft Excel. Результаты выражены как среднее и SEM или как процент. Сравнение групп проверено с использованием критерия t-теста. Статистическую значимость определяли как P<0,05. Результаты исследований и их обсуждение. Выживаемость бластоцист была стабильной и одинаково высокой независимо от использованного протокола оттаивания (таблица 1). Время реэкспансии — время расправления бластоцисты до объема перед криоконсервацией (рисунок 2) также значимо не отличалось между группами (таблица 1, рисунок 3).
Рис. 1. Протокол витрификации и протоколы оттаивания эмбрионов крупного рогатого скота
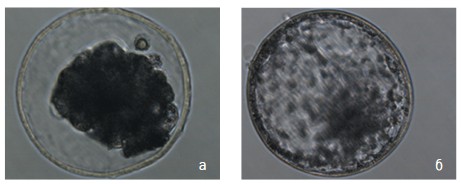
Рис. 2. Расправление (реэкспансия) бластоцисты после криоконсервации: а) фотография бластоцисты сразу после оттаивания; б) фотография бластоцисты через 2 часа после оттаивания
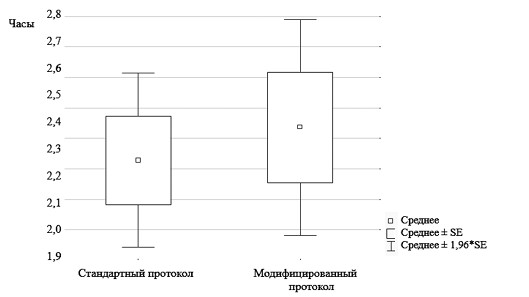
Рис. 3. Время реэкспансии бластоцист при стандартном протоколе оттаивания и при использовании модифицированного протокола
Таблица 1 Данные по эффективности оттаивания при стандартном протоколе оттаивания и при одноступенчатом модифицированном протоколе
Примечание: данные приведены в виде среднего и ошибки среднего (SEM). В нашем исследовании одношаговый протокол регидратации привел к схожему показателю выживаемости и скорости реэкспансии бластоцист в сравнении со стандартным многоступенчатым методом регидратации. Данный модифицированный протокол позволяет сократить время нахождения эмбрионов вне инкубатора при комнатной температуре во время процесса размораживания, а также сэкономить время специалиста на проведение процедуры оттаивания биоматериала. Таким образом, можно заключить, что одноступенчатый протокол эффективен для оттаивания витрифицированных бластоцист крупного рогатого скота и регидратация бластоцист может происходить в один этап, что согласуется с данными, полученными на бластоцистах человека [6]. Однако ключевым аспектом остается успешность имплантации оттаянных эмбрионов и наступление беременности. По результатам переноса бластоцист человека в работе Liebermann, 2024, достоверных отличий в наступлении клинической беременности не обнаружено: 72,9% беременностей в группе одноступенчатой регидратации и 69,8%% в контроле. В дизайне данного эксперимента не был предусмотрен перенос эмбрионов после витрификации коровам-реципиентам. Анализ уровня имплантации бластоцист крупного рогатого скота, оттаянных по модифицированному протоколу будет проведен в дальнейшем. Хотя к настоящему времени метод витрификации известен уже более 40 лет, используемые протоколы витрификации и последующего оттаивания достаточно стандартны и неизменны. Однако данные по применению ускоренного модифицированного протокола оттаивания, полученные на эмбрионах человека [6] и в нашей работе на бластоцистах крупного рогатого скота свидетельствуют о потенциальной возможности модификации стандартного протокола без снижения эффективности. Вместе с тем, необходимо отметить, что существуют потенциальные риски такого ускоренного одноступенчатого протокола, которые связаны со скоростью поступления воды внутрь клетки - скорость набухания клетки. Во-первых, так как в процессе витрификации клетка теряет воду, при быстром оттаивании в средах с низкой осмолярностью вода по градиенту концентрации интенсивно поступает в клетку, что вызывает резкое изменение объема клетки. Если скорость такой дегидратации будет слишком быстрой и набухание клетки будет избыточным, клеточная мембрана лопнет и клетка погибнет. Поэтому использование при оттаивании растворов с низкой осмолярностью не рекомендуется, несмотря на данные, полученные при разморозке эмбрионов человека без использования специализированных сред для оттаивания [3]. Во-вторых, следует отметить, что наше исследование и исследование Liebermann, 2024 проведено на эмбрионах на стадии бластоцисты. Эта стадия, предшествующая имплантации эмбриона в полость матки, и клеточ-ность эмбриона на этой стадии достаточно высокая. Бластоциста, как правило, содержит от 100 и более клеток. Гибель нескольких клеток в эмбрионе (до 10%) в процессе оттаивания по одному из протоколов не скажется на выживаемости эмбриона в целом и на его способности к имплантации. Планируется провести дальнейшие исследования о возможности применения модифицированного протокола оттаивания для эмбрионов и ооцитов витрифицированных на более ранних стадиях развития с более низкой клеточностью. Можно заключить, что в нашем исследовании мы впервые применили одноступенчатую модификацию протокола для оттаивания витрифицированных бластоцист крупного рогатого скота, оценили уровень выживаемости и скорость реэкспансии бластоцист после разморозки. Использование модифицированного протокола оттаивания позволит сократить время оттаивания эмбрионов, а значит и время нахождения эмбрионов вне инкубатора при субоптимальной температуре и осмолярности. Исследование выполнено при финансовой поддержке гранта Российского научного фонда, проект № 19-76-10022 (https://rscf.ru/project/19-76-10022). Список литературы: 1. Генетические технологии для сохранения биоресурсного потенциала сельскохозяйственных животных / И. М. Донник, В. А. Макутина, А. Г. Исаева [и др.] // Ветеринария Кубани. 2023. № 4. С. 9-13. 2. Cho J., Yu E., Lee H. et al. Ultra-Fast Vitrification: Minimizing the Toxicity of Cryoprotective Agents and Osmotic Stress in Mouse Oocyte Cryopreservation. Int J Mol Sci. 2024. 4. 25(3): 1884. 3. David Yiu Leung Chan, Murong Xu, Waner Wu et al. Live Birth resulted from a direct thawing of vitrified human blastocyst in a regular embryo culture medium. MedRxiv. 2024. 03. 20. 24304140. 4. Gallardo M., Saenz J., Risco R. Human oocytes and zygotes are ready for ultra-fast vitrification after 2 minutes of exposure to standard CPA solutions. Sci Rep. 2019. 9 (1): 15986. 5. Liebermann J., Dietl J., Vanderzwalmen P. et al. Recent developments in human oocyte, embryo and blastocyst vitrification: where are we now? Reprod Biomed Online. 2003. 7 (6): 623-633. 6. Liebermann J., Hrvojevicb K., Hirshfeld-Cytrona J. et al. Fast and furious: pregnancy outcome with one-step rehydration in the warming protocol for human blastocysts. RBMO. 2024. V. 48 (4): 1-8. 7. Makutina V., Isaeva A., Krivonogova A. et al. Adaptation of the technology for culturing bovine embryos on commercial media for human embryos. BIO Web of Conferences 82. 02042 (2024). 8. Rall W., Fahy G. Ice-free cryopreservation of mouse embryos at -196 degrees C by vitrification. Nature. 1985. 20. 313 (6003): 573-575. 9. Seki S., Mazur P. The dominance of warming rate over cooling rate in the survival of mouse oocytes subjected to a vitrification procedure. Cryobiology. 2009. 59 (1): 75-82. Резюме. Впервые был использован протокол модифицированного оттаивания (регидратации) для бластоцист крупного рогатого скота после витрификации. По результатам выживаемости бластоцист, а также по скорости реэкспансии после оттаивания достоверных отличий между модифицированным и стандартным многоступенчатым протоколом не обнаружено. Показатели выживаемости были одинаковыми в обеих группах (99,5%). Скорость реэкспансии составила 2,22±0,18 ч в группе контроль и 2,34±0,19 ч по модифицированному протоколу, соответственно. Использование модифицированного протокола позволит сократить время оттаивания эмбрионов, а значит и время нахождения эмбрионов вне инкубатора при субоптимальной температуре и осмолярности. Ключевые слова: витрификация, бластоцисты крупного рогатого скота, оттаивание эмбрионов, разморозка бластоцист. Сведения об авторах: Макутина Валерия Андреевна, кандидат биологических наук, старший научный сотрудник ФГБНУ УрФАНИЦ УрО РАН; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: makutina_v@rambler.ru. Кривоногова Анна Сергеевна, доктор биологических наук, доцент, ведущий научный сотрудник ФГБНУ УрФАНИЦ УрО РАН; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: tel-89826512934@yandex.ru. Моисеева Ксения Викторовна, младший научный сотрудник ФГБНУ УрФАНИЦ УрО РАН; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: moiseeva456@yandex.ru. Романова Алиса Сергеевна, кандидат технических наук, старший научный сотрудник ФГБНУ УрФАНИЦ УрО РАН; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: alisic_kolotova@mail.ru. Ответственный за переписку с редакцией: Исаева Альбина Геннадьевна, доктор биологических наук, доцент, ведущий научный сотрудник ФГБНУ УрФАНИЦ УрО РАН; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: isaeva.05@bk.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|