|
||||

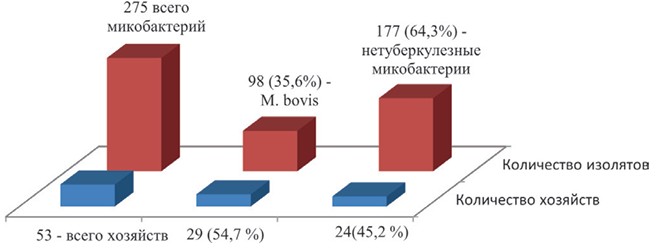
Нетуберкулезные микобактерии: сенсибилизирующая роль и патоморфологические изменения в организме зараженных животныхУДК.619.616.98:579.636.611.21 Баратов М. О. Прикаспийский зональный научноисследовательский ветеринарный институт - филиал Федерального Основным методом прижизненной диагностики туберкулеза является внутрикожная аллергическая туберкулиновая проба. Многочисленные исследования отечественных и зарубежных авторов свидетельствуют о специфичности, высокой чувствительности и пригодности ее для массовых исследований животных на ППД-туберкулин для млекопитающих [1, 5, 17]. В то же время, в некоторых случаях больные туберкулезом старые и истощенные животные, даже с генерализованным процессом, или молодняк, могут не реагировать на туберкулин [1, 3, 8, 11, 13]. Наряду с этим, возможны случаи, когда при аллергическом внутрикожном исследовании реагирующих на туберкулин животных выявляют систематически, а при убое с диагностической целью на вскрытии не обнаруживают патологоанатомических изменений, свойственных туберкулезу. Так, по данным H. Lee et al. (2008), при бактериологическом исследовании патологического материала от 60 животных в 23 случаях были выделены микобактерии, из которых 20 отнесены к M. avium [19]. При бактериологическом исследовании материала от 574 реагирующих на туберкулин животных культура микобактерий была получена от 143 голов (24,9%), причем, в 137 случаях (95,8%) были выделены культуры, отнесенные к нетуберкулезным и только 6 - к M. bovis [2, 12]. Это подтверждено рядом исследований, проведенных Р. А. Нуратиновым (1988), Н. П. Овдиенко с соавт. (2004) и др., которым при бактериологическом исследовании материала от 412 голов крупного рогатого скота, реагировавшего на туберкулин без патологоанатомических изменений во внутренних органах, удалось выделить 128 культур нетуберкулезных микобактерий [3, 7, 14]. Такие неспецифические реакции у животных могут быть связаны с сенсибилизацией их возбудителями туберкулеза птиц (M. avium), нетуберкулезными кислотоустойчивыми микобактериями, а также сапрофитами [2, 4, 6, 10, 11, 15]. В то же время есть данные, указывающие, что нетуберкулезные микобактерии способны приживаться в организме, вызывая изменения туберкулезного характера, специфичность которых невозможно определить при послеубойном осмотре [7, 9, 14, 16, 18, 20]. Следует отметить, что во всех почвенно климатических зонах Республики Дагестан при плановых аллергических исследованиях нередко изолируют реагирующих на туберкулин животных, у которых в последующем не подтверждается туберкулез. Так, из 1 624положительно реагировавших на туберкулин животных, убитых в 2005-2021 годах, характерные для туберкулёза изменения были обнаружены только в 184 случаях (11,3%) [1, 5, 12, 17]. Целью настоящего исследования явилось изучение видового разнообразия нетуберкулезных микобактерий на территории Республики Дагестан и характеристика их сенсибилизирующих и пато-морфологических возможностей. Материалы и методы исследований. Исследования проведены в хозяйствах (СПК, КФХ, ЛПХ) Кизлярского, Тарумовского, Хасавюртовского и Буйнакского районов. Неспецифический характер реакций был подтверждён симультанными аллергическими исследованиями с применением ППД-туберкулина для млекопитающих и КАМ согласно «Ветеринарным правилам осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления и отмены карантина и иных ограничений, направленных на предотвращение распространения и ликвидацию очагов туберкулеза» от 1 марта 2021 года. Отбор патологического материала (кровь, пробы кормов и навоза) транспортировка, хранение, подготовка питательных сред проведены согласно справочнику по микробиологическим и вирусологическим методам исследования (под ред. М. О. Биргера, 1981). Отобранный для бактериологического исследования материал обрабатывался 1,5%-м раствором лаурилсульфата натрия на 1,5%-м растворе едкого натрия в течение 30 мин. и засевался на среду Левенштейна-Иенсена и Финна, после чего выдерживался в термостате до 90 дней. Идентификация выделенных микобактерий проводилась в сравнении с референс-штаммами, хранящимися в лаборатории, путём изучения их культуральных и биохимических свойств. Обращалось внимание на скорость роста, образование пигмента на свету и в темноте, способность роста на простых питательных средах, рост при различных температурах (27,37, 45, и 52 градуса), каталазную и никотиномидазную активность, расщепление твина-80, способность роста на среде Левенштейна-Иенсена, содержащей 500 и 1000 мкг/мл салицилата натрия, 0,2% ПАСК, 5% поваренной соли, деградацию салицилата натрия и ПАСК. Установление сенсибилизирующей роли изолированных нетуберкулезных микобактерий и оценка патогенных свойств проводилась на кроликах с отрицательными результатами аллергических исследований (8 голов). Испытывалось три штамма (M. gordonae-flavescens, M. phlei, M. avium-intracellulare). Каждой культуройзаражалосьпо2кроликавдозе1мгбактериальноймассыв 1 мл изотонического раствора, еще 2 животных служили в качестве контроля. Через 35 дней наличие реакции проверялось симультанной пробой с применением туберкулина и КАМ внутрикожно в область спины в дозе 0,1 мл. Одновременно туберкулин в дозе 25 т.е. вводился внутрикожно и в область ушной раковины. Через 90 дней после заражения проводился убой животных. Ряд вопросов, связанных с патологоанатомическими и морфологическими изменениями при заражении нетуберкулезными микобактериями был изучен на телятах. Непатогенными культурами (M. gordonae-flavescens, M. avium-intracellulare) были заражены 4 теленка 3-месячного возраста с отрицательными результатами аллергических исследований (по 2 теленка на культуру). Заражение проводилось подкожно, в дозе 150 мг двукратно через день. Результаты исследований и их обсуждение. В период с 2017 по 2022 годы обследовано 53 хозяйства, в которых было выделено 275 культур микобактерий, из которых 98 (35,6 %) изолятов по биохимическим признакам отнесены к M. bovis. В 15 (51,7 %) хозяйствах из 29, где у животных был установлен туберкулез, наряду с M. bovis выделены и нетуберкулезные микобактерии. Кроме того, нетуберкулезные микобактерии были изолированы еще в 24 (45,2 %) хозяйствах, где животные реагировали на ППД- туберкулин, но на вскрытии туберкулезные поражения не были обнаружены и возбудитель болезни не выделен (рисунок 1).
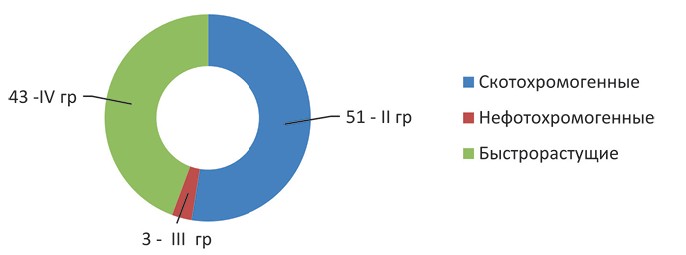
Рис. 1. Видовое разнообразие микобактерий, выделенных в хозяйствах Дагестана в период с 2017 года по 2022 год Нетуберкулезные микобактерии классифицировались по Раньону, согласно которой из 97 культур ко 2 группе (скотохромогенные) было отнесено 51, к 3 группе (нефотохромогенные) - 3 и к 4 (быстрорастущие) - 43 (рисунок 2).
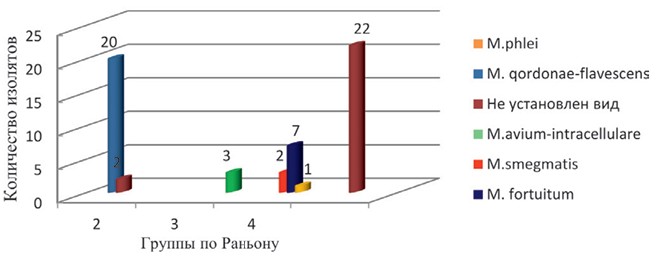
Рис. 2. Групповая идентификация нетуберкулезных микобактерий по Раньону С целью определения вида более подробно нами было изучено 57 штаммов. Из 22 культур второй группы 20 отнесены к М. qordonae-flavescens. У 2 штаммов установить вид не удалось. Три штамма были отнесены к группе M. avium-intracellulare. Из 4 группы к M. smegmatis отнесены 2, M. fortuitum - 7, M. phlei - 1. У 22 штаммов вид не установлен (рисунок 3).
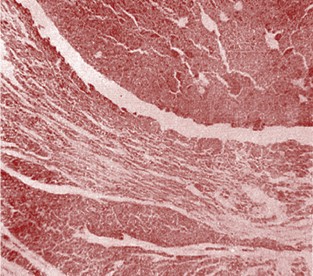
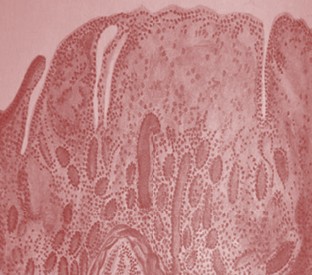
Рис. 3. Видовая идентификация нетуберкулезных микобактерий При учете результатов аллергических исследований через 48 часов у семи кроликов были получены положительные результаты. Выявлена болезненная отёчность размером 5 и более мм с повышением местной температуры. В одном случае у зараженного M. phlei показания были сомнительные. На ушной раковине у кроликов, зараженных M. phlei, отмечено покраснение округлой формы, диаметром 7-8 мм, у зараженных M. avium-intracellulare и М. qordonae-flavescens - диаметром 10-11 мм и незначительная отечность кожи. Температура тела колебалась от 39,6 до 39,9°С. При патологоанатомическом вскрытии в паренхиматозных органах выявлены узелковые поражения. Через 40 дней у 2 телят, зараженных M. avium-intracellulare и у одного, зараженного M. gordonae-flavescens, было выявлено отчетливо заметное утолщение кожной складки на месте введения ППД-туберкулина, размером 3 и более мм. У одного зараженного M. gordonae-flavescens разница в величине складки составила 2,2 мм. На 3 день после второго введения культуры у всех подопытных телят отмечен подъем температуры. У одного теленка, зараженного M. avium-intracellulare - до 40,7°С, 3 остальных - в пределах от 39,8-40,3°С. При убое телят через 3,5 месяца после заражения обнаружено следующее: у зараженных M. avium-intracellulare в легких визуализируется большое количество узелков размером с просяное зерно, казеозный лимфаденит, средостенные, предлопаточные, портальные лимфоузлы увеличены, плотной консистенции, с очагами некроза зеленоватого цвета. Содержимое творожистой консистенции легко вылущивается, соединительнотканная капсула внутри гладкая. Незначительные изменения выявлены в бронхиальных и заглоточных лимфоузлах. В печени и селезенке незначительные серые очажки некроза. Слизистая преджелудков и кишечника серо-бледного цвета, утолщена и собрана в извилистые складки, при разглаживании не расправляются. В легких у одного теленка, зараженного M. gordonae-flavescens, выявлены конгломераты гранулем в значительной фибринозной капсуле, бледно желтого цвета. У второго - признаки катарально-гнойного воспаления в начальной стадии. В средостенных и портальных лимфатических узлах у обоих телят регистрируется гиперплазия. В печени - одиночные узелки без образования конгломератов и перифокального воспаления, содержимое легко удаляется, внутренняя поверхность гладкая, блестящая. Гистологические изменения, типичные вследствие пролиферации эпителиоидных клеток, были обнаружены на месте введения культуры, в кишечнике, лимфатических узлах, легких, печени и почках. Встречались гигантские клетки типа Лангханса. В месте введения выявлено значительное количество инкапсулированных гранулем, состоящих из лимфоидных, эпителиоидных и гистиоцитарных клеток, нередко окруженных соединительнотканной капсулой, с содержанием в центре бесструктурных некротических масс (рисунок 4). В связи с пролиферацией ворсинки кишечника были увеличены в объеме, нередко деформированные и слившиеся с видом колбообразного вздутия. В слизистой оболочке среди эпителиоидных и гигантских клеток отчетливо встречались гистиоциты, фибробласты и лимфоидные клетки (нейтрофилы и эозинофилы) (рисунок 5).
Местами утолщенный подслизистый слой может являться показателем распространения процесса в глубину. У всех зараженных телят в срезах кишечника, окрашенных по Циль-Нильсену, выявились фагоцитированные в эпителиоидных и гигантских клетках нетуберкулезные микобактерии исходных культур. В солитарных фолликулах и пейеровых бляшках изменения не были выявлены. Просветы лимфатических узлов кишечника и брыжейки были заполнены эпителиоидно-клеточным пролифератом и фибрином. У одного теленка, зараженного M. gordonae-flavescens, в легких имелись незначительные периваскулярные скопления эпителиоидных клеток. В почках - групповые скопления из эпителиоидных и лимфоидных клеток. Аналогичные изменения в почках выявились и у зараженных M. avium-intracellulare, вкупе с периваскулярными скоплениями клеток в печени, где в срезах встречались клеточные узелки, располагающиеся в дольках, состоящие из эпителиоидных и гигантских клеток и фибробластов. У всех зараженных были выявлены изменения гистологического характера и в лимфатических узлах. В предлопаточных, средостенных, брыжеечных, портальных лимфатических узлах - небольшие скопления из эпителиоидных клеток. Следует отметить, что в настоящее время нетуберкулезные микобактерии в условиях Республики Дагестан изучены недостаточно по сравнению с патогенными представителями рода Mycobacterium. Поэтому для Республики полная родовая и видовая таксономическая характеристики приобретают особое значение и целесообразность в связи с постоянной напряженностью по туберкулезу человека и животных и систематическим выявлением реагирующих на ППД-туберкулин для млекопитающих животных в благополучных хозяйствах. В результате биохимического и культурального типирования культур изолированных штаммов нами была установлена принадлежность более чем в 64 % случаев к нетуберкулезным микобактериям, относящимся ко 2, 3 и 4 группам по классификации Раньона. Полученная сравнительная оценка результатов изучения видового и группового разнообразия микобактерий представляет определенный интерес, поскольку при сравнительном анализе нами отмечены изменения в количественном плане, обусловленные преобладанием нетуберкулезных микобактерий, в большей части - представителей 2 группы. По данным Р. А. Ну-ратинова (1998), в середине 90-х годов нетуберкулезные микобактерии выделялись не более, чем в 48 %, и в основном, это были представители 4 группы. Возможно, отмеченные нами изменения доминирования представителей 2 группы объясняются способностью данных микобактерий к длительной персистенции в объектах внешней среды [21]. Полученные нами данные явились базисной основой для дальнейшего динамического слежения за циркуляцией нетуберкулезных микобактерий в условиях Республики Дагестан, оптимизации противоэпизоотических мероприятии по туберкулёзу. Заключение. В условиях Республики Дагестан из объектов внешней среды и биоматериала, как из неблагополучных по туберкулезу хозяйств, так и из благополучных, но в которых животные реагировали на туберкулин, наряду с M. bovis, изолируются нетуберкулезные кислотоустойчивые микобактерии, преимущественно представители 2 и 4 групп. Полученные результаты позволяют заключить, что при экспериментальном заражении нетуберкулезные микобактерии вызывали у кроликов и телят повышение температуры и сенсибилизацию к ППД-туберкулину для млекопитающих. Патологоанатомические изменения характеризовались гиперплазией, гиперемией и появлением очагов некроза в паренхиматозных органах. Гистологические изменения имели параспецифический характер, в виде периваскулярных пролифератов из лимфоидных и эпителиоидных клеток и специфических гранулем. В области введения микобактерий наблюдались специфические гранулемы из некротических масс, гигантских, лимфоидных и эпителиоидных клеток. Таким образом, объединение полученных результатов в общедоступную базу данных обеспечит возможность для проведения расширенной биохимической и хемотаксо-номической характеристики видов нетуберкулезных микобактерий, позволяя дополнить знания о патогенезе действия их на макроорганизм. Результаты исследования на фоне эпизоотологического и эпидемиологического неблагополучия Республики Дагестан по туберкулезу могут иметь существенное значение в плане совершенствования дифференциальной диагностики. Список литературы: 1. Баратов М. О. Выявление реагирующих животных при аллергических исследованиях на туберкулез / М. О. Баратов, А. Х. Найманов // Ветеринария. - 2022. - № 1. - С. 24-27. 2. Баратов М. О. К совершенствованию диагностики туберкулеза крупного рогатого скота / М. О. Баратов // Ветеринария сегодня. - 2020. -№ 4(35). - С. 261-265. 3. Донченко А. С. Система дифференциальной диагностики неспецифических туберкулиновых реакций в благополучных хозяйствах / А. С. Донченко, М. В. Агапова, М. В. Качкин // Научное обеспечение АПК Сибири, Монголии, Казахстана, Белорусии и Башкортостана. - Абакан. - 2002. - С. 401-405. 4. Донченко А. С. Диагностика туберкулеза животных / А. С Донченко, В. Н. Кисленко, Н. А. Донченко [и др.] // Новосибирский ГАУ. -Новосибирск. -2011. - С. 247. 5. Жумаш А. С. Неспецифические туберкулиновые реакции у крупного рогатого скота в ранее оздоровленных хозяйствах / А. С. Жумаш // Вестник сельскохозяйственной науки Казахстана. - 2002. № 8. - С. 43-47. 6. Камалиева Ю. Р. Ретроспективный анализ частоты проявления неспецифических реакций на туберкулин у крупного рогатого скота в Республике Татарстан / Ю. Р. Камалиева // Сб. науч. тр. «Молодежные разработки и инновации в решении приоритетных задач АПК», 2020. - С. 278-280. 7. Колоскова Э. Л. Патоморфологические изменения у животных, зараженных разными видами микобактерий: Автореферат дисс.... канд. вет. наук, Москва, 2007. - 22 с. 8. Литвинов В. И. Нетуберкулезные микобактерии и микобактериозы / В. И. Литвинов, М. В. Макаров, М. А. Краснова // Эпидемиология, инфекционные болезни. - 2011. - № 6. -С. 4-10. 9. Мингалеев Д. Н. Новые средства и методы профилактики туберкулеза молодняка крупного рогатого скота: Автореферат дисс.. д-ра вет. наук. Казань, 2018. - 42 с. 10. Мирзоев Д. М. Частота выделения микобактерий из биоматериала от реагировавших и нереагировавших на туберкулин животных и объектов внешней среды Республики Таджикистан / Д. М. Мирзоев, Х. И. Раджабов // Проблемы ветеринарной санитарии, гигиены и экологии. - 2016. -№ 3(19). - С. 63-69. 11. Найманов А. Х. Совершенствование учета симультанной пробы с ППД-туберкулином для млекопитающих и КАМ / А. Х. Найманов, Н. Г. Толстен-ко, Е. П. Вангели [и др.] // Ветеринария. - 2022. - № 10. - С. 24-28. 12. Нуратинов Р. А. Туберкулез КРС в республиках Северного Кавказа и Калмыкии (эпизоотология, проблемы дифференциальной диагностики и меры борьбы). // Автореферат дисс.. докт. вет. наук. - Москва, 1998. - 37с. 13. Овдеенко Н. П. О патогенности атипичных микобактерий для лабораторных животных / Н. П. Овдеенко, В. И. Косенко, Н. Г. Толстенко [и др.] // Ветеринарная патология. - 2004. - Т.9: 2. - С. 150-153. 14. Оттен Т. Ф. Деструктивные поражения легочной ткани, вызванные нетуберкулезными микобактериями / Т. Ф. Оттен, Д. И. Войтова, А. В. Зайцева [и др.] // Проблемы туберкулеза и других заболеваний легких. - 2004. -№ 9. - С. 9-16. 15. Прокопьева Н. И. Нетуберкулезные (атипичные) микобактерии, выделенные от животных и людей / Н. И. Прокопьева, Г. П. Протодьяконова, Н.Г Павлов //Аграрный вестник Урала. - 2011. - № 5(84). - С. 29-30. 16. Якушева О. В. К оценке патологоанатомических изменений в диагностике туберкулеза / О. В. Якушева, В. С. Суворов, Э. Л. Колоскова // Ветеринарная патология. - 2004. - № 1-2(9). - С. 79-80. 17. Bercovier H. Mycobacterial infections in domestic and wild animals due to Mycobacterium marinum, M. fortuitum, M. chelonae, M. porcinum, M. farcinogenes, M. smegmatis, M. scrofulaceum, M. xenopi, M. kansasii, M. simiae and M. genavense / H. Bercovier, V. Vincent // Rev. Sci. Tech. - 2001; 20 (1): 265-290. DOI: 10.20506/rst.20.1.1269. 18. Betke P. Untersuchungen uber die Frischblut-Aglutination ur Diagnose der Geflugel tuberculose. Arch. exp. Vetermed. - 2010. - 19:13. 507. 19. Lee H., Park HJ., Cho S.N., Bai G.H., Kim SJ. Species identification of mycobacteria by PCR-regis-tration fragment length polymorphism of the rpoB gene // J. Clin. Microbiol. 2000., V. 38., P. 2966-2971. 20. Martin E., Kamath A.T., Triccas J.A., Britton W.J. Protection against virulent Mycobacterium avium infection follov\wing DNA vaccination with the 35-kilodalton antigen is accompanied by induction of gamma interferonsecreting CD4+ T cells // Infect. Immune.2000., V. 68., P. 3090-3096. Резюме. Целью исследования явилось определение возможностей нетуберкулезных микобактерий в сенсибилизации макроорганизма к ППД-ту-беркулину для млекопитающих и изучение патоморфологических изменений с целью совершенствования дифференциальной диагностики туберкулеза. Распространение нетуберкулезных микобактерий изучено в 53 хозяйствах. Из изолированных 275 культур 98 (35,6%) отнесены к M. bovis. В 29 (54,7%) хозяйствах, где установлен туберкулез, наряду с M. bovis выделялись и нетуберкулезные микобактерии. Нетуберкулезные микобактерии также изолированы в 24 (45,2%) благополучных по туберкулезу хозяйствах. В соответствии с групповой классификацией, из 97 культур, ко 2 группе (скотохромогенные) отнесена 51, к 3 группе (нефотохромогенные) - 3 и к 4 группе (быстрорастущие) - 43. Видовая принадлежность изучена на 57 штаммах. Из 22 культур второй группы 20 отнесены к М. qordonae- flavescens. У 2 вид не установлен. Три штамма отнесены к виду M. avium-intracellulare (3 группа по Раньону). Из 4 группы к M. smegmatis отнесены 2, M. fortuitum - 7, M. phlei - 1. Вид не установлен у 22. Для исследования аллергического состояния кроликов и телят использовались штаммы нетуберкулезных микобактерий (M. gordonae-flavescens, M. phlei, M. avium-intracellulare). Через 35 дней после заражения у кроликов и через 40 дней у телят были получены положительные результаты аллергических исследований. При патологоанатомическом вскрытии и гистологическом исследовании в паренхиматозных органах подопытных животных были выявлены отчетливо выраженные патоморфологические и гистологические изменения. Таким образом, объединение полученных результатов в общедоступную базу данных обеспечит возможность для проведения расширенной биохимической и хемотаксономической характеристики видов нетуберкулезных микобактерий, позволяя дополнить знания о патогенезе действия их на макроорганизм. Ключевые слова: нетуберкулезные микобактерии, сенсибилизация, туберкулез, ППД-туберкулин, аллергическая проба, кролики, телята, патоморфо-логические изменения, классификация по Раньону. Сведения об авторах: Баратов Магомед Омарович, доктор ветеринарных наук, главный научный сотрудник, заведующий лабораторией инфекционной патологии Прикаспийского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный аграрный научный центр Республики Дагестан, 367000, г. Махачкала, ул. Дахадаева, 88; тел. 8-928-5010948; e-mail: alama500@rambler.ru. Ответственный за переписку с редакцией: Семененко Марина Петровна, доктор ветеринарных наук, доцент, заведующая отделом фармакологии ФГБНУ «Краснодарский научный центр по зоотехнии и ветеринарии»; 350004, г. Краснодар, ул. 1-я Линия, 1; тел.: 8-918-4612663; e-mail: sever291@mail.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|