|
||||

Инфекционный ринотрахеит крупного рогатого скота: эпизоотологический надзор в животноводческих хозяйствах Московской областиУДК: 619.578.825.11 Пчельников А. В., Сафина Е. Р., Коба И. С. Федеральное государственное бюджетное образовательное Инфекционный ринотрахеит крупного рогатого скота (далее, ИРТ КРС) продолжает оставаться актуальной проблемой отечественного животноводства. Болезнь наносит животноводческим хозяйствам значительный экономический ущерб, в первую очередь связанный с недополучением молодняка, продукции животноводства (молока) и значительными затратами на проведение противоэпизоотических мероприятий. Возбудитель длительное время может персистировать в организме животных, вызывая при неблагоприятных условиях осложнения вторичной инфекцией [3, 5, 12]. Литературные и официальные статистические данные, указывающие на точное распространение возбудителя инфекционного ринотрахеита крупного рогатого скота - герпесвируса крупного рогатого скота 1 типа (Varicellovirus bovinealphal - BoHV-1) отсутствуют. В доступной литературе указано о повсеместном распространении этого возбудителя на территории Российской Федерации. В тоже время эпизоотическая ситуация в мире по этой болезни строго отслеживается Всемирной организацией охраны здоровья животных (ВОЗЖ) и ее наличие на территории страны может послужить поводом для определенных ограничений в области торговли живым скотом, племенным материалом и продуктами животноводства на мировых рынках [1, 11, 13, 14, 16, 17, 18, 19]. По данным регионализации территории Российской Федерации по заразным болезням животных по состоянию на 28 мая 2024 г. 27 субъектам страны присвоен статус «неблагополучный регион», в Волгоградской области статус Старополтавского района определен как «неблагополучный регион», остальные административные территории области определены как «регион с неопределенным статусом»; статус остальных 62 субъектов по этой болезни не определен. Вакцинация восприимчивых животных против ИРТ КРС проводится на территории 83 субъектов Российской Федерации, на территории Ивановской и Новгородской областей вакцинация не проводится 9 из 23 и 17 из 22 административных районов соответственно, а Донецкая Народная, Луганская Народная республики, Хабаровский край, Запорожская, Херсонская области и г. Севастополь обозначены, как субъекты без вакцинации. По степени риска статус определен только у 48 субъектов, как «регионы со средней степенью риска». У остальных субъектов страны этот критерий отсутствует [8]. В сложившейся ситуации эпизоотическая ситуация по ИРТ КРС на территории нашей страны остается не известной. В связи с этим актуальным представляется вопрос определения границ действующих эпизоотических очагов ИРТ КРС и территорий, на которых циркулируют полевые штаммы возбудителя этой болезни [6, 9]. В работе описаны результаты 4-летнего эпизоотологического надзора за ИРТ КРС в животноводческих хозяйствах Московской области, имеющей в соответствии с данными регионализации территории Российской Федерации неопределенный статус по этой болезни [8]. В сложившейся ситуации эпизоотическая ситуация по ИРТ КРС на территории нашей страны остается неизвестной. В связи с этим актуальным представляется вопрос определения границ действующих эпизоотических очагов ИРТ КРС и территорий, на которых циркулируют полевые штаммы возбудителя этой болезни [6, 9]. Материалы и методы исследований. На территории Московской области методом случайной выборки были определены 10 административных территорий, в которых, также случайным образом, подобраны по 2 животноводческих хозяйства. По просьбе руководства животноводческих хозяйств, все хозяйства, участвующие в программе надзора, обезличены и представлены в тексте под порядковыми номерами 1-20, присвоенными случайным образом. Эпизоотологический надзор проводился с использованием классических методов - активного серологического, вирусологического мониторинга и эпизоотологического обследования животноводческих хозяйств с интервалом 3 года. Для серологического и вирусологического мониторинга в 2019 и 2022 годах в животноводческих хозяйствах проводили отбор проб крови и смывов со слизистой оболочки носовой полости у телят в возрасте 2-6 месяцев. Отбор проб крови в 2019 году производился собственными силами из хвостовой вены с использованием закрытой системы для взятия крови. Для вирусологического мониторинга у тех же животных одновременно с пробами крови отбирались смывы со слизистой оболочки носовой полости - из каждой ноздри хлопковыми стерильными тампонами, которые затем помещали в отдельную пробирку. Материал охлаждали и доставляли в ФГБОУ ВО МГАВМиБ - МВА имени К.И. Скрябина. Отбор проб крови и смывов в 2022 году производился специалистами государственной ветеринарной службы Московской области. В учреждениях государственной ветеринарной службы специалисты отбирали сыворотку крови после формирования кровяного сгустка, пробы сыворотки замораживались. Пробы смывов замораживались в день отбора. Материал с нарочным доставляли в ФГБОУ ВО МГАВМиБ - МВА имени К.И. Скрябина. Для репродукции вируса использовалась перевиваемая культуа клеток почки теленка MDBK. Для серологических исследований использовался полевой изолят вируса ИРТ КРС «Куйбышев-2006» из коллекции ФГБНУ ФНЦ ВИЭВ РАН. Культивирование клеток почки теленка проводили в полистироловых культуральных флаконах с площадью роста 75 см2 и не-вентилируемой крышкой в условиях термостата при 37,0°С. В качестве ростовой питательной среды использовали среду Игла МЕМ (ПанЭко, Россия) с добавлением 5% сыворотки крупного рогатого скота (HyClone, США). Пересев культуры проводили 1 раз в неделю в соотношении 1:3. Заражение культуры клеток изолятом вируса ИРТ проводили общепринятым методом после формирования полного монослоя. Изоляция вируса из биологического материала. Ватные тампоны, которыми отбирались смывы, предварительно тщательно отмывали в 1 мл поддерживающей питательной среды Игла МЕМ (ПанЭко, Россия). Аликвоты разных проб объединяли, фильтровали через бактериальный фильтр с размером пор 0,22 нм и вносили на предварительно отмытый монослой клеток. После адсорбции клетками, в течение 1 часа при температуре 37,0°C, содержимое культурального флакона удаляли в 0,032%-ный (по активному хлору) раствор Хлор-Актива (ОАО «Хэппи Дэй», Россия), а во флакон вносили поддерживающую бессывороточную питательную среду Игла МЕМ (ПанЭко, Россия). Цитопатическое действие вируса учитывали визуально под малым увеличением инвертированного микроскопа ежедневно до отслоения большей части монослоя от субстрата. Вируссодержа-щую суспензию использовали в дальнейших исследованиях. Определение инфекционной активности вируса проводили по методу Рида и Менча. Реакцию нейтрализацию проводили с постоянной дозой вируса микрометодом, используя полистироловые 96-луночные культуральные планшеты в соответствии с ГОСТ 25755-91. Крупный рогатый скот. Методы лабораторной диагностики инфекционного ринотрахеита. Окончательный титр сыворотки рассчитывался по методу Кербера. Для каждого значения титра вычисляли стандартную ошибку [2]. Идентификация полевого изолята вируса ИРТ КРС проводилась молекулярно-генетическими методами. ДНК выделяли с помощью набора «РИБО-преп» (ФБУН ЦНИИЭ, Россия). ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени проводили с использованием набора РИНОКОР (ФБУН ЦНИИЭ, Россия), предназначенного для выявления ДНК вируса ИРТ КРС 1 типа в биологическом материале от животных, не вакцинированных или иммунизированных маркированными по гену гликопротеина Е (gE) вакцинами. Эпизоотологическое обследование хозяйств проводили по общепринятой методике, особое внимание обращали на молодняк с клиническими признаками заболеваний органов дыхания. Статистическая обработка результатов и построение диаграмм проводились в программе Microsoft Excel 2016, картографический анализ - в программе ArcMap10.8 (Esri, США). Результаты исследований и их обсуждение. Исследование сыворотки крови проводили в реакции нейтрализации с постоянной дозой вируса. Обобщенные результаты представлены в таблице 1. В 2019 году отбор проб крови проводился авторами самостоятельно. Большое количество хозяйств, и их значительная удаленность друг от друга (рисунок 1а), не позволили спланировать и провести двукратный отбор. В итоге пробы отбирались однократно, что не могло не сказаться на интерпретации результатов лабораторных исследований даже с учетом данных о статусе вакцинации животных и схемах использования иммунобиологических препаратов в хозяйствах. По результатам серологического мониторинга 2019 года установлена возможность циркуляции полевых изолятов возбудителя ИРТ КРС в обследованных хозяйствах, а также оценена эффективность противоэпизоотических мероприятий против этой болезни (табл. 1). Таблица 1 Обобщенные данные серологического мониторинга инфекционного ринотрахеита крупного рогатого скота в животноводческих хозяйствах Московской области
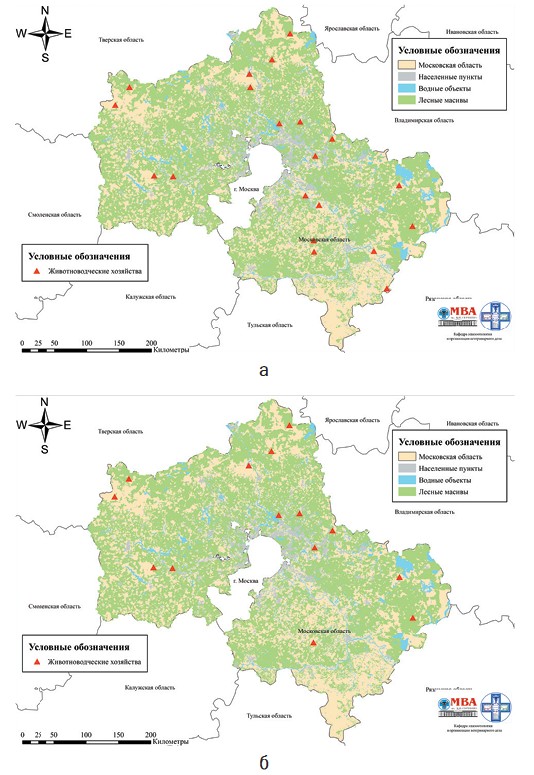
В хозяйстве 5 молодняк вакцинируется однократно в месячном возрасте живой маркированной вакциной. В последующем вакцинируются только сухостойные коровы однократно инактивированной вакциной. Из 10 проб сыворотки крови от телят в возрасте 2-4 месяца, только в одной были детектированы антитела в титре 1 log2. В хозяйстве 20 пробы крови отбирались от телят старше 2 месяцев. Вакцинация молодняка против ИРТ КРС в этом хозяйстве проводится в месячном возрасте с ревакцинацией через 1 месяц. Таким образом, все животные указанного хозяйства, от которых случайным образом отбирали пробы крови, должны были дважды быть вакцинированными против ИРТ КРС. Учитывая результаты серологических исследований, можно с уверенностью утверждать, что у молодняка КРС хозяйствах 5 и 20 нет иммунитета против ИРТ КРС, что указывает на явную неэффективность противоэпизоотических мероприятий. В хозяйстве 15 используется инактивированная вакцина, телята вакцинируются двукратно - на 34 и 45 дни жизни. Из 10 проб, отобранных в этом хозяйстве от телят в возрасте от 2-х до 5-ти месяцев, только в 3 детектированы антитела к ИРТ КРС с разбросом от 1,00 до 3,50 log2 что также может свидетельствовать о низкой эффективности противоэпизоотических мероприятий против этой болезни в хозяйстве. В хозяйствах 2, 3, 9, 10 и 14 вакцинация животных против ИРТ КРС не проводится. В соответствии с результатами серологических исследований, средний титр антител у телят в этих хозяйствах составляет 4,75±0,32, 1,33±0,41, 1,17±0,20, 1,30±0,22 и 2,39±0,48 log2, соответственно. Во всех указанных хозяйствах воспроизводство стада осуществляется за счет собственного ремонтного молодняка. Эти данные свидетельствуют о циркуляции возбудителя ИРТ среди поголовья животных в данных хозяйствах. За период проведения мероприятий по надзору животноводческие хозяйства 3, 12, 15, 16, 19, 20 были выведены из наблюдения по причине прекращения хозяйственной деятельности, либо полной смены поголовья животных в связи с реорганизацией предприятия, что сделало бы результаты надзора не объективными. В остальных животноводческих хозяйствах технология содержания, кормления, эксплуатации животных, технология получения и выращивания молодняка, а также технологические схемы противоэпизоотических мероприятий от рождения животных до их выбытия и перечень используемых иммунобиологических препаратов не изменились, за исключением хозяйства 17, в котором с 2019 га была дополнительно введена вакцинация телят первых дней жизни против ИРТ КРС с использованием живой маркированной вакцины (рисунок 1б).
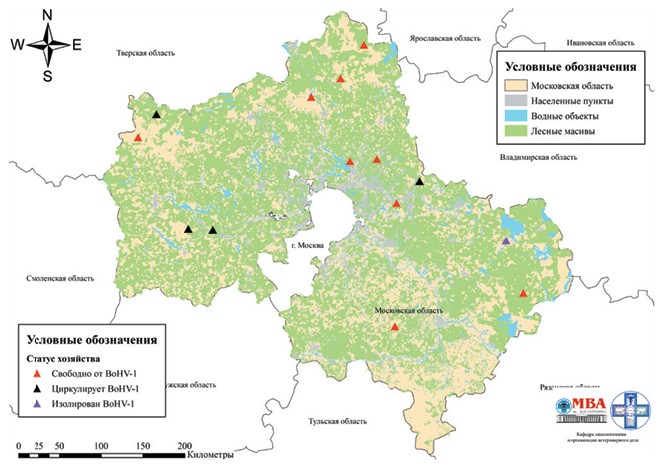
Рис. 1. Расположение животноводческих хозяйств, участвующих в программе эпизоотологического надзора, по состоянию на 2019 год (а) и 2022 год (б) По согласованию с государственной ветеринарной службой Московской области в 2022 году пробы сыворотки крови отбирались специалистами госслужбы двукратно, с интервалом в 3 недели, только в одном случае (хозяйство 10) отбор проб был произведен однократно. Как видно из таблицы 1, результаты серологических исследований подтвердили ранее сделанное заключение о циркуляции возбудителя ИРТ КРС в животноводческих хозяйствах 2 и 14, несмотря на отсутствие динамики прироста титра антител во второй пробе. Также результаты ретроспективной серологической диагностики позволили установить увеличение титра антител в два раза, не связанное с вакцинацией, при исследовании парных сывороток крови, отобранных с интервалом 21 день, у телят, содержащихся в хозяйствах 11 и 13. По результатам мониторинга 2019 года указанные хозяйства скорее всего были упущены из-за невозможности интерпретировать происхождение антител по причине однократного отбора проб и проведения вакцинации животных против ИРТ КРС. В животноводческих хозяйствах 4 и 6, также как и в 2019 году, получены отрицательные результаты серологических исследований. В указанных хозяйствах животные не вакцинируются против ИРТ КРС, что позволяет подтвердить факт отсутствия циркуляции возбудителя этой болезни в данных хозяйствах. В хозяйствах 9 и 10, по результатам мониторинга 2022 года, также получены отрицательные результаты (в хозяйстве 9 - двукратно при исследовании парных сывороток; в хозяйстве 10 - однократно). По результатам мониторинга 2019 года у телят, содержащихся в этих хозяйствах, были детектированы антитела к ИРТ КРС. В хозяйстве 9 антитела были детектированы в 4-х пробах из 10 исследованных с разбросом от 1 до 5 log2. В хозяйстве 10 -в 5-ти пробах из 10 с разбросом от 1 до 2 log2. На основании указанных результатов было сделано заключение о циркуляции в этих хозяйствах возбудителя ИРТ КРС. Обобщенные результаты серологических исследований 2019 и 2022 годов, тем не менее, не позволяют опровергнуть первоначальное заключение по этим хозяйствам. Оба указанных хозяйства являются крестьянско-фермерскими с общим поголовьем животных до 80 голов и высоким оборотом молодняка на мясо по достижению 8-10-месячного возраста. В доступной литературе мы не нашли информацию о том, что при большой скорости оборота молодняка, при условии содержания животных всех возрастных групп в одном помещении, возможна самопроизвольная санация животноводческого хозяйства от возбудителя ИРТ КРС. Скорее всего, в данных хозяйствах наблюдается персистентная инфекция у взрослых животных, с периодической реактивацией возбудителя во время отелов и единичными случаями инфицирования молодняка. Тем не менее, статус хозяйств 9 и 10 в отношении возможной циркуляции возбудителя ИРТ КРС требует дальнейшего изучения. Результаты серологического мониторинга ИРТ КРС в хозяйстве 5, проведенного в 2022 году, совпали с результатами мониторинга 2019 года. В обоих случаях антитела к BoHV-1 не детектированы ни в одной из исследованных проб, несмотря на комбинированную стратегию специфической профилактики ИРТ КРС в этом хозяйстве, основанной на применении двух видов вакцин: живой маркированной при вакцинации молодняка и инактивированной - при вакцинации стельных коров в сухостойный период. Отсутствие антител к возбудителю ИРТ КРС у телят намного старше вакцинального возраста подтверждает заключение о неэффективности противоэпизоотических мероприятий против этой болезни, сделанное по результатам мониторинга 2019 года. Главному ветеринарному врачу хозяйства даны рекомендации по усилению контроля за качеством и полнотой проведения противо-эпизоотических мероприятий. В результате вирусологических исследований объединенных проб смывов со слизистой оболочки носовой полости телят, содержащихся в хозяйствах 1-20, во всех случаях, кроме одного, не удалось изолировать BoHV-1. При исследовании объединенной пробы смывов, отобранных в хозяйстве 17, в 2022 году изолировали вирус, который на протяжении 3 последовательных пассажей характеризовался идентичной картиной ЦПД на культуре клеток MDBK. Принадлежность изолята к герпесвирусам подтвердили ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени, которую проводили с использованием набора РИНОКОР (ФБУН ЦНИИЭ, Россия), предназначенным для выявления ДНК вируса ИРТ КРС 1 типа в биологическом материале от животных, не вакцинированных или иммунизированных маркированными по гену гликопротеина Е (gE) вакцинами. Одновременно было установлено наличие в геноме изолированного вируса участка, кодирующего gE. В ходе дополнительного эпизоотического обследования хозяйства 17, проведенного по факту изоляции возбудителя ИРТ КРС, установили, что на момент проведения отбора проб оно благополучно по инфекционным и инвазионным болезням животных, противоэпизоотические мероприятия, предусмотренные планом, проводят своевременно и в полном объеме. Воспроизводство стада в хозяйстве происходит за счет собственного ремонтного молодняка, коров осеменяют отечественной спермопродукци-ей. Последний раз животных завозили в 2019 году (до начала программы надзора, описанной в настоящей статье) из трех хозяйств Московской области и одного хозяйства Рязанской областей. По данным ветеринарных сопроводительных документов, все ввезенное поголовье родилось на территории Российской Федерации. Телят содержат в скотном дворе типовой постройки групповым способом на глубокой подстилке - крупная фракция древесных опилок. Подстилку меняют несколько раз в неделю по мере загрязнения продуктами жизнедеятельности. Уровень вентиляции и освещения соответствуют зоогигиеническим требованиям. Специфическую профилактику респираторных и желудочно-кишечных болезней молодняка проводят, используя инактивированные вакцины. С 2019 года (после начала программы надзора, описанной в настоящей статье) молодняк после рождения дополнительно иммунизируют вакциной, содержащей живой аттенуированный штамм герпесвируса крупного рогатого скота 1 типа, маркированный путем делеции гена gE. Обобщая данные эпизоотологического обследования хозяйства, в котором был изолирован вирус, учитывая факт использования в хозяйстве инактивированных и живых маркированных вакцин для профилактики ИРТ КРС, а также наличие у изолированного вируса участка генома, кодирующего gE, можно предположить, что изолированный нами вирус является представителем эпизоотического изолята возбудителя инфекционного ринотрахе-ита крупного рогатого скота, циркулирующего в хозяйстве 17. Выделенный изолят был передан в лабораторию вирусологии ФГБНУ ФНЦ ВИЭВ РАН для дальнейшего изучения биологических свойств и филогенетических особенностей, по результатам которых пять участков генома, кодирующих белки myristylated tegument protein CIRC (CIRC gene), multifunctional expression regulator (UL54 gene), glycoprotein K (UL53 gene), DNA replication protein (UL52 gene) и tegument protein UL51 (UL51 gene), были депонированы в GeneBank под номерами OQ784259, OQ784260, OQ784261, OQ784262 и OQ784263 соответственно, а сам изо-лят вируса ИРТ КРС паспортирован и под рабочим названием V-49 депонирован для ответственного хранения во Всероссийскую государственную коллекцию патогенных и вакцинных штаммов микроорганизмов-возбудителей инфекционных болезней животных ФГБНУ ФНЦ ВИЭВ РАН. Заключение. Четырехлетняя программа эпизоотологического надзора за циркуляцией возбудителя ИРТ КРС на территории Московской области позволила сделать следующие выводы, в том числе согласующиеся с мнением многих авторов, изучающих эту болезнь ранее. Обобщенные результаты серологических исследований позволяют со значительной долей вероятности утверждать, что вирус ИРТ КРС циркулирует среди поголовья животных в 4 хозяйствах на территории Московской области (хозяйства 2, 11, 13 и 14). В хозяйствах 2 и 14 нами зарегистрированы высокие титры антител к вирусу ИРТ КРС во всех исследованных пробах сыворотки крови, при отсутствии вакцинации животных против этой болезни, что, в соответствии с мнением многих отечественных авторов, является признаком циркуляции возбудителя этой болезни в хозяйствах [4, 7, 10, 15]. В хозяйствах 11 и 13 установлен двукратный пророст титра антител к ИРТ КРС, не связанный с вакцинацией, при исследовании парных сывороток крови, отобранных с интервалом 21 день, что также, в соответствии с литературными данными, напрямую указывает на циркуляцию возбудителя болезни в этих хозяйствах [6, 9, 11]. Противоречивые результаты серологического мониторинга 2019 и 2022 гг. требуют дальнейшего изучения эпизоотической ситуации в хозяйствах 9 и 10. При вирусологических исследованиях в хозяйстве 17 изолирован эпизоотический изолят ИРТ КРС, депонированный для ответственного хранения во Всероссийскую государственную коллекцию патогенных и вакцинных штаммов микроорганизмов-возбудителей инфекционных болезней животных ФГБНУ ФНЦ ВИЭВ РАН. Подробный анализ результатов эпизоотологического надзора позволил установить, что отхождение от схем использования биопрепаратов, рекомендованных их производителями, приводит к значительному снижению эффективности противоэпи-зоотических мероприятий при ИРТ КРС. Отсутствие контроля со стороны главного ветеринарного врача за полнотой и качеством проведения противоэпизоотических мероприятий приводит к абсолютной неэффективности противоэпизоотических мероприятий. Картирование результатов эпизоотологического надзора позволило установить, что возбудитель ИРТ КРС преимущественно циркулирует в хозяйствах, расположенных на западе и на востоке Московской области (рисунок 2).
Рис. 2. Результаты эпизоотологического надзора в животноводческих хозяйствах Московской области Список литературы: 1. Белоусова, Р. В. Серологический мониторинг вирусных пневмоэнтеритов крупного рогатого скота. / Р. В. Белоусова, М. С. Калмыкова, Е. И. Ярыгина // Вопросы физико-химической биологии в ветеринарии. Сборник научных трудов. ФГБОУ ВПО МГАВМиБ им. К.И. Скрябина. 2012. С. 153-157. 2. ГОСТ 25755-91. Крупный рогатый скот. Методы лабораторной диагностики инфекционного ринотрахеита. Введ. 1993-01-01. М.: Комитет стандартизации и метрологии СССР, 1993. 21 с. 3. Донник, И. М. Острые респираторные заболевания крупного рогатого скота и проблемы профилактики в современных условиях промышленного производства / И. М. Донник, О. Г. Петрова, С. А. Марковская // Аграрный вестник Урала. 2013. № 10 (116). С. 25-27. 4. Красочко, П. П. Иммунный ответ у коров при иммунизации против инфекционного ринотрахеита в зависимости от серологического статуса животных в стадах / П. П. Красочко, Е. И. Ярыгина, Я. П. Яромчик // 2016. С. 290-294. 5. Мищенко, В. А., Состояние проблемы респираторных болезней молодняка крупного рогатого скота / В. А. Мищенко, Д. К. Павлов, В. В. Думова // Ветеринария Кубани. 2008. № 5. С. 6-7. 6. Мищенко, В. А. Проблема борьбы и профилактики инфекционного ринотрахеита - инфекционного пустулезного вульвовагинита крупного рогатого скота / В. А. Мищенко, Г. А. Джаилиди, О. Ю. Черных // Ветеринария Кубани. 2012. № 6. С. 3-5. 7. Мищенко, В. А. Проблема респираторной патологии новорожденных телят / В. А. Мищенко, А. В. Мищенко, О. Ю. Черных // Ветеринария Кубани. 2013. № 6. С. 19-20. 8. Статусы регионов по заразным болезням животных. [Электронный ресурс]. - Режим доступа: https://cerberus.vetrf.ru/cerberus/ regionalization/pub 9. Строганова, И. Я. Закономерности распространения инфекционного ринотрахеита крупного рогатого скота в Восточной Сибири / И. Я. Строганова // Вестник КрасГАУ. 2011. № 6. С. 118-120. 10. Сюрин, В. Н. Вирусные болезни животных / В. Н. Сюрин, А. Я. Самуйленко, Б. В. Соловьев // ВНИТИБП. 1998. 928 с. 11. Шуляк, А. Ф. Характеристика изолятов BHV-1, выделенных от племенных быков / А. Ф. Шуляк, Г. Н. Величко // Молекулярная диагностика. 2017. Т. 2. С. 380. 12. Юров, К. П. Контроль и пути оздоровления скота племенных хозяйств и племенных предприятий от инфекционного ринотрахеита и вирусной диареи / К. П. Юров, М. И. Гулюкин // Российская сельскохозяйственная наука. 2018. № 1. С. 59-63. 13. Юров, К. П. Распространение инфекционного ринотрахеита и вирусной диареи - болезни слизистых оболочек крупного рогатого скота в различных регионах России / К. П. Юров, А. Ф. Щуляк, О. Г. Петрова // Тр. ВИЭВ. 2003. Т. 73. С. 22-25. 14. Юров, К. П. Герпесвирусы - возбудители массовых заболеваний крупного рогатого скота / К. П. Юров, А. Ф. Щуляк // Ветеринария. 1998. № 11. С. 10-12 15. Ярыгина, Е. И. Лабораторная диагностика и профилактика инфекционного ринотрахеита/ инфекционного пустулезного вульвовагинита крупного рогатого скота / Е. И. Ярыгина, М. С. Калмыкова, И. В. Третьякова // Методические рекомендации. ФГБОУ ВО МГАВМиБ - МВА имена К.И. Скрябина. 2018. 15 с. 16. Carbonero A., Saa L.R., Jara D.V. et al. Seroprevalence and risk factors associated to Bovine Herpesvirus 1 (BHV-1) infection in non-vaccinated dairy and purpose cattle herds in Ecuador // Preventive Veterinary Medicine. 2011. 100. Р. 84-88. 17. Kerli Raaperi, Toomas Orro, Arvo Viltrop. Epidemiology and control of bovine herpesvirus 1 infection in Europe // The Veterinary Journal. 2014. 201. P. 249-256. 18. Suman Biswas, Samiran Bandyopadhyay, Emesh Dimri et al. Bovine herpesvirus-1 (BHV-1) - emerging concern in livestock: a revisit to its biology, epidemiology, diagnosis, and prophylaxis // Veterinary Quartly. 2013. Vol. 33. No. 2. P. 68-81. 19. World Organization of Animal Health (OlE). https://www.woah.org/en/home/ Резюме. В настоящее время, несмотря на все предпринимаемые Минсельхозом России и Россельхознадзором меры по регионализации территории Российской Федерации по заразным болезням животных, статусы субъектов по многим из них до сих пор не определены. По состоянию на 28 мая 2024 года для 62 субъектов страны не определен статус по инфекционному ринотрахеиту крупного рогатого скота, в том числе для Московской области. В данной работе представлены результаты 4-летнего эпизоотологического надзора за ИРТ КРС на территории указанного субъекта Российской Федерации. В итоге были установлены животноводческие хозяйства, в которых циркулируют полевые штаммы герпесвируса крупного рогатого скота 1 типа - возбудителя ИРТ КРС, расположенные на востоке и западе Московской области, изолирован полевой вариант вируса ИРТ КРС, изучено влияние качества и полноты проведения проти-воэпизоотических мероприятий на эпизоотическую ситуацию по ИРТ КРС в хозяйствах. Ключевые слова: крупный рогатый скот, герпесвирус, инфекционный ринотрахеит, полевой штамм, мониторинг, эпизоотологический надзор, эпизоотический статус, регионализация. Сведения об авторах: Коба Игорь Сергеевич, доктор ветеринарных наук, заведующий кафедрой эпизоотологии и организации ветеринарного дела ФГБОУ ВО «Московская государственная академия ветеринарной медицины и биотехнологии - МВА имени К. И. Скрябина»; 109472, г. Москва, ул. Академика Скрябина, 23; e-mail: epizootology@mgavm.ru. Сафина Елизавета Рашитовна, аспирант ФГБОУ ВО «Московская государственная академия ветеринарной медицины и биотехнологии - МВА имени К. И. Скрябина»; 109472, г. Москва, ул. Академика Скрябина, 23. Черных Олег Юрьевич, профессор, доктор ветеринарных наук, профессор кафедры микробиологии, эпизоотологии и вирусологии ФГБОУ ВО «Кубанский государственный аграрный университет имени И. Т. Трубилина»; 350044, г. Краснодар, ул. Калинина, 13; e-mail: gukkvl50@kubanvet.ru. Кривонос Роман Анатольевич, кандидат ветеринарных наук, доцент кафедры паразитологии, ветсанэкспертизы и зоогигиены ФГБОУ ВО «Кубанский государственный аграрный университет имени И. Т. Трубилина»; 350044, г. Краснодар, ул. Калинина, 13. Ответственный за переписку с редакцией: Пчельников Александр Владимирович, кандидат ветеринарных наук, доцент кафедры эпизоотологии и организации ветеринарного дела ФГБОУ ВО «Московская государственная академия ветеринарной медицины и биотехнологии - МВА имени К. И. Скрябина»; 109472, г. Москва, ул. Академика Скрябина, 23; e-mail: vetdr-mom@list.ru.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|