|
||||

Экспрессия генов иммунитета в красном костном мозге цыплят кросса Ломан Браун под влиянием вакцинации и заражения вирусом инфекционной анемии цыплятУДК 636.5.034:615.371 Тарлавин Н.В., Веретенников В.В., Джавадов Э.Д., Красков Д.А. Федеральное государственное бюджетное Современное промышленное птицеводство в России занимает лидирующие позиции по получению прибыли и важности в агропромышленной сфере. Эти результаты складываются из таких важных показателей как: низкая конверсия корма, высокая окупаемость различных затрат на ветеринарно-санитарные и зоотехнические мероприятия, а также большой спрос у общества, как на яичную, так и на мясную продукцию. Для того, чтобы получать наибольшую прибыль - наиболее важно соблюдать все ветеринарно-санитарные мероприятия, в частности меры специфической и неспецифической профилактики инфекционных болезней. Из всех групп инфекционных болезней птиц наиболее серьезный ущерб причиняют иммунодепрессивные болезни, к ним относят - инфекционную бурсальную болезнь, болезнь Марека, синдром спленомегалии и гепатомегалии кур (малоизученная болезнь), а также инфекционную анемию цыплят [2]. Инфекционная анемия цыплят (далее, ИАЦ) является высококонтагиозной и иммуносупрессивной болезнью, вызывающей острую форму у цыплят и субклиническое течение у кур. Возбудителем является одноцепочечный, непокрытый оболочкой ДНК-вирус из семейства Circoviridae, рода Gyrovirus [1]. При попадании в организм птицы, вирус разносится кровотоком, поражая органы центральной иммунной системы (красный костный мозг, тимус, фабрициеву сумку) и вызывая иммунодепрессию. В настоящее время известно, что организм реагирует на воздействия внешней среды посредством активации процессов экспрессии генов в клетках и тканях различных органов, в ходе чего образуется матричная РНК, комплементарная ДНК экспрессирующихся генов. Регулирование экспрессии генов позволяет клеткам контролировать свою собственную структуру и функцию и является основой клеточной дифференцировки, морфогенеза и адаптации. Изучение экспрессии генов иммунитета сельскохозяйственных птиц позволяет в реальном времени отслеживать процесс формирования белков, которым организм отвечает на воздействия со стороны окружающей среды [3]. Данная работа позволяет изучить характер экспрессии генов IL8L2, PTGS2, IRF7, и AvBD-11, возникающей в ответ на введение в организм кур-несушек импортной зарубежной вакцины против инфекционной анемии цыплят, а также полевого патогенного вируса инфекционной анемии цыплят, выделенного с отечественной птицефабрики во время вспышки заболевания. Материалы и методы исследования. Анализ уровня относительной экспрессии генов иммунитета проводили методом ПЦР в реальном времени (qPCR) на базе Научно-консультационного диагностического центра по птицеводству ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины». Материалом для исследования служили цыплята породы Ломан Браун 95-дневного возраста. Содержание и вакцинация птиц проводились на базе вивариев университета. Заражение было осуществлено путем внутримышечного введения гомогената внутренних органов цыплят, павших от инфекционной анемии с подтверждением молекулярно-генетическими методами. Образцы тканей красного костного мозга были получены на 102 сутки жизни несушек. Вакцинация осуществлялась при помощи вакцины Нобилис® CAV P4 производства MSD Animal Health. Вакцину вводили внутримышечно (в грудную группу мышц) в объеме 0,2 мл. Для разведения использовали растворитель DILAVIA (1x200ml) (для CAV P4) в соответствии с инструкцией производителя. Общая РНК из образцов была выделена с использованием набора ExtractRNA (Евроген) в соответствии с инструкциями производителя. Ткань разрезали на мелкие кусочки (<5 мм длиной) и измельчали до тонкого порошка с помощью пестика и ступки. Ткани измельчались и гомогенизировались с добавлением раствора монофазного водного раствора фенола и гуанидин-изотиоцианата. С использованием набора «MMLV RT kit для синтеза кДНК» (Евроген) проводили реакцию обратной транскрипции для получения кДНК с использованием матрицы РНК. Программа амплификатора: подготовка в течение 3 мин при 60°С, обратная транскрипция в течение 30 мин при 37°C, инактивация в течение 2 мин при 70°С. Реакцию амплификации с генными праймерами проводили с использованием набора «Готовая смесь для ПЦР 5X qPCRmix-HS» (Евроген) в соответствии с протоколом производителя. Расчет относительной экспрессии был произведен при помощи метода 2 -AACt. В качестве референсного гена был выбран ген белка b-Actin. Список праймеров приведен в таблице 1. Таблица 1 Список праймеров для исследования генов
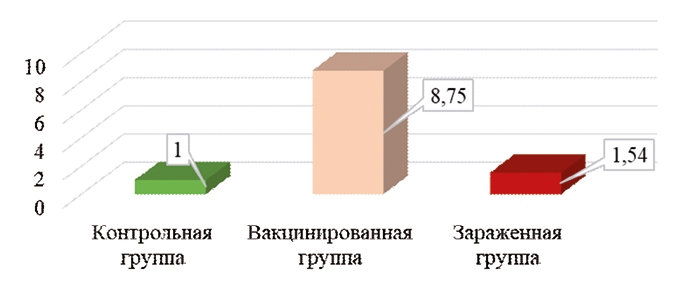
Результаты исследований и их обсуждение. Сравнение характера экспрессии основных иммунных генов в клетках красного костного мозга цыплят дает представление об иммунном ответе, происходящем в иммунных органах цыплят при проникновении в них вакцинных и патогенных штаммов вируса инфекционной анемии [5]. Рисунок 1 демонстрирует характер взаимодействия клеток красного костного мозга с вакцинным и полевым штаммами вируса инфекционной анемии цыплят. В целом, данный ген активно включается в работу при инфицировании организма птицы вирусными агентами [5]. В том числе, известна активность данного гена при инфицировании птиц вирусом болезни Марека, и при формировании характерных для данной болезни опухолей, о чем сообщает Nazerian с соавторами [8]. Также по сообщениям Swinkels, данный ген активно экспрессируется, как компонент противопаразитарного иммунного ответа [9]. Данные исследования подтверждают роль пептида, синтезируемого геном IL8L2, как воспалительного цитокина. Из проведенных исследований видно, что экспрессия гена IL8L2 в клетках красного костного мозга вакцинированных птиц существенно превышала как уровень контроля (в 8,75 раза), так и уровень экспрессии в том же типе ткани у птиц, зараженных патогенным штаммом вируса инфекционной анемии цыплят (в 5,7 раза).
Рис. 1. Экспрессия гена IL8L2 в тканях красного костного мозга цыплят кросса Ломан Браун на 7 сутки после вакцинации и заражения
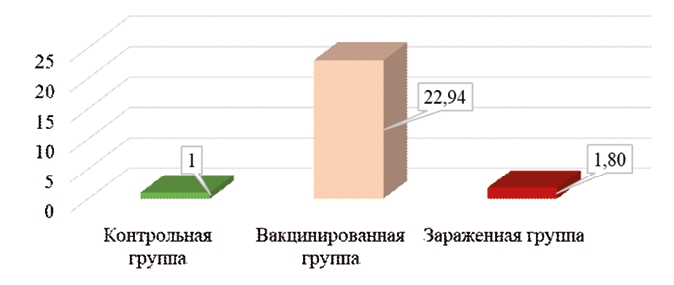
Рис. 2. Экспрессия гена PTGS2 в тканях красного костного мозга цыплят кросса Ломан Браун на 7 сутки после вакцинации и заражения При анализе характера экспрессии гена PTGS2 в вакцинированной и зараженной группах цыплят кросса Ломан Браун (рисунок 2) наблюдается сходная картина с экспрессией гена IL8L2. В целом, это может быть связано с тем, что ген PTGS2 также является участником воспалительных реакций организма птицы, кодируя синтез циклооксигеназы-2, а ингибирование ее синтеза, в свою очередь, ведет к резкому ингибированию воспалительных реакций, о чем сообщает Wang с соавторами [10]. Также, Kamble с соавторами сообщает о том, что вирус болезни Марека in vitro и in vivo индуцирует активацию циклооксигеназы-2 за счет гена PTGS2, что является важным для вирус-инду-цированной иммуносупрессии при данной болезни [7]. Наши исследования говорят о том, что при вакцинации кур кросса Ломан Браун вакциной Нобилис® CAV P4 экспрессия данного гена увеличивается в 22,9 раза относительно уровня контроля, а в группе, зараженной патогенным штаммом вируса инфекционной анемии цыплят, наблюдается увеличение экспрессии гена PTGS2 в 1,8 раза. Данные результаты, вкупе с результатами экспрессии гена IL8L2, говорят о том, что вакцинный вирус стимулировал существенно большую выработку воспалительных цитокинов по сравнению с полевым вирусом инфекционной анемии цыплят. Также это может наводить на мысль о способности полевого штамма вируса избегать воздействия белков, синтезируемых данными генами. И, наконец, это может говорить о том, что вирус инфекционной анемии цыплят, являющийся патогенным и иммунодепрессивным вирусом, способен подавлять синтез воспалительных цитокинов в своих клетках-мишенях, таким образом делая свою репликацию в данных клетках более комфортной и продуктивной.
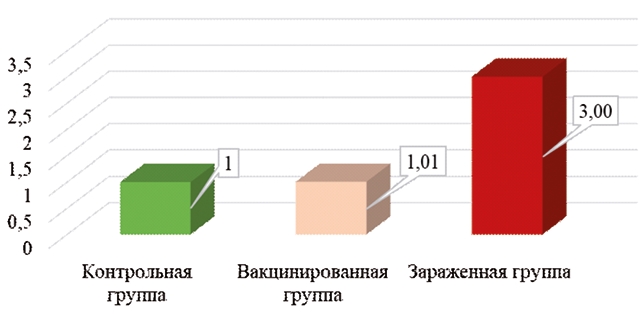
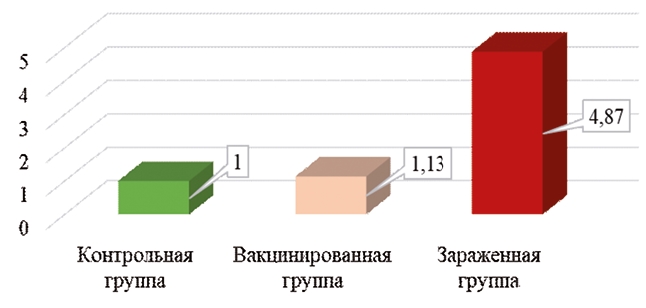
Рис. 3. Экспрессия гена IRF7 в тканях красного костного мозга цыплят кросса Ломан Браун на 7 сутки после вакцинации и заражения При анализе экспрессии гена IRF7 (рисунок 3) наблюдаются интересные данные. Основная задача данного гена заключается в активации транскрипции вирусноиндуцированных клеточных генов [4]. Например, по сообщениям Wang с соавторами, он участвует в иммунных процессах при заражении птиц вирусом лейкоза, еще одной вирусной иммунодепрессивной болезнью, поражающей красный костный мозг [11]. По данным наших исследований, под влиянием вакцины Ноби-лис® CAV P4 экспрессия данного гена в клетках красного костного мозга у цыплят была идентичной показателям уровня контроля. В зараженной группе экспрессия данного гена превосходила уровень контроля в 3 раза. Это может служить демонстрацией того, что клетки красного костного мозга цыплят чувствовали угрозу со стороны полевого штамма вируса и пытались выработать противовирусные компоненты защиты. При изучении экспрессии гена AvBD-11 в тканях красного костного мозга цыплят кросса Ломан Браун на 7 сутки после вакцинации и заражения видна картина, схожая с картиной экспрессии гена IRF7. Экспрессия гена AvBD-11 в вакцинированной группе практически не превышала уровень контроля, тогда как в зараженной группе данный ген экспрессировался в 4,9 раза сильнее относительно контрольной группы (рисунок 4). Ген AvBD-11 также, как и ген IRF7 экспрессируется при состояниях инфицирования организма бактериальными и вирусными агентами, о чем сообщает Derache с соавторами [6]. Таким образом, патогенный вирус инфекционной анемии цыплят встречал существенное противодействие в организме зараженных цыплят, и вызывал активное формирование местного иммунного ответа в клетках красного костного мозга.
Рис. 4. Экспрессия гена AvBD-11 в тканях красного костного мозга цыплят кросса Ломан Браун на 7 сутки после вакцинации и заражения Заключение. Из проведенных исследований был сделан ряд выводов, касающихся ярко выраженной экспрессии важнейших генов иммунитета сельскохозяйственной птицы под влиянием вакцинации живой вакциной Нобилис® CAV P4, а также заражения вирусом инфекционной анемии цыплят. Из полученных результатов можно сделать вывод, что при вакцинации данной вакциной сильно возрастает экспрессия генов, кодирующих синтез воспалительных цитокинов (IL8L2 и PTGS2). Это связано с пролонгированным действием живого вакцинного вируса на клетки-мишени. В организме зараженной птицы экспрессия данных генов была практически подавлена патогенным иммунодепрессивным вирусом. В свою очередь, гены, кодирующие синтез пептидов, играющих существенную роль при вирусных, бактериальных и прочих инфекциях (IRF7 и AvBD-11), в красном костном мозге вакцинированной группы практически не экспрессировались ввиду незначительной опасности, которую представляет собой живой вакцинный вирус. Экспрессия данных генов при инфицировании патогенным штаммом вируса инфекционной анемии превосходила уровень контроля в разы, что связывается с разрушительным воздействием полевого патогенного вируса на клетки красного костного мозга. Исследование выполнено за счет гранта Российского научного фонда № 22-26-20084 (https://rscf.ru/project/22-26-20084/). Список литературы: 1. Алиев А.С. Вирусная анемия - скрытая угроза промышленному птицеводству// Птица и птицепродукты. 2012. № 6. С. 30-33. 2. Джавадов Э.Д., Веретенников В.В., Тарлавин Н.В., Красков Д.А. Инфекционная анемия цыплят - современное представление о болезни// Эффективное животноводство. 2022. № 4 (179). С. 60-61. 3. Методические рекомендации по использованию современных биотенологий для оценки экспрессии генов, связанных с продуктивностью и устойчивостью птицы к неблагоприятным факторам/ И.И. Кочиш, М.Н. Романов, Г.Ю. Лаптев и др.// Сельскохозяйственные технологии. 2019. 112 с. 4. Экспрессия гена IRF7 в тканях фабрициевой сумки кур-несушек и цыплят-бройлеров при вакцинации иммунокомплексной вакциной из штамма «ВНИВИП»/ Н.В. Тарлавин, В.В. Веретенников, Э.Д. Джавадов и др.// Материалы 3-й Международной научно-практической конференции «Молекулярногенетические технологии анализа экспрессии генов продуктивности и устойчивости к заболеваниям животных». Сельскохозяйственные технологии. 2021. С. 264-271. 5. Экспрессия генов IL-6 и IL8L2 в тканях фабрициевой сумки кур-несушек при вакцинации иммунокомплексной вакциной из штамма «ВНИВИП»/ Н.В. Тарлавин, Э.Д. Джавадов, О.В. Козыренко и др.// Птица и птицепродукты. 2021. № 6. С. 42-44. 6. Primary structure and antibacterial activity of chicken bone marrow-derived beta-defensins/ C. Derache, V. Labas, V. Aucagne, H. Meudal, C. Landon, A.F. Delmas, T. Magallon, A.C. Lalmanach// Antimicrob Agents Chemother. 2009. 53 (11): 4647-55. 7. Marek Disease Virus Modulates T Cell Proliferation via Activation of Cyclooxygenase 2-Dependent Prostaglandin E2/ N. Kamble, A. Gurung, B.B. Kaufer, Pathan A.A., Behboudi S. Front Immunol. 2021, 12:801781. 8. Nazerian K., Witter R.L. Properties of a chicken lymphoblastoid cell line from Marek disease tumor. J Natl Cancer Inst. 1975. 54 (2): 453-458. 9. Swinkels W.J., Post J., Cornelissen J.B. et al. Immune responses in Eimeria acervulina infected one-day-old broilers compared to amount of Eimeria in the duodenum, measured by real-time PCR. Vet Parasitol. 2006. 138 (3-4): 223-233. 10. Wang Q., He Y., Shen Y. et al. Vitamin D inhibits COX-2 expression and inflammatory response by targeting thioesterase superfamily member 4. J Biol Chem. 2014. 289 (17): 11681-11694. 11. Wang Y., Yang F., Yin H. et al. Chicken interferon regulatory factor 7 (IRF7) can control ALV-J virus infection by triggering type I interferon production through affecting genes related with innate immune signaling pathway. Dev Comp Immunol. 2021. 119:104026. Резюме. Инфекционная анемия цыплят - опасная иммунодепрессивная вирусная болезнь сельскохозяйственной птицы. Традиционно от болезни страдают как яичные, так и бройлерные отечественные птицефабрики. Данная болезнь, вызываемая ДНК-содержащим вирусом семейства Circoviridae, поражает основные иммунокомпетентные органы цыплят (красный костный мозг, тимус, фабрициеву сумку, селезенку), вызывая тяжелое иммуносупрессивное состояние у птицы, ведущее к смерти от вторично патогенной микрофлоры. Также данный вирус при инфицировании птицы вызывает существенное изменение экспрессии основных генов иммунитета (IL8L2, PTGS2, IRF7 и AvBD-11). На базе Научно-консультационного диагностического центра по птицеводству Санкт-Петербургского государственного университета ветеринарной медицины был поставлен опыт на цыплятах кросса Ломан Браун 95-дневного возраста по заражению полевым вирусом инфекционной анемии цыплят и вакцинации вакциной Нобилис® CAV P4 производства MSD Animal Health. Исходя из полученных результатов, был сделан вывод, что патогенный вирус инфекционной анемии способен подавлять экспрессию воспалительных цитокинов и циклооксигеназы-2 в клетках красного костного мозга зараженных цыплят по сравнению с вакцинным вирусом за счет более активного воздействия на клетки красного костного мозга, тогда как вакцина Нобилис® CAV P4 обладает пролонгированным действием в организме птиц. Также клетки красного костного мозга отвечают на вирусное вмешательство экспрессией генов IRF7 и AvBD-11 и синтезом противовирусных факторов защиты неодинаково, в зависимости от характера проникшего вируса. Были получены данные, что вакцинный вирус способен не вызывать активации экспрессии гена IRF7 в клетках красного костного мозга у вакцинированной птицы. Ключевые слова: птицеводство, эпизоотология, экспрессия генов, заражение, инфекционная анемия цыплят, гены иммунного ответа птиц, регуляторный фактор интерферона-7, простагландинэндопероксидсинтаза-2, интерлейкин, бета-дефензин. Сведения об авторах: Веретенников Владислав Валерьевич, ассистент кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8778769; e-mail: vlad.veretennikov.96@mail.ru. Джавадов Эдуард Джавадович, доктор ветеринарных наук, профессор кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-9666774; e-mail: vnivip1@mail.ru. Красков Дмитрий Андреевич, студент факультета ветеринарной медицины ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-4152266; e-mail: kraskov-00@bk.ru. Ответственный за переписку с редакцией: Тарлавин Николай Владимирович, кандидат ветеринарных наук, ассистент кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8430353; e-mail: tarlav1995@bk.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|