|
||||

Динамика антимикробной резистентности энтерококков на молочно-товарной фермеУДК 619:636.2:579:615.07 Кривоногова А.С., Исаева А.Г., Соколова О.В., Безбородова Н.А., Моисеева К.В. Федеральное государственное Стремительный рост резистентности бактерий к антимикробным препаратам (далее, АМП) обусловлен влиянием различных факторов - генетических, экологических, ятрогенных, гигиенических. В настоящее время известно, что устойчивость к антибиотикам распространяется среди бактерий горизонтально, путем переноса генов антибиотикорезистентности (далее, ARG). Картирование трансфера генов, ассоциированных с устойчивостью к АМП, через геномы микроорганизмов показало, одним из ключевых условий формирования горизонтального переноса являются смежные и пересекающиеся экологические среды обитания микроорганизмов [5, 10]. Формирование обширной, связанной с человеком сети обмена генами резистентности, осуществляется в основном под влиянием экологии микроорганизмов, а не их географии или филогении. Обмен генами ARG происходит в основном между изолятами из экологически сходных сред и общих экологических ниш, при этом наиболее интенсивна передача между бактериями, населяющими одни и те же локусы макроорганизма и имеющими схожий метаболизм [10]. Поскольку микробиомы сельскохозяйственных животных экологически ассоциированы с микробиомами человека, населены бактериями, общими для человека и животных, то развитие резистентности к АМП в животноводстве закономерно вносит существенный вклад в эволюцию резистома - глобального резервуара генов резистентности, которые придают устойчивость к антибиотикам при экспрессии в восприимчивом хозяине [5, 7]. Механизм получения генов устойчивости от неродительских линий (горизонтальный перенос генов) эволюционно обеспечивает способности бактерий к высокой адаптации к меняющимся условиям среды за счет реализации генетической вариабиль-ности. Быстрый доступ к генетическим инновациям позволяет бактериальной клетке изменять метаболизм ксенобиотиков во временных пределах её существования, а также способствует дальнейшему распространению устойчивости в микробиоме [10]. Этот механизм, например, привел к появлению популяций ванкомицин-резистентных энтерококков и энтеробактерий, продуцирующих бета-лактамазы.
Несовершенство протоколов антибиотикотерапии, использование АМП в нетерапевтических и профилактических целях (для стимуляции роста и продуктивности животных) привели к значительной контаминации животноводческих микробиомов генами резистентности. При этом передача мобильных элементов ARG между сельскохозяйственными животными и человеком происходит под действием филогенетических и экологических факторов, что означает интенсивный внутривидовой и межвидовой обмен генами резистентности среди обитающих на фермах бактерий, общих для человека и животных [7, 8]. Широкое использование антибиотиков человеком и в сельском хозяйстве привело к элиминации менее успешных бактерий и к заполнению их ниш обитания новыми, более приспособленными видами. Так, происходит колонизация устойчивыми изолятами E. faecalis и E. faecium, новых, ранее недоступных для них сред макроорганизма животных и человека, при этом возникают штаммы энтерококков, у которых почти одинаково отсутствует защита CRISPR. Как следствие, эти штаммы интенсивно наполняются плазмидами и другими компонентами мобильного резистома, придающими устойчивость к ксенобиотикам и высокую вирулентность [7, 11].
Контаминация животноводческих микробиомов агентами резистентности требует неотложных мер, направленных на её предотвращение. В настоящее время отсутствует системный подход к решению проблемы антимикробной резистентности (далее, АМР) в животноводстве, и по-прежнему остро стоит вопрос с нетерапевтическим использованием антибиотиков в качестве кормовых добавок. Первостепенной задачей для борьбы с антимикробной резистентностью на молочно-товарных фермах является контроль миграции агентов АМР (генов и устойчивых микроорганизмов) внутри животноводческих микробиомов. Поскольку скрининг большого количества геномов бактерий, выделенных из различных точек на ферме, зачастую недоступен для предприятия из-за его высокой цены и нехватки лабораторных средств, целесообразно проводить анализ профилей фенотипической антимикробной устойчивости. Методика скрининга фенотипической АМР энтеробактерий и энтерококков на молочно-товарной ферме включает в себя отбор проб навоза и подстилки на разных хозяйственных и технологических участках с последующим определением чувствительности к антибиотикам диско-диффузионным способом, который является наиболее универсальным, а также технически и экономически доступным [8, 9].
Целью исследования являлось проведение анализа изменения чувствительности к антимикробным препаратам изолятов энтерококков, выделенных на молочно-товарной ферме в течение трёхлетнего периода. В рамках работ было изучено количественное распределение изолятов Enterococcus faecium и Enterococcus faecalis по чувствительности к 5 препаратам - ванкомицину, меропенему, энрофлок-сацину, ампициллину, защищенному амоксициллину в 2018, 2019, 2020 гг., и проанализирована динамика изменения резистентности энтерококков на молочно-товарной ферме.
Материалы и методы исследований. Исследования выполнены в рамках государственного задания Министерства науки и высшего образования Российской Федерации по теме № 0532-2021-0004 «Разработка методологических подходов к мониторингу, контролю и сдерживанию антибиотикорезистентности оппортунистических микроорганизмов в животноводстве». Проводили исследование фенотипической антимикробной устойчивости Enterococcus spp. микробиома молочно-товарной фермы в трёхлетней динамике. Для бактериологических исследований отбирали пробы в 25-28 точках на разных технологических участках фермы: подстилку, навоз от животных, навоз из буртов. Отбор проводили в течение трёх лет (2018-2020), всего отобрано 80 проб. Микроорганизмы культивировали на питательных средах, идентифицировали, анализировали профили антибиотико-резистентности выделенных изолятов энтерококков диско-диффузионным методом, методом лунок, определяли МПК по стандартным микробиологическим методикам [1, 2, 3, 6]. После культивирования материала из каждой пробы выбирали по 2-3 изолята E. faecium и E. faecalis для дальнейших исследований фенотипической антибиоти-кочувствительности. Всего было проанализировано 296 изолятов, из них 152 E. faecium и 144 E. faecalis. При работе диско-диффузионным и луночным методами изоляты разделяли на группы (чувствительные, промежуточные и резистентные) в соответствии с пограничными значениями (breakpoint), установленными Европейским комитетом по определению чувствительности к антибиотикам (EUCAST) и Национальным стандартом [1, 2]. В основной цикл исследований фенотипической чувствительности изолятов к антимикробным препаратам входили: ампициллин, амоксициллин, амоксициллин + клавулановая кислота (амоксиклав), ванкомицин, меропенем, энрофлоксацин. Выбор препаратов был обусловлен отсутствием у энтерококков механизмов природной резистентности [3], а также историей применения АМП на обследованном предприятии. Полученные результаты анализировали с использованием статистических методов (Statistica 10).
Результаты исследований и их обсуждение. Было установлено, что среди всех выделенных за время исследований изолятов Enterococcus spp. подавляющее большинство составляли E. faecalis и E. faecium. В связи с тем, что изоляты E. durans и E. gallinarum были обнаружены в единичном количестве, и при этом не имели резистентности к анализируемым антимикробным препаратам, их при обработке данных не учитывали.
В 2018 году было исследовано 27 проб: из них ассоциация изоля-тов E.faecium + E. faecalis выделена в 15 пробах, только E. faecium - в 5, только E. faecalis в 7 пробах. Для анализа на фенотипическую антибиотикочувствительность взято 50 изолятов E. faecium и 50 изолятов E. faecalis.
В 2019 году из 25 проб ассоциации изолятов энтерококков выделили в 17, только E. faecium был обнаружен в 5 пробах, только E. faecalis - в 3; на анализ отобрано 46 изолятов E. faecium и 45 -E. faecalis.
В 2020 всего исследовано 28 проб, из них ассоциации изолятов обнаружили в 18 случаях, только E. faecium - в 7, только E. faecalis - в 3 пробах. На определение чувствительности к АМП было отобрано 56 изолятов E. faecium и 49 - E. faecalis.
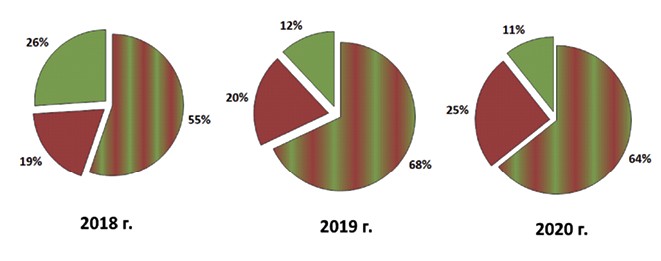
За все три года наблюдений в соотношении изолятов энтерококков отмечали преобладание микробных ассоциаций E. faecium и E. faecalis, из меньшей части проб (32-45%) выделяли изоляты только одного вида (рисунок 1).
Рис. 1. Соотношение изолятов энтерококков в пробах подстилки и навоза, отобранных на молочно-товарной ферме в 2018-2020 гг.
При исследовании фенотипической чувствительности энтерококков к пяти антимикробным препаратам изоляты распределяли на три группы: чувствительные (susceptible, S) при стандартном режиме дозирования АМП; чувствительные при увеличенной экспозиции АМП (умеренно-чувствительные, Increased exposure, I) и резистентные (resistant, R) [2, 3, 4]. Установили, что и E. faecium и E. faecalis имели значительное количество резистентных и умеренно чувствительных изолятов во все годы наблюдения (табл. 1, 2). Таблица 1 Динамика чувствительности изолятов Enterococcus faecium к антимикробным препаратам на МТФ в 2018-2020 гг.
* Количество выделенных изолятов (n)=152 Таблица 2 Динамика чувствительности изолятов Enterococcus faecalis к антимикробным препаратам на МТФ в 2018-2020 гг.
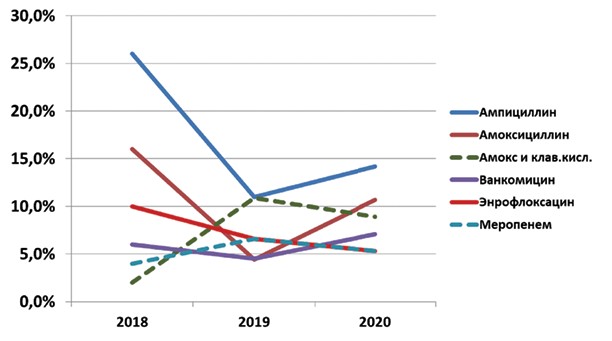
* Количество выделенных изолятов (n)=144 Установлено, что за три года увеличилась доля изолятов E. faecium со сниженной чувствительностью к ампициллину и амоксициллину, но снизилось количество малочувствительных к защищенному амоксициллину и эрофлоксацину, и - что особенно важно - к ванкомицину (в 2 раза) и меропенему (2,3 раза). При этом, однако, несколько выросла доля энтерококков, резистентных к ванкомицину, что позволяет предположить переход части изолятов, ранее имевших сниженную чувствительность, в группу резистентных. Доля устойчивых к меро-пенему также увеличилась (табл. 3). Приобретенная устойчивость E. faecium в основном ассоциирована с геном VanB, локализующимся на хромосоме либо плазмиде, или геном VanD, локализованным на хромосоме. Фенотипически эти энтерококки характеризуются разными профилями чувствительности к ванкомицину и тейкопланину. При этом изоляты, имеющие VanB на плазмиде, отличаются значительной мобильностью ARG и вносят существенный вклад в распространение антимикробной резистентности в популяциях диких энтерококков в случае их контаминации [1, 4, 8]. Таблица 3 Распределение по фенотипической чувствительности изолятов E. faecium, выделенных на МТФ в 2018-2020 гг. (%)
К положительным тенденциям следует отнести снижение доли изо-лятов E. faecium, резистентных к ампициллину, амоксициллину и эн-рофлоксацину (рисунок 2). Это может быть связано с прекращением использования данных антибиотиков и заменой АМП в терапевтической и профилактической стратегиях ветеринарного сопровождения на МТФ.
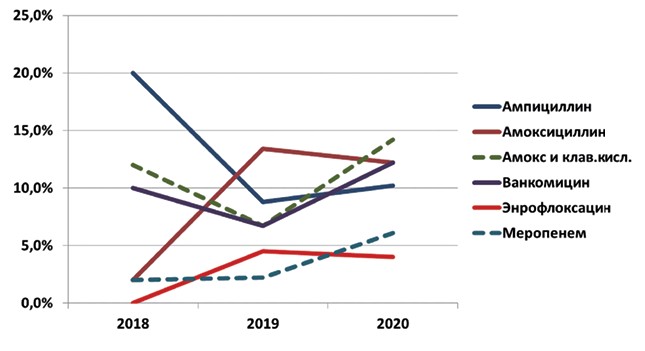
Рис. 2. Доля резистентных к антибиотикам изолятов от всех выделенных E. faecium на МТФ в 2018-2020 гг. Исследование фенотипической антибиотикочувствительности изо-лятов E. faecalis показало, что доля изолятов со сниженной чувствительностью к ампициллину за три года не изменилась и составляла в среднем 28,5%, а количество резистентных изолятов снизилось в 1,9 раза. При этом, однако, в 2020 г. каждый десятый изолят E. faecalis имел резистентность к ампициллину (табл. 4). По представлениям EUCAST ампициллин считается антибиотиком, активным в отношении фекальных энтерококков. В случае резистентности E. faecalis к данному антибиотику, изолят следует считать потенциально устойчивым к пенициллинам и карбапенемам, вследствие ассоциированной пониженной афинности к бета-лактамам [1, 4]. Доля обнаруженных нами в ходе исследований изолятов, резистентных к меропенему, выросла за три года с 2% до 6%. E. faecalis, резистентный к ампициллину, по рекомендациям EUCAST следует рассматривать как необычный фенотип: частота его встречаемости в популяциях энтерококков в настоящее время достаточно низка, однако в ряде географически и экологически обособленных микробиомов может существенно превышать среднюю. Таблица 4 Распределение по фенотипической чувствительности изолятов E. faecalis, выделенных на МТФ в 2018-2020 гг. (%)
Также отмечали изменение соотношения чувствительных и слабочувствительных к ванкомицину изолятов E. faecalis: за три года произошло перераспределение из группы (I) в группы (S) и (R). Значительно изменилась восприимчивость E. faecalis к энрофлоксацину: в 2020 году доля чувствительных изолятов увеличилась в 1,7 раза, преимущественно за счет уменьшения группы с промежуточной чувствительностью. При этом наблюдали также появление резистентных изолятов. В 2018 году не было выявлено ни одного изолята E. faecalis, устойчивого к энрофлоксацину, а в 2020 году они составляли уже 4% от всех исследованных (рисунок 3).
Рис. 3. Доля резистентных к антибиотикам изолятов от всех выделенных E. faecalis на МТФ в 2018-2020 гг.
Наиболее неблагоприятную динамику показала восприимчивость E. faecalis к амоксициллину. Соотношение изолятов существенно изменилось: количество слабочувствительных (I) уменьшилось в 2,5 раза, чувствительных (S) увеличилось в 1,5 раза, а количество резистентных (R) за три года выросло в 6 раз.
Заключение. Исследование в трехлетней динамике фенотипической антибиотикочувствительности энтерококков, выделенных из проб на молочно-товарной ферме, показало, что уровень резистентности изолятов колеблется в большинстве случаев в диапазоне 4-15%. К неблагоприятным тенденциям следует отнести рост количества устойчивых к меропенему E. faecium, значительную долю (более 10%) резистентных к пенициллинам изолятов E. faecium и E. faecalis; рост резистентности к меропенему; ванкомицину, а также, появление у изолятов E. faecalis устойчивости к энрофлоксацину. Положительные изменения касались, в основном, снижения доли изолятов E. faecium, резистентных к ампициллину, амоксициллину и энрофлоксацину, а также перераспределения энтерококков из группы с промежуточной чувствительностью в группу восприимчивых к меропенему, ванкомицину и амоксициллину. Анализ динамики профилей резистентности энтерококков показал, что интестинальные микробиомы животных на молочно-товарной ферме в значительной степени контаминированы агентами АМР (мобильными генетическими элементами и бактериями). Циркуляция элементов мобильного резистома в популяциях энтерококков на ферме несет риск распространения резистентности как в микробиомах животных, так и людей, находящихся на предприятии и контактирующих с содержащими кишечную микрофлору объектами.
Список литературы:
Резюме. В рамках работ по анализу контаминации животноводческих микробиомов агентами антимикробной резистентности проводили исследования динамики фенотипической чувствительности к антибиотикам изолятов Enterococcus faecium и Enterococcus faecalis на молочно-товарной ферме в течение трёх лет. Изучали восприимчивость энтерококков к ванкомицину, меропенему, энрофлоксацину, ампициллину, защищенному амоксициллину в 2018, 2019, 2020 гг., анализировали изменения резистентности изолятов на протяжении трехлетнего периода наблюдений. Установили, что в большинстве проб энтерококки встречались в виде ассоциаций E. faecium и E. faecalis. В 32-45% случаев в пробах находили изоляты только одного вида, при этом частота обнаружения E. faecium и E. faecalis была сравнительно одинакова. Другие виды энтерококков встречались в единичном количестве. Исследования фенотипической антибиотикочувствительности показали, что средний уровень резистентности выделенных изолятов энтерококков колебался, в диапазоне 415%. Наблюдали увеличение количества устойчивых к меропенему изолятов E. faecium; появление у изолятов E. faecalis устойчивости к энрофлоксацину. Также выявили значительную долю (более 10%) резистентных к пенициллинам изолятов E. faecium и E. faecalis; рост резистентности энтерококков к меро-пенему и ванкомицину. Благоприятные тенденции выявили в снижении доли изолятов E. faecium, устойчивых к ампициллину, амоксициллину и энрофлоксацину. На протяжении 2018-2020 гг. отмечали перераспределение изолятов E. faecium и E. faecalis между чувствительной, умеренно чувствительной и резистентной группами, при этом основной тенденцией было уменьшение доли изолятов с промежуточной чувствительностью к повышенным концентрациям антибиотиков.
Ключевые слова: антибиотикочувствительность, антибиотикорезистент-ность, энтерококки, Enterococcus faecium, Enterococcus faecalis, молочно-товарная ферма, антимикробные препараты, ванкомицин, меропенем, энро-флоксацин, ампициллин.
Сведения об авторах:
Кривоногова Анна Сергеевна, доктор биологических наук, доцент, ведущий научный сотрудник лаборатории биологических технологий ФГБНУ УрФАНИЦ УрО РАН; 620145, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: tel-89826512934@yandex.ru.
Соколова Ольга Васильевна, кандидат биологических наук, старший научный сотрудник лаборатории геномных исследований и селекции животных ФГБНУ УрФАНИЦ УрО РАН; 620145, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: nauka_sokolova@mail.ru.
Безбородова Наталья Александровна, кандидат ветеринарных наук, старший научный сотрудник лаборатории геномных исследований и селекции животных ФГБНУ УрФАНИЦ УрО РАН; 620145, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: n-bezborodova@mail.ru.
Моисеева Ксения Викторовна, младший научный сотрудник лаборатории биологических технологий ФГБНУ УрФАНИЦ УрО РАН; 620145, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: moiseeva456@yandex.ru.
Ответственный за переписку с редакцией: Исаева Альбина Геннадьевна, доктор биологических наук, доцент, ведущий научный сотрудник лаборатории биологических технологий ФГБНУ УрФАНИЦ УрО РАН; 620145, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: isaeva.05@bk.ru.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|