|
||||

Динамика антителообразования при экспериментальном заражении вирусом африканской чумы свинейУДК:608.2:578.8:619:616.98:616-079.4 Першин А.С., Шевченко И.В., Иголкин А.С., Жуков И.Ю., Власова Н.Н., Мануйлова О.А. ФГБУ «ВНИИЗЖ», г. Владимир Введение. Африканская чума свиней (далее, АЧС) - контагиозная вирусная болезнь, протекающая с проявлениями гемморагической лихорадки, поражающая домашних свиней и диких кабанов. АЧС может протекать в формах от сверхострой до инаппарантной. Уровень смертности при заражении высоковирулентными изолятами достигает 100%. На сегодняшний день эффективных мер специфической профилактики и лечения АЧС не существует [2, 7, 8].
Возбудитель АЧС - двухцепочечный ДНК-вирус семейства Asfarviridae. Как правило заражение животного происходит посредством алиментарного пути (поедании свиньями отходов пищевых продуктов и сырья, полученного от инфицированных животных, контаминированных возбудителем АЧС кормов), контакта с заражёнными животными и инфестации инфицированными мягкими клещами рода Ornithodoros, а также при контакте с контаминированными возбудителем АЧС объектами окружающей среды. Для вируса АЧС свойственны гемадсорбирующая активность, высокая генетическая и антигенная гетерогенность популяции [4, 13, 15, 16].
С момента заноса в 2007 году Россия стационарно неблагополучна по заболеванию африканской чумой свиней. Основной экономический ущерб от болезни складывается из затрат на вынужденное уничтожение животных и ликвидацию вспышек, а также затрат, к которым приводят ограничения, накладываемые на внутреннюю и международную торговлю.
Ежегодно в Российской Федерации проводится большое количество серологических исследований, направленных на выявление антител к возбудителю АЧС [10]. В отсутствии вакцинации, результаты, полученные прямыми и непрямыми методами исследований, являются равнозначными для лабораторной диагностики заболевания. Согласно действующим «Ветеринарным правилам....», [1] диагноз на АЧС устанавливается по результатам лабораторных исследований проб биологического (патологического) материала и сывороток крови (выявление вируса АЧС, его генетического материала или антител против возбудителя АЧС). Однако, применять прямые и непрямые методы исследований необходимо в соответствии с учётом их границ применимости.
Целью данной работы является анализ результатов серологических исследований образцов, полученных от животных во время 13 экспериментальных заражений различными изолятами вируса АЧС, выделенными на территории Российской Федерации в период с 2013 по 2016 годы.
Материалы и методы исследований. Экспериментальные заражения проводили на поросятах массой тела 15-25 кг, полученных из благополучных по инфекционным болезням хозяйств Владимирской области. Животных содержали в изолированном боксе виварного комплекса ФГБУ «ВНИИЗЖ», отвечающего требованиям работы с ПБА II группы (BSL-3). В течение 5-10 дневного карантина исследовали сыворотку крови животных для подтверждения серонегативного статуса к возбудителям основных инфекционных болезней свиней.
Для заражения использовали различные изоляты вируса АЧС, дозы и методы заражения (табл. 1, 2, 4). При этом использовали поступающий в лабораторию патологический полевой материал от подозреваемых в инфицировании животных из различных регионов Российской Федерации, а также вируссодержащий материал, полученный при культивировании вируса АЧС в культуре клеток (КК). Так, изолят вируса АЧС Одинцово-02/14, выделенный из селезёнки дикого кабана, убитого на территории Таракановского лесничества Одинцовского района Московской области, был пассирован в КК КМС в течение 3 последовательных пассажей [12]. Восемь используемых золятов было получено от дикого кабана, четыре - от домашних свиней. Один изолят выделен из фекалий кабана, обнаруженных на территории Липецкой области.
Для получения заражающей вируссодержащей жидкости первоначально подготавливали 10% суспензию селезёнки (в отдельных случаях другого инфицированного материала) в стерильном физрастворе, которую разводили до испытуемой заражающей дозы. Дизайн отдельных экспериментов включал животных, находящихся в прямом контакте с инфицированными, для моделирования процесса передачи вируса. В течение всех опытов проводили наблюдение за животными с отбором проб крови (для получения сыворотки крови) на разные сроки после заражения. Ежедневно проводили термометрию и наблюдение за животными. Работы осуществляли согласно методическим рекомендациям, утверждённым в ФГБУ «ВНИИЗЖ» [3, 9].
Иммуноферментный анализ проводили наборами Ingezim PPA Compac K3 (Ingenasa, Испания) и ID Screen (IDvet, Франция) в соответствии с инструкциями производителя.
Результаты исследований и их обсуждение. В результате исследований, вошедших в данную работу, проведено экспериментальное заражение 129 свиней вирусом АЧС 13 изолятов по схеме «1 изолят - 1 опыт - 1 бокс», с использованием различных доз и методов заражения. При заражении 11 изолятами использовали 36 контактных свиней, одновременно находившихся в одном боксе с инфицированными животными на всём протяжении каждого эксперимента (табл. 1).
Установлены различия в сроках развития болезни у заражённых животных, длительности периодов от развития клинических признаков заболевания до гибели заражённых животных и периодов от развития клинических признаков заболевания до гибели контактных животных. Кроме того, отмечали случаи бессимптомного течения болезни, а также переболевания после инфекции. При вскрытии павших свиней, в большинстве случаев, обнаруживали изменения, характерные для АЧС: спленомегалию, гиперплазию и гиперемию регионарных лимфоузлов, кровоизлияния под капсулой почек, отек легких. Степень выраженности изменений увеличивалась в прямой зависимости от длительности жизни животного после заражения. Проведенные исследования показывают, что изученные изоляты вируса АЧС обладают различающимися биологическими свойствами.
Всего из 165 исследованных набором Ingenasa животных антитела выявили у 34 свиней (20,6%). Для сравнения эффективности выявления антител к вирусу АЧС из 165 образцов 143 исследованы двумя различными коммерческими наборами (табл. 1). Из них, набором IDvet выявили антитела у 9 животных, тогда как набором Ingenasa у 26.
Сроки обнаружения антител применяемыми наборами в пробах от переболевших животных варьировали. У свиньи, заражённой вирусом АЧС изолята Лысогорье 07/15 (контактно) набором IDVet получен положительный результат с 18 дня после начала эксперимента (заражения животных), а набором Ingenasa только с 28 дня. В противоположность этому, у двух свиней, выживших после заражения вирусом АЧС изолята Одинцово 02/14, положительный результат набором Ingenasa получен начиная с 9 и 12 дня после заражения, а набором IDvet только с 12 и 18 дня, соответственно. Вероятно, это связано с таргетными белками диагностических наборов. Так как набор IDvet направлен на выявление антител к p72, p62 и p32, в то время как набор Ingenasa только к р72. Различия в сроках выявления может быть обусловлено меняющейся динамикой накопления антител к различным белкам в крови инфицированных животных. Таблица 1. Сравнение чувствительности коммерческих наборов для выявления антител к вирусу АЧС
Примечание: ГАдЕ - гемадсорбирующие единицы; * - в числителе указано количество серопозитивных к вирусу АЧС животных по итогам опыта, в знаменателе общее количество животных в опыте; ** - в скобках указано количество контактных животных в группе.
Из 165 экспериметальных животных семь выжило, и не имело клинических признаков АЧС после переболевания в течение более 33 дней, что составляет 4,24% от общего их числа, или 20,58% от числа животных, у которых обнаружили антитела.
Таким образом, продукция антител иммунной системой животного при заражении вирусом АЧС различных изолятов, выделенных на территории Российской Федерации в 2013-2016 годы существенно не влияла на выживаемость животных. Вероятность гибели свиньи после заражения российскими изолятами вируса АЧС 2013-2016 годов, в случае продукции антител в детектируемом количестве, составила 79,42%, при общей летальности 95,76%.
Ранний срок после заражения, в течение которого обнаруживали антитела, не увеличивал выживаемость животных, что согласуется с ранее полученными результатами [5]. Таблица 2. Групповая динамика гибели поросят и обнаружения антител к вирусу АЧС в наборе Ingezim PPA compac
Примечание: ГАдЕ - гемадсорбирующие единицы; в числителе указано количество серопозитивных к вирусу АЧС животных, в знаменателе количество живых животных. Данные указаны на последний день выбранного временного промежутка.
В 2013-2016 гг. вспышки африканской чумы свиней официально нотифицированы в 31 субъекте Российской Федерации. За данный период в референтной лаборатории по АЧС «ФГБУ ВНИИЗЖ» изучены культуральные свойства более 50 изолятов возбудителя. Антитела к вирусу АЧС во время экспериментального заражения российскими изолятами вируса АЧС в ФГБУ «ВНИИЗЖ» обнаруживали с момента начала проведения данных работ, при заражении изолятами 2013 года, выделенными на территории Тверской области [14]. Первый случай реконвалесценции от заболевания при экспериментальном заражении в референтной лаборатории по АЧС установлен при заражении изолятом Антоново 07/14, выделенным в 2014 году [6]. В представленную работу вошли изоляты вируса, выделенные из 11 различных регионов, что составляет более трети от всех поражённых в 20132016 годах территорий страны. Для экспериментальных заражений использовали отобранные по культуральным свойствам и пространственно-временным характеристикам изоляты. Таблица 3. Динамика образования антител у свиней, зараженных изолятами вируса АЧС, выделенными в 2013-2016 гг.
В ходе проведенных экспериментов при анализе динамики образования антител у свиней не прослеживается чёткий тренд выявления серологической конверсии в сыворотках крови свиней заражённых различными изолятами вируса АЧС в зависимости от года выделения, вошедшего в данную работу, изолята (табл. 3). Процент серопозитивных животных оставался низким независимо от года выделения. Таким образом, обнаружение антител у свиней связано с конкретными изолятами. Так например, для экспериментов с изолятами Одинцово 02/14 и Липецк 12/16 было характерно высокое количество животных, у которых в сыворотках крови обнаруживали антитела к вирусу АЧС (10 положительных из 14 зараженных животных (71,4%) и 6 из 8 (75%) соответственно), в то время как при заражении изолятом Графский 06/14 антитела обнаружены только у 1 из 16 животных (6,25%). При заражении изолятом Рязань 07/16 животных с антителами к вирусу АЧС не обнаружено.
Вероятность обнаружить антитела у животных, инфицированных контактным путём значимо выше, чем при первичном заражении. Так из 36 животных, заразившихся контактным путём, антитела выявили у 14, что составляет 38,9%. Антитела у животных, которым ино-кулировали вирус (внутримышечно или ороназально) выявили только в 15,5% случаев (20 животных из 129).
При анализе сроков обнаружения антител у погибших свиней установлено, что антитела у тринадцати животных обнаружены за 1 день до гибели, у трёх за 2 дня, у двух за 3 дня, у четырёх за 4 дня и у трёх за 5-12 дней. Учитывая развитие коагулопатии и геморрагического синдрома при АЧС, особенно при заражении высоковирулентными изолятами, инвазивные методы отбора крови, вероятно, могут ускорять наступление гибели животных. Тем не менее, стоит отметить, что максимально длительные периоды от момента обнаружения антител до смерти животных характерны для изолята Одинцово 02/14, который показал более высокий уровень наличия серопревалентных животных по сравнению с другими изолятами.
В опытах (n=7) проведённых с использованием различных заражающих доз (0,1-10 ГАдЕ) антитела в группах животных, заражённых большей дозой обнаруживали только для изолятов Воронеж-Агро 12/14 (10 ГАдЕ) и Рязань 10/15 (10 ГАдЕ). В остальных случаях антитела обнаруживали только в группах, заражённых меньшей дозой вируса АЧС того же изолята. Таблица 4. Динамика выявления антител при экспериментальном заражении
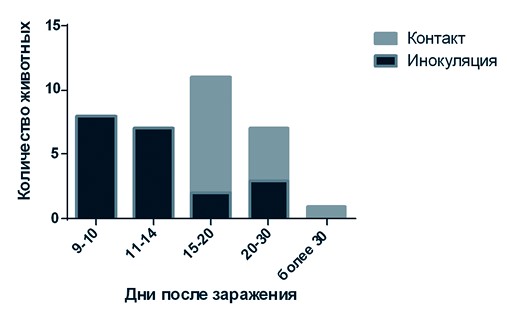
Примечание: в/м - внутримышечное введение; и/н - интраназальное введение; конт - животное из группы контакта; * - полужирным шрифтом выделен день отбора проб крови положительной на наличие антител к вирусу АЧС; ** - животных вывели из опыта. Антитела у большинства инфицированных животных вырабатывались в детектируемых в ТФ ИФА количествах на 9-14 сутки после заражения (рисунок 1). У животных находящихся в контакте, антитела вырабатывались преимущественно на 15-20 сутки, что указывает на быструю репликацию вируса в организме животных которым инокулировали вирус, быстрое наступление периода выделения вируса в окружающую среду. Таким образом, после попадания вируса в организм контактных свиней проходило необходимое минимальное физиологическое время для образования иммуноглобулинов в детектируемом количестве (7-9 дней). Обнаружение антител на 20-25 сутки после заражения для контактных и инфицированных животных может свидетельствовать о длительном течении инфекционного процесса, приводящем к поздней выработке антител. Также возможно незаражение животных при первичном введении им вируса АЧС и их последующее заражение при контакте с инфицированными животными. Таким образом, с момента попадания вируса в популяцию свиней до наступления сероконверсии у вторично инфицированных животных может проходить длительное время, что важно учитывать при выборе метода диагностики АЧС.
Рис. 1. Гистограмма распределения частоты обнаружения серопозитивных животных в зависимости от времени после начала опыта Антитела у диких кабанов и у свиней при вспышках заболевания в Российской Федерации обнаруживали с момента возникновения эпизоотии, как в первичных, так и во вторичных очагах [11]. Несмотря на это, серодиагностика, направленная на выявление антител к вирусу АЧС, на данный момент менее результативна, чем методы выявления антигена или генома вируса. Это объясняется тем, что вследствие высокой вирулентности вируса АЧС его циркуляция в 2013-2016 гг. на территории Российской Федерации сопровождалась низкой серопревалентностью [10, 14], что подтверждается результатами данной работы.
Однако, высокий процент выживаемости животных и свиней, положительных по наличию антител к возбудителю заболевания после их экспериментального заражения вирусом АЧС изолята Липецк 12/16 указывают на то, что при пассировании через организм животного (например дикого кабана) происходит качественное изменение популяционной составляющей вируса.
Снижение летальности и увеличение числа случаев бессимптомного и хронического течения заболевания в эндемичных по АЧС районах потребует изменения подхода к лабораторной диагностике АЧС, так как у переболевших животных возможна персистенция вируса, что приведёт к невозможности его детектировать применением только прямых методов.
Выводы:
1. В результате экспериментального заражения 165 животных (инокуляция 129 поросятам + 36 в группе контакта) 13-ю российскими изолятами вируса АЧС выделенными со вспышек инфекции в 2013-2016 гг. при испоользовании коммерческого набора ТФ ИФА антитела удалось обнаружить только у 20,6%. Общая летальность составила 95,76%, что говорит о высокой вирулентности большинства исследованных изолятов. При этом, из всех животных имеющий положительный серологический статус, выжило только 20,58%, что подтверждает недостаточность гуморального ответа для выживания. У большинства животных антитела к вирусу АЧС в детектируемом в ТФ ИФА количестве вырабатываются за 1 день до гибели.
2. Так как антитела к возбудителю выявляются только у ограниченного числа животных, проведение исследований направленных на выявление антител у домашних свиней в целях раннего обнаружения болезни, либо определения статуса благополучия в рамках мониторинговых программ не целесообразно. Однако, учитывая возможность переболевания животных, необходимо параллельно с прямыми методами проводить исследования по выявлению антител у поголовья, лишённого постоянного контроля со стороны ветеринарных служб, у дикого кабана, а также на крупных свиноводческих предприятиях, где так называемый естественный технологический отход может замаскировать мягкое или бессимптомное течение инфекции.
3. Доступные на рынке коммерческие наборы отличаются по диагностической чувствительности выявления антител к вирусу АЧС. Однако, учитывая то, что различия наблюдались только на ранних сроках заражения, когда более эффективны прямые методы обнаружения возбудителя, различия не могут являться решающими для выбора используемой тест-системы. Кроме того, используемые в описанных экспериментах наборы не сравнивались по диагностической специфичности.
4. Вероятность обнаружить антитела у животных заражённых контактным путём («природная модель») выше, чем у первично инфицированных.
5. Описанные различия в приведённых выше сроках образования антител по каждому из изолятов могут свидетельствовать о гетерогенности вирусной популяции исследованных изолятов вируса АЧС.
6. При заражении свиней изолятами Одинцово 02/14 и Липецк 12/16 получено высокое количество серопозитвных к вирусу АЧС животных, 71,4% и 75% соответственно.
Список литературы:
Резюме. Ежегодно в Российской Федерации проводится большое количество серологических исследований, направленных на выявление антител к возбудителю африканской чумы свиней. Оценку эффективности серологической диагностики АЧС необходимо проводить, основываясь на динамике обнаружения антител к вирусу АЧС, циркулирующему на территории страны. В данной работе обобщены результаты выявления антител после 13 экспериментальных заражений свиней российскими изолятами вируса АЧС, выделенными в различных регионах Российской Федерации в 2013-2016 годах. В этот период вспышки АЧС официально нотифицированы в 31 субъекте Российской Федерации. В данной работе использовали изоляты вируса выделенные в 11 различных регионах, что составляет более трети от всех неблагополучных на тот момент территорий страны. Для экспериментальных заражений использовали отобранные по культуральным свойствам и пространственно-временным характеристикам изоляты. В ТФ ИФА антитела удалось обнаружить только у 20,6% животных. При этом, у большинства инфицированных животных антитела обнаруживали начиная с 9-14 суток после заражения. Общая летальность для анализируемых изолятов составила 95,76%, что говорит об высокой вирулентности большинства из них. Из всех животных имеющий положительный серологический статус, выжило только 20,58%, что подтверждает недостаточность гуморального ответа для выживания. У большинства животных антитела к вирусу АЧС в детектируемом в ТФ ИФА количестве вырабатываются за 1 день до гибели. При этом антитела к вирусу АЧС более часто обнаруживаются при контактном заражении, являющимся более схожим с тем, что происходит в условиях свиноводческого хозяйства.
Ключевые слова: африканская чума свиней, диагностика, ТФ ИФА, эпизоотология, серология, экспериментальное заражение, вирусология, биопроба, кабаны, домашние свиньи, антитела.
Сведения об авторах:
Шевченко Иван Вячеславович, кандидат биологических наук, научный сотрудник референтной лаборатории по АЧС ФГБУ «ВНИИЗЖ»; 600901, г. Владимир, мкр. Юрьевец; e-mail: shevchenko@arriah.ru.
Иголкин Алексей Сергеевич, кандидат ветеринарных наук, заведующий референтной лабораторией по АЧС ФГБУ «ВНИИЗЖ»; 600901, г. Владимир, мкр. Юрьевец; e-mail: igolkin_as@arriah.ru.
Жуков Иван Юрьевич, кандидат биологических наук, младший научный сотрудник референтной лаборатории по АЧС ФГБУ «ВНИИЗЖ»; 600901, г. Владимир, мкр. Юрьевец; e-mail: zhukov@arriah.ru.
Власова Наталья Никифоровна, доктор биологических наук, главный научный сотрудник, референтной лаборатории по АЧС ФГБУ «ВНИИЗЖ»; 600901, г. Владимир, мкр. Юрьевец; e-mail: vlasova_nn@arriah.ru.
Мануйлова Ольга Анатольевна, соискатель ФГБУ «ВНИИЗЖ»; 600901, г. Владимир, мкр. Юрьевец; e-mail: o.manuylova@list.ru.
Ответственный за переписку с редакцией: Першин Андрей Сергеевич, кандидат ветеринарных наук, старший научный сотрудник референтной лаборатории по АЧС ФГБУ «ВНИИЗЖ»; ФГБУ «ВНИИЗЖ»; 600901, г. Владимир, мкр. Юрьевец; тел.: 8(4922)261512; e-mail: pershin@arriah.ru.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|