|
||||

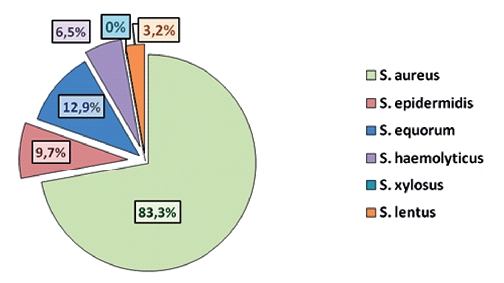
Характеристика антимикробной резистентности стафилококков на молочно-товарной ферме в пятилетней динамикеУДК 619:615.07:001.891.53:631.14 Кривоногова А.С., Исаева А.Г., Соколова О.В., Логинов Е.А., Беспамятных Е.Н. Антимикробные препараты широко применяются для предотвращения болезней и улучшения продуктивности сельскохозяйственных животных. При этом антимикробная резистентность (далее, АМР) является неизбежным побочным эффектом и главной проблемой нетерапевтических схем приема антибиотиков, так как микрофлора адаптируется к малым дозам антибактериальных препаратов и вырабатывает устойчивость. Механизм горизонтального переноса генов (далее, ГПГ) способствует быстрому её распространению в микробиомах животных, человека, окружающей среды [3, 4, 9, 12]. ГПГ способствует эволюции бактерий, приводя к появлению устойчивых штаммов патогенов таких как, например, метициллин-резистентный золотистый стафилококк (далее, MRSA), энтеробактерии -продуценты в-лактамаз расширенного спектра (далее, БЛРС) или ван-комицин-резистентные энтерококки (далее, VRE). Эти патогены получили ген резистентности от другого вида бактерий, связывая клинически важные патогены с резистомом - глобальным резервуаром генов резистентности, которые придают устойчивость к антибиотикам [5]. В результате микрофлора продуктивных животных становится резервуаром и источником генов резистентности (далее, ARGs). Добавка кормовых антибиотиков в рацион животных, нарушение лечебных схем и низкая доступность лабораторных тестов на антибиотикочувствитель-ность (далее, АБЧ) в животноводстве постепенно привели к вытеснению менее адаптированных бактерий из микробиомов и замещению их в экологических нишах более стойкими штаммами [3, 4, 9, 12]. К представителям наиболее распространенных на молочных фермах патогенов относятся возбудители гнойно-септических заболеваний кожи, копыт, слизистых оболочек респираторной и репродуктивной систем, молочной железы, внутренних органов - различные виды стафилококков. При этом наиболее клинически значимы штаммы, продуцирующие стафилококковые токсины (мембранотоксины, гемолизины, энтеротоксины, эксфолиатины, сфингомиелиназа и др.). Появление в микробиоме фермы таких штаммов приводит к росту заболеваемости среди иммунокомпрометированных животных - новорожденных телят, молодняка крупного рогатого скота, стельных и новотельных коров, а в случае хронических интоксикаций и неблагоприятных условий содержания - у всего поголовья. При иммунодефицитах стафилококки часто вызывают бактериемию с появлением метастатических очагов инфекции любой локализации. Стафилококковая бактериемия в медицине является основной причиной заболеваемости (особенно удлинения периода госпитализации) и смертности среди ослабленных пациентов [1, 2, 11]. Так как стафилококки являются представителями условно-патогенной микрофлоры млекопитающих, они вызывают схожие патологии как у животных, так и у человека, способны распространяться в смежных экологических нишах, а потому представлять опасность не только для продуктивных животных, но и для работников ферм. Кроме того, существует риск передачи агентов резистентности - бактерий или генов (ARGs) - через животноводческую продукцию (мясо и молоко) конечному потребителю. Так, в бактериях, выделенных из молока коров, обнаруживали гены bla, mcr-1, cfr и tet, ассоциированные с антимикробной устойчивостью условнопатогенных бактерий, клинически значимых для человека [8, 10]. Лечение стафилококковых инфекций обычно проводят с применением защищенных бета-лактамов, ванкомицина, фторхинолонов. В настоящее время все чаще встречаются штаммы стафилококков с мультирезистентностью (МЛУ, MDR), широкой устойчивостью (ШЛУ, XDR) или панрезистентностью (ПЛУ, PDR), частично сохраняя чувствительность только к самым новым антибиотикам [1, 7]. Многочисленные исследования и клинические данные показывают, что в среднем в 20%-50% случаев штаммы стафилококков, выделенные из микробиомов людей и животных, продуцируют бета-лактамазы, что фенотипически проявляется в способности инактивировать пенициллины (ампициллин, амоксициллин, противопсевдомонадный пенициллин), цефалоспорины и карбапенемы [1, 2, 6]. В связи с распространением штаммов стафилококков, имеющих гены БЛРС, стартовые протоколы лечения тяжелых стафилококковых инфекций в медицинской практике были пересмотрены и включают ванкомицин или даптомицин в случае инфекций кровотока, ванкомицин, телаванцин или линезолид при инфекциях респираторного тракта, в том числе, пневмониях [1, 13]. Однако в ветеринарии до сих пор сохраняется тенденция к эмпирическому выбору антибиотика, без предварительного определения чувствительности, что ведет к низкой эффективности лечения и развитию резистентности у ранее чувствительных штаммов. В связи с этим необходимы как мониторинг и контроль антимикробной резистентности на животноводческих предприятиях, так и поиск альтернатив антибиотикам и способов сдерживания АМР. Цель работы - проанализировать антимикробную резистентность Staphylococcus spp. на молочно-товарной ферме в пятилетней динамике. Материалы и методы исследований. Для исследований отбирали биологический материал от коров и телят (молоко, смывы с молочной железы, смывы со слизистой оболочки ротовой и носовой полостей, влагалища, смывы с кожи и шерстного покрова), образцы подстилки, смывы с контактных поверхностей, оборудования, инвентаря по уходу за скотом, пробы воздуха на различных технологических участках МТФ. Всего в 2017, 2020 и 2022 гг. было отобрано 142 пробы. Лабораторные исследования выполняли в соответствии с МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам»; ГОСТ Р ИСО 20776-1-2010 «Клинические лабораторные исследования и диагностические тест-системы in vitro*. Исследование чувствительности инфекционных агентов и оценка функциональных характеристик изделий для исследования чувствительности к антимикробным средствам»; ГОСТ 32901-2014 «Молоко и молочная продукция. Методы микробиологического анализа; МУ «Правила бактериологического исследования кормов» (1975 г.); Клинические рекомендации, утв. на Расширенном совещании Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (Москва, 15.05.2017 г.); Экспертные правила EUCAST. Для культивирования использовали типовые питательные среды; идентификацию микроорганизмов и определение их чувствительности к антибиотикам проводили культуральными микробиологическими методами, а также методом MALDI-TOF масс-спектрометрии (Vitek MS, BioMerieux). Определение фенотипической чувствительности выделенных бактерий к антибиотикам диско-диффузионным методом проводили с использованием агара Мюллера-Хинтон (Bio-Rad, Франция), дисков с антимикробными препаратами (Bio-Rad, Франция, НИЦФ, Санкт-Петербург). Содержание антимикробного препарата (АМП) в стандартных дисках: меропенем - 10 мкг, ципрофлоксацин - 5 мкг, ампициллин - 10 мкг, амоксициллин - 20 мкг, левомицетин - 30 мкг, доксициклин - 30 мкг, азитромицин - 15 мкг, тобрамицин - 10 мкг. Исследования выполнены в ФГБНУ УрФАНИЦ УрО РАН в рамках Государственного задания Минобрнауки России по теме № 0532-2021-0004 «Разработка методологических подходов к мониторингу, контролю и сдерживанию антибиотикорезистентности оппортунистических микроорганизмов в животноводстве». Результаты исследований и их обсуждение. Проведенные исследования показали, что наиболее распространенными представителями рода Staphylococcus на обследованной молочно-товарной ферме в 2017-2022 гг. являлись: S. aureus, S. xylosus, S. equorum, S. epidermidis, S. haemolyticus и S. lentus. В 2017 году в пробах выявляли преимущественно изоляты S. aureus (83,3% от общего количества выделенных стафилококков), S. equorum (12,9%) и S. epidermidis (9,7%), в то время как количество S. haemolyticus и S. lentus составило всего 6,5% и 3,2%, соответственно, а S. xylosus совсем отсутствовал в отобранных пробах (рисунок 1).
Рис. 1. Частота встречаемости стафилококков в пробах на молочно-товарной ферме в 2017 году
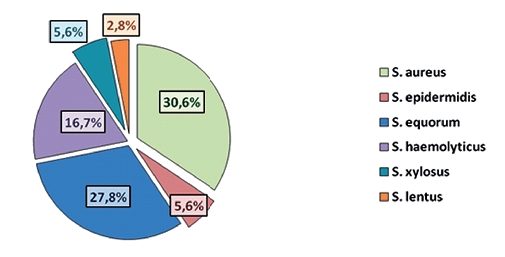
В 2022 году родовой состав стафилококков был представлен следующими видами: S. aureus (30,6% от общего количества стафилококков), S. equorum (27,8%), S. haemolyticus (16,7%), S. xylosus (5,6%), S. epidermidis (5,6%) и S. lentus (2,8%) (рисунок 2).
Рис. 2. Частота встречаемости стафилококков в пробах на молочно-товарной ферме в 2022 году За пять лет штаммы S. haemolyticus и S. equorum могли вытеснить S. aureus. Так как существенных изменений в технологии содержания скота на ферме за этот период не было, смена преобладающего вида стафилококков может быть связана с более высокой устойчивостью S. haemolyticus к используемым на ферме антибактериальным препаратам и дезинфектантам. Доля S. lentus осталась неизмененной, составляя в среднем ~3%. Анализ фенотипической чувствительности выделенных изолятов Staphylococcus spp. показал снижение средней чувствительности к фторхинолонам, тетрациклинам, пенициллинам в 2022 году по сравнению с 2017 годом. Результаты тестов на чувствительность распределяли по 5 группам: 0 - резистентность (R), 1-2 - чувствительность снижена (I), 3-4 - чувствительность сохранена (S) (табл. 1, 2, 3). Таблица 1 Изменение чувствительности S. aureus к антибиотикам в период 2017-2022 гг.
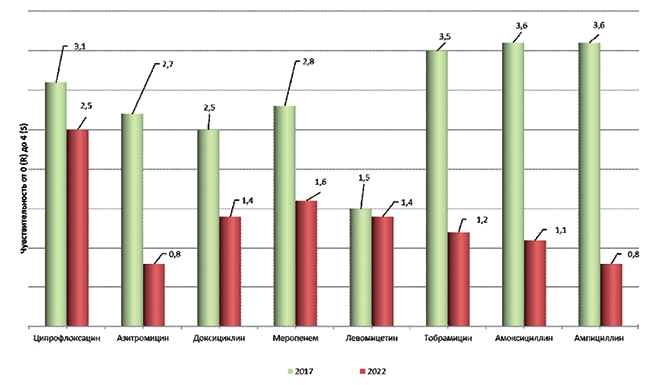
Примечание: X±x (мода) n=24; R - резистентность (0), I - чувствительность снижена (1-2), S - чувствительность сохранена (3-4) Было обнаружено снижение доли чувствительных изолятов S. aureus и увеличение доли резистентных и слабочувствительных. Так, в 2017 году к в—лактамным антибиотикам - меропенему, амоксициллину и ампициллину, - было восприимчиво 85%-92% изолятов, а в 2022 году - только 0%-20%. При этом увеличилось число изоля-тов со сниженной чувствительностью к меропенему (I - 7,1% в 2017 году и 60% в 2022 году), увеличилась доля как слабочувствительных (I - около 7% в 2017 году, 50% в 2022 году), так и резистентных к ампициллину и амоксициллину форм (R - 0% в 2017 году, 50% и 40% в 2022 году). Аналогичная тенденция обнаружена для азитромицина и тобрамицина (рисунок 3).
Рис. 3. Изменение средней чувствительности S. aureus на молочно-товарной ферме за 5 лет Выявили тенденцию к снижению средней чувствительности обнаруженных на МТФ изолятов S. epidermidis к полусинтетическим пенициллинам. При этом к доксициклину, наоборот, в 2022 году было обнаружено больше восприимчивых изолятов, чем в 2017 году (табл. 2). Таблица 2 Изменение чувствительности S. epidermidis к антибиотикам в период 2017-2022 гг., n=10
В отношении S. equorum отмечено некоторое снижение активности доксициклина и ампициллина в 2022 году по сравнению с 2017 годом. При этом средняя чувствительность данных изолятов к азитромицину и левомицетину повысилась. В целом, для более точного описания динамики антибиотикочувствительности S. epidermidis и S. equorum требуются дальнейшие исследования с охватом большего количества изолятов. Однако, выявленные факты фенотипической резистентности у изолятов стафилококков на МТФ косвенно свидетельствуют о циркуляции генетических детерминант резистентности в микробиомах фермы, в том числе о наличии у стафилококков генов резистентности, ассоциированных с в-лактамазами. Таблица 3 Изменение чувствительности S. equorum к антибиотикам в период 2017-2022 гг.
Была обнаружена тенденция к росту количества мультирезистентных изолятов Staphylococcus spp. в период с 2017 по 2022 г. (табл. 4) Таблица 4 АБЧ мультирезистентных изолятов Staphylococcus spp., обнаруженных на ферме в период 2017-2022 гг.
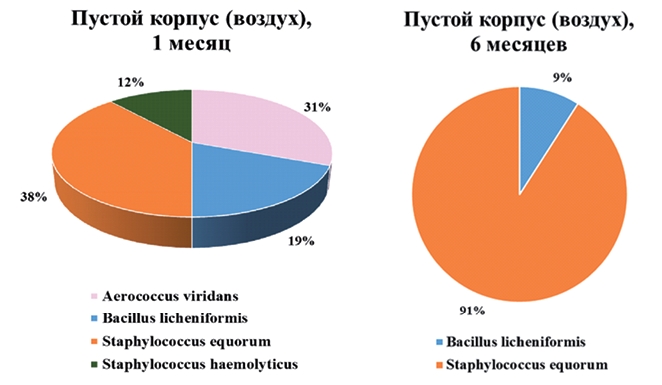
Примечание: * - SA - S. aureus, SE - S. epidermidis, SH - S. haemoliticus Так в 2017 г. устойчивость к двум и более антибиотикам выявили у стафилококков в 1,9% проб; в 2017 году - в 7,9% проб, в 2022 году -в 11,3% проб. При этом в 2017 г. мультирезистентность обнаружили только у изолятов S. aureus, а в 2022 - у S. aureus, S. haemolyticus и S. epidermidis. Это может быть косвенным свидетельством межвидового переноса генов резистентности в популяциях стафилококков. Наиболее неблагоприятно нахождение мультирезистентных штаммов Staphylococcus spp. в подстилке, на контактных поверхностях и инвентаре по уходу за скотом, так как с помощью этих факторов передачи происходит распространение штаммов и перенос их в пространстве фермы или между животными. Увеличение количества мультире-зистентных стафилококков затрудняет лечение больного поголовья стандартными схемами антибиотикотерапии, следовательно, может привести к увеличению частоты осложненных и затяжных форм стафилококковых инфекций, а в случае иммунокомпрометированных животных - к росту смертности поголовья от гнойно-септических заболеваний. Предположительно, формирование устойчивости в родильном отделении и телятнике могло быть связано с использованием одинаковых протоколов и средств дезинфекции в течение нескольких лет, что способствовало селекции резистентных штаммов Staphylococcus spp. и распространению генов резистентности в микробиомах. Также проводили исследования в пустом корпусе, освобожденном от скота для проведения ремонтных работ и дезинфекции. Отбирали пробы с контактных поверхностей, стен, инвентаря, кормового стола, пола, ограждений, кормушек и поилок через 1 и 6 месяцев после вывода скота. В пробах, взятых через 1 месяц, обнаружили изоляты S. equorum и S. haemolyticus, а через полгода - только изоляты S. equorum (рисунок 4).
Рис. 4. Микроорганизмы в пробах воздуха в пустом корпусе через 1 и 6 месяцев после вывода скота Таким образом, можно предположить, что штаммы S. equorum либо изначально имели более высокую устойчивость к дезинфектантам, низким температурам и условиям обитания в целом, либо приобрели её быстрее, чем штаммы S. haemolyticus. Заключение. В ходе проведенных исследований были установлены тенденции к росту антибиотикорезистентности обнаруженных на МТФ Staphylococcus spp. и к увеличению количества мультирезистент-ных изолятов, не восприимчивых к 3-5 классам антибиотиков. Чувствительность изолятов S. aureus в 2022 году по сравнению с 2017 годом существенно снизилась к бета-лактамам (меропенему, ампициллину, амоксициллину), азитромицину и тобрамицину. Полученные данные свидетельствуют о том, что антимикробная резистентность на молочной ферме остается актуальной проблемой. Те стафилококки, которые преобладали в 2017 году, могли быть замещены более устойчивыми штаммами. Кроме того, эпизоды резистентности у стафилококков, обитающих на МТФ, свидетельствуют о контаминации микробиомов фермы генами резистентности. Список литературы:
Резюме. Изучали изменение антимикробной резистентности изолятов Staphylococcus spp. на молочно-товарной ферме в течение пяти лет. Исследовали молоко, смывы с молочной железы коров, смывы со слизистых оболочек ротовой и носовой полости, с кожи и шерстного покрова коров и телят, смывы со слизистой оболочки влагалища коров, образцы подстилки, смывы с контактных поверхностей, оборудования, инвентаря по уходу за скотом, пробы воздуха на различных технологических участках молочно-товарной фермы. Исследования проводили в период с 2017 по 2022 годы. Анализировали родовой и видовой состав микроорганизмов, определяли фенотипическую чувствительность выделенных изолятов стафилококков к антибиотикам. Установили, что наиболее часто среди представителей рода Staphylococcus встречались S. aureus, S. xylosus, S. equorum, S. epidermidis, S. haemolyticus и S. lentus. В динамике выявили изменение соотношения преобладающих изолятов: увеличение доли S. haemolyticus и S. equorum и уменьшение S. aureus. Исследование чувствительности к антибиотикам показало тенденцию к росту антимикробной резистентности обнаруженных Staphylococcus spp. Установили, что в 2017 г. 85% изолятов золотистого стафилококка было, в основном, чувствительно к меропенему, ампициллину, амоксициллину, а в 2022 г. - не более 20%. Чувствительность изолятов S. aureus к азитромицину и тобрамицину в 2022 году по сравнению с 2017 г. существенно снизилась. Кроме того, увеличилось количество мультирезистентных изоля-тов, невосприимчивых к 3-5 классам антибиотиков. Полученные данные свидетельствуют о контаминации популяций стафилококков агентами резистентности и об их циркуляции в микробиоценозах фермы. Ключевые слова: крупный рогатый скот, молочная ферма, микроорганизмы, стафилококки, изоляты, Staphylococcus aureus, антимикробная резистентность, антибиотикочувствительность, мультирезистентность, контаминация популяций микроорганизмов. Сведения об авторах: Кривоногова Анна Сергеевна, доктор биологических наук, доцент, ведущий научный сотрудник, доктор биологических наук, заведующий лабораторией биологических технологий ФГБНУ «Уральский федеральный аграрный научноисследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: tel-89826512934@yandex.ru. Соколова Ольга Васильевна, доктор ветеринарных наук, старший научный сотрудник лаборатории геномных исследований и селекции животных ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044, e-mail: nauka_sokolova@mail.ru. Логинов Егор Александрович, лаборант лаборатории биологических технологий ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук», 620142, Российская Федерация, г. Екатеринбург, ул. Белинского, 112 а; e-mail: attiwer1337@gmail.com. Беспамятных Елисей Николаевич, кандидат биологических наук, старший научный сотрудник лаборатории иммунологии и патобиохимии ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук», 620142, г. Екатеринбург, ул. Белинского, 112 а; e-mail: demonorth@mail.ru. Ответственный за переписку с редакцией: Исаева Альбина Геннадьевна, доктор биологических наук, доцент, ведущий научный сотрудник лаборатории биологических технологий ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-343-2572044; e-mail: isaeva.05@bk.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|