|
||||

Особенности лабораторной диагностики при аэромонозе рыбУДК: 579.62; 579.843.2 Басанкина В.М. ФГБУ «Краснодарская межобластная ветеринарная лаборатория», г. Краснодар Введение. Обнаружение и идентификация возбудителей при возникновении заболевания у рыб с признаками бактериальной геморрагической септицемии на сегодняшний день является одной из главных задач, как для сотрудников диагностических лабораторий, так и для организаций, занимающихся разведением товарной рыбы. Следовательно, максимально ранняя диагностика могла бы служить гарантом снижения экономических потерь.
Целью нашей работы является совершенствование метода лабораторной диагностики инфекционной болезни рыб с признаками бактериальной геморрагической септицемии, позволяющего установить вид возбудителя и оценить его вирулентные и патогенные свойства за короткие сроки.
Для достижения цели были поставлены следующие задачи:
Материалы и методы исследований. Научные исследования проводились в лаборатории эпизоотологии Краснодарского научноисследовательского ветеринарного института и в отделе бактериологии ФГБУ «Краснодарская межобластная ветеринарная лаборатория».
Лабораторные исследования больной рыбы, доставленной из рыбоводных хозяйств, проводились в течение трех лет, используя два актуализированных (действующих) методических указания (далее, МУ) и две инструкции согласно виду рыб, а именно:
Объектами исследования служили особи рыб различных видов из 3 семейств:
Анализу подвергали живую свежевыловленную рыбу с клиническими признаками заболевания. Лабораторные исследования проводили бактериологическим, микроскопическим, биологическим методами.
При изучении особенностей бактерий учитывались морфологические, тинкториальные, культуральные, биохимические свойства, вирулентность и патогенность выделенных микроорганизмов.
Определение наличия микроорганизмов в организмах рыб проводили качественным анализом образцов печени, почек, сердца, селезенки, желчного пузыря, головного мозга.
Рассматривая фенотипические свойства выделенных микроорганизмов (штаммов), использовали как стандартные (классические), так и усовершенствованные методы. В работе использовались простые и специальные питательные среды (обогащенные, элективные и дифференциально-диагностические).
Тинкториальные свойства учитывались после окраски препарата по Граму. При изучении фенотипических свойств бактерий учитывали образование биопленки на мясопептонном бульоне, культивируя микроорганизмы при двух температурах (24°С и 37°С) в течение 48 ч. Оценку культуральных (макроморфологических) свойств проводили после образования колоний на плотных питательных средах МПА, Эндо, TSA, цетримидный агар, определяя форму, размер и окраску выросших бактерий. Биохимические показатели учитывали на жидких питательных средах Гисса (большой пестрый ряд), по расщеплению до кислотообразования, а глубину ферментативного процесса по наличию в питательной среде конечных газообразных продуктов.
Для определения протеолитических свойств использовали среды с желатином, молоком, пептоном. Способность бактериальных штаммов продуцировать гемолизины изучали на кровяном агаре с дефибринированной кровью барана.
Вирулентность выделенных штаммов аэромонад оценивали по ДНК-азной активности на ДНК-азном агаре [8].
Для проведения бактериологических исследований использовали следующее лабораторное оборудование: БАВп-01 «Ламинар С»-1, 2 (01), микроскоп люминесцентный проходящего и отражённого света Axio Imager Carl Zeiss, термостат 37±1°C Binder BD-400, шейкер с адаптером REAX top, денситометр (детектор мутности суспензий) с адаптером А-16 DEN-1B, дозатор пипеточный одноканальный «Thermo» 1 - 100 - 1000 мкл, баня водяная LT-2 двухместная и питательные среды производства ФБУН ГНЦПМБ, п. Оболенск, Московская область; НИЦФ, Санкт-Петербург; HiMedia Laboratories, Индия, а также тест - полоски и реактивы: OXItest, VPtest, PYRtest. При более углубленного исследования в лабораторной диагностике применяли тест - системы: ЭНТЕРОтест 24, НЕФЕРМтест 24 производства ERBA Lachema, Чехия.
Последующую идентификацию микроорганизмов осуществляли согласно определителю Берджи [10], нормативным документам [2, 4, 5, 6, 7] и др. источникам [1, 9].
Дополнительно проводили анализ выделенных культур на бактериологическом масс-спектрометре MALDI-TOF - с помощью десорбционного метода «мягкой» ионизации.
Для постановки окончательного диагноза изучали патогенные свойства выделенных культур с постановкой биологической пробы на белых мышах и морских свинках [3, 6].
Результаты исследований и их обсуждение. При изучении морфологических и тинкториальных особенностей микроорганизмов чашще всего наблюдали полиморфизм клеток, который заключался в наличии в нескольких полях зрения прямых и слегка изогнутых гра-мотрицательных палочек разной величины 0,2-0,5 к 1,0-2,8 мкм.
На плотных питательных средах при изучении культуральных свойств обнаружили разные колонии, отличающиеся по характеру роста, формой, размером, оттенками, консистенцией, структурой поверхности.
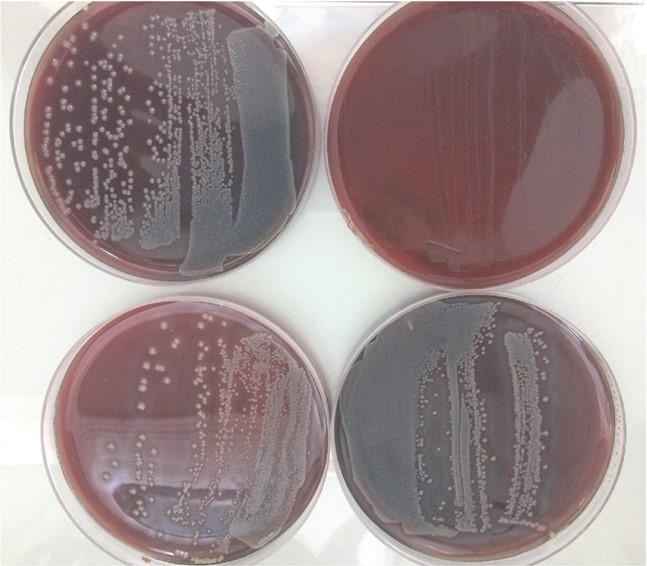
При росте на кровяном МПА из одной особи выделяли несколько штаммов, проявляющих гемолитическую активность разного типа (рисунок 1, 2, 3).
Рис. 1. Штаммы от одной особи с разным типом гемолитической активности
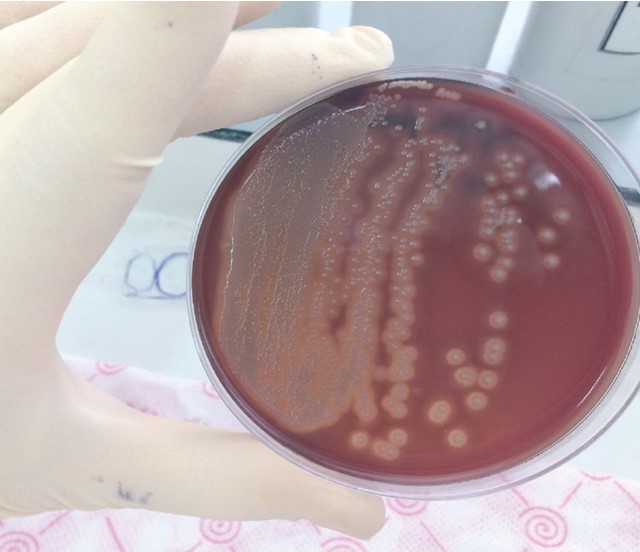
Рис. 2. Бета-гемолиз, характеризующийся полным растворением эритроцитов, с ферментативным обесцвечиванием гемоглобина (зона вокруг колонии прозрачная)
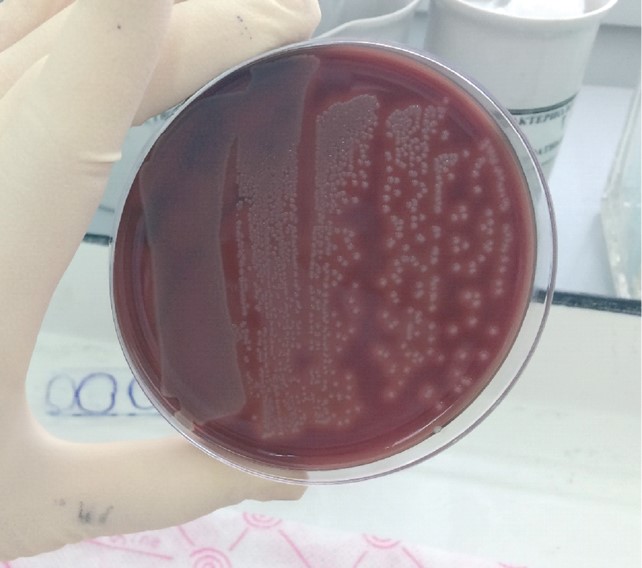
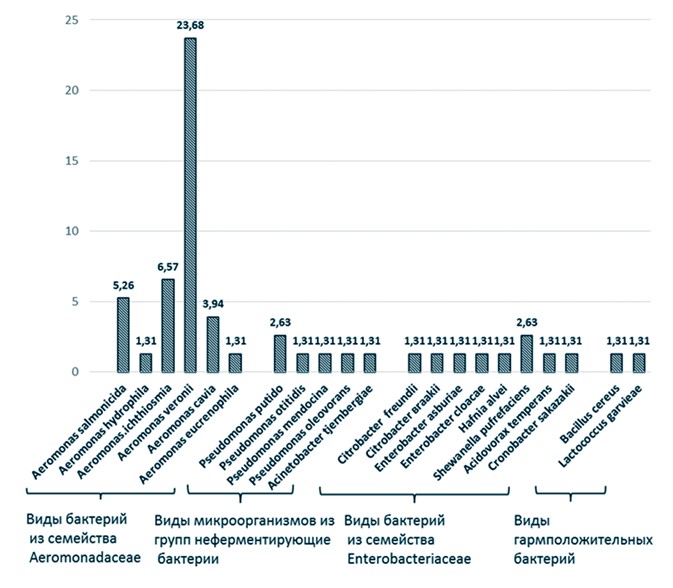
Рис. 3. Альфа-гемолиз, неполное разрушение эритроцитов с сохранением клеточной стромы Выделенные бактерии от особей с клиническими признаками заболевания были отнесены к 21 виду из 11 родов: А. salmonicida, A. hydrophila, А. ichthiosmia, А. veronii, A. caviae, A. eucrenophila, Pseudomonas putido, P. ctitidis, P. mendocina, P. оleovorans, Hafnia alvei, Citrobacter freundii, C. braakii, Enterobacter asburiae, E. oloacae, Cronobacter sakazakii, Shewanella pufrefaciens, Acidovorax temperans, Acinetobacter tjernbergiae, Bacillus cereus, Lactococcus garvieae (рисунок 4).
Рис. 4. Удельный вес грамотрицательных и грамположительных бактерий, выделенных из рыб, выловленных в водоемах Северного Кавказа В результате питания, дыхания, размножения каждый вид микроорганизма продуцирует постоянный для него набор ферментов, определяя их биохимические свойства (табл. 1). Так все штаммы обладали оксидазоположительными свойствами, а также способностью расщеплять глюкозу, как в анаэробных, так и в аэробных условиях в среде Хью-Лейфсона с образованием кислоты, а некоторые и газа. Хорошо выражена протеолетическая активность и способность восстанавливать нитраты до нитритов. Таблица 1 Биохимические свойства различных видов бактерий из семейства Aeromonadaceae
Из-за отсутствия четкой границы между видами бактерий при изучении биохимических свойств классическим методом их внутривидовая идентификация затруднена (рисунок 5, 6).
Рис. 5. Биохимические свойства бактерий из семейства Aeromonadaceae, выделенных из сома
Рис. 6. Биохимические свойства бактерий семейства Aeromonadaceae, выделенных из осетра Возможность проведения глубокого изучения состава микрофлоры посредством анализатора MALDI-TOF позволили определить практически 100% специфичность выделенных микроорганизмов. Достоверность идентификации составила от 2,286 (В +++) до 2,424 (В +++).
При изучении биологических (вирулентных) свойств бактерий, обладающих гемолитической и протеолитической активностью, была обнаружена высокая степень их патогенности. Нами были отработаны два метода, а именно постановка биологической пробы на белых мышах массой 16-18 г и на морских свинках массой 180-200 г.
При проведении биологических исследований 48-часовую бульон-ную культуру вводили внутрибрюшинно трём белым мышам в дозе 0,5 мл. Вирулентные штаммы вызывали гибель белых мышей в течение двух суток.
Одновременно проверяли специфические свойства аэромонад на двух морских свинках, для чего из одного штамма сразу ставили две пробы на одной морской свинке (дермонекротическую и конъюнктивальную).
При постановке дермонекротической пробы культуру вводили на тщательно выстриженный участок кожи бока морской свинки внутрикожно в дозе 0,3-0,5 мл бульонной культуры. Конъюнктивальную пробу проводили, нанося на конъюнктиву глаза 2 капли испытуемой бульонной культуры с последующим легким массажем век ватным тампоном. Оба метода дали положительную реакцию в течение 2-3 суток. В первом случае вирулентные штаммы давали положительную реакцию на месте введения у морских свинок в виде образования некроза. Во втором случае у морских свинок отмечался гнойный кератоконъюнктивит.
При лабораторном исследовании на патогенность с постановкой биопробы на обычных лабораторных животных доказано, что гибель наступала через 6 - 10 часов, а реакция на дермонекротическую и конъюнктивальную - в течение 2-3 суток, что очень сильно сокращает сроки исследования по сравнению с биопробой на живой рыбе, при которой срок наблюдения составляет 10 суток.
Таким образом, можно сделать следующие выводы:
Список литературы:
Резюме. Обнаружение и идентификация возбудителей при возникновении заболевания у рыб с признаками бактериальной геморрагической септицемии является одной из важнейших задач ветеринарных врачей и ихтиопатоло-гов. Механизмы лабораторной диагностики Aeromonas hydrophila и Aeromonas salmonicida достаточно хорошо изучены для указанных возбудителей, в отличие от условно-патогенных видов бактерий данного семейства, которые лишь с недавнего времени привлекли внимание исследователей как возбудители заболевания и поэтому требуют дальнейшего изучения. В настоящее время, используя и анализируя методические указания и инструкции при лабораторной диагностики, авторы обратили внимание, что в методических указаниях за 1986 и 1997 годы и в инструкции за 1997 год указывается конкретный возбудитель и лишь в инструкции за 1998 год говорится, что возбудителями болезни являются патогенные варианты, относящиеся к роду Aeromonas, семейства Vibrionaceae. Патогенные свойства аэромонад определяют биопробой на 3 карпах массой 100-200 г из благополучных по аэромонозу водоемов. Сроки исследования по данным методических указаний и инструкций составляют 20-21 день. Также в данных методических указаний и инструкций отсутствует информация о развитии заболевания с признаками бактериальной геморрагической септицемии у других видов рыб, таких как клариевые, осетровые и других гидробионтов. В указанных выше документах отсутствует четкая дифференциальная диагностика видов возможных возбудителей, а также в связи с результатами исследований иностранных ученых, проведенных с использованием анализа 16S рРНК - нуклеотидов, получено дополнительное основание для отделения семейства Aeromonadaceae от семейства Vibrionaceae. Поэтому разработка методических указаний по лабораторной диагностике аэромоноза с признаками бактериальной геморрагической септицемии для разных видов рыб и гидробионтов является актуальным вопросом в связи с тем, что с течением времени происходит изменение видового состава возбудителя за счет развития эмерджентной инфекции у рыб, а применение обычных лабораторных животных позволило сократить срок исследования и является более доступным методом для лабораторий разного уровня.
Ключевые слова: рыба, карповые, клариевые, осетровые, бактерии Aeromonas, возбудитель, условно-патогенные виды аэромонад, патогенные свойства, эмерджентная инфекция, биологическая проба, лабораторные животные.
Сведения об авторах:
Басанкина Виктория Михайловна, ветеринарный врач отдела бактериологии ФГБУ «Краснодарская межобластная ветеринарная лаборатория», аспирант Краснодарского научно-исследовательского ветеринарного института - обособленного подразделения Федерального государственного бюджетного научного учреждения «Краснодарский научный центр по зоотехнии и ветеринарии»; 350004, г. Краснодар, ул. Калинина, 15; тел.: 8-918-2593649; e-mail: vbasankina@mail.ru.
Пруцаков Сергей Владимирович, доктор ветеринарных наук, заведующий лабораторией эпизоотологии Краснодарского научно-исследовательского ветеринарного института - обособленного подразделения Федерального государственного бюджетного научного учреждения «Краснодарский научный центр по зоотехнии и ветеринарии»; 350004, г. Краснодар, ул. 1-я Линия, 1; тел.: 8-918-4687755; e-mail: enteroplus@mail.ru.
Ответственный за переписку с редакцией: Басанкин Алексей Вадимович, кандидат ветеринарных наук, заместитель начальника отдела организации противо-эпизоотических мероприятий и лечебно-профилактической работы департамента ветеринарии Краснодарского края; 350000, г. Краснодар, ул. Рашпилевская, 36; тел.: 8-918-9550057; e-mail: abasankin@mail.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|