|
||||

Исследование инкубационного периода при остром течении африканской чумы свинейКуриннов В.В., Балышев В.М., Шкаев А.Э., Васильев А.П., Стрижакова О.М. Введение. После первичного и последующих заносов вируса африканской чумы свиней (далее, АЧС) в Европу в XX г веке фундаментальные исследования болезни всегда сопровождались обязательными изучениями ключевых признаков инфекции: инкубационного, инфекционного периодов и продолжительности болезни до гибели [27, 32]. Так как наблюдения эпизоотий и отдельных вспышек АЧС в популяциях домашних свиней в Африке, Европе и Латинской Америке "представили" ветеринарным врачам все известные формы течения болезни (сверхострую, острую, подострую. хроническую, латентную) продолжительность инкубационного периода, оценённая разными авторами, была приблизительной.
Наиболее обширные наблюдения естественных инкубационных периодов при остром течении АЧС были на Пиренейском полуострове в 1957-1995 годах. Инкубационные периоды были представлены с очень сильным варьированием: от 3 до 15 дней [32], от 4-6 дней при остром или 6-8 дней - при подостром течении [13], а по данным Ordas A. [27] - от 4 до 10 дней и даже до 20 дней. По сообщениям R. Carnero [14] при вспышках АЧС во Франции диапазоны колебаний инкубационного периода были минимальными - от 2-4 дней, - максимальными - до 10 дней.
После экспериментальных экспозиций свиней вирулентным вирусом АЧС, даже несмотря на определённую контролируемость дозы и пути заражения величины инкубационных периодов также варьировали. По сообщению Hammond R. [16] штамм "Hinde" (выделен от бородавочника) у домашних свиней индуцировал первую гипертермию на 12-й день, а после нескольких пассажей на домашних свиньях - на 4-й день [23]. Коваленко Я.Р. [7] после инокуляции свиней (подкожно или внутримышечно) разными дозами португальского штамма "L 60" в дозах от 10 до 106ЛД50 определил инкубационный период 3-4 дня. Mebus C.A. [23] после интраназально-оральной экспозиции 105,8 ГАЕ50 того же вирулентного штамма "L-60" и 104,7 ГАЕ50 умеренновирулентного штамма "DR" (изолят, вызвавший вспышки АЧС в Доминиканской республике) установил сходные по продолжительности инкубационные периоды для обоих штаммов, то есть 2-4 дня, соответственно. Ordas A. и M.A. Мarcotegui [27] после экспериментальной инфекции, вызванной инокуляцией вирулентного штамма вируса АЧС, циркулировавшего на территории Испании, первые признаки лихорадки наблюдали на 2-5-й день.
Другие авторы при изучении биологических свойств (вирулентности), патогенеза болезни или оценке лабораторных диагностических методов после экспериментальных заражений свиней АЧС "европейскими" ("European 70" [38], "Ourique" [12], "латино-американскими" [4] и африканскими ("Kirawira" [36], "Malawi Lil-20/1" [17, 18] "АМ/86" "САМ/88" "САМ/86" [15], "Pr4/96" [38], "MOZ/1/98" [28]) изолятами разного происхождения, в том числе и от клещей, определяли также сильно варьирующие по продолжительности инкубационные периоды (минимально - от 2-х, максимально - до 8 дней).
После контактной передачи вирулентного вируса АЧС инкубационные периоды у реципиентов (при совместном содержании с донором в течение 24 часов, инфицированным этим же штаммом вируса) имели ещё более сильные вариации, от 5-ти до 16-ти дней [6] или от 3-х до 19-ти дней [15, 17, 18, 27, 28, 36, 38].
В современных отечественных публикациях, посвящённых описаниям полевых вспышек в 2008-2013 годах и экспериментальным исследованиям АЧС in vivo, авторами подтверждено острое течение инфекции с геморрагическим синдромом и высокой летальностью [1, 2, 8, 9, 10, 11], однако, сведения о продолжительности инкубационных периодов были ограничены только единичными статьями. Так Белянин С.А. [2] после внутримышечной и/или интраназальной инокуляции полевых изолятов от павших свиней или диких кабанов при вспышках АЧС в РФ в 2008-2013 годах среднюю величину продолжительности экспериментального инкубационного периода определил 3 дня с очень коротким диапазоном - 2-4 дня. По данным Варенцовой А.А. [3], после интраназальной инокуляции 2-х изолятов вируса от вспышек АЧС домашних свиней в 2013 году в разных дозах (50-5000 ГАЕ50) время первой гипертермии у разных животных варьировало более выраженно - от 3-х до 10-ти дней.
В сложной эпизоотической ситуации по АЧС отсутствие утверждённого инкубационного периода в действующей Инструкции [5] приводит к дилемме для эпизоотологов: либо использовать время диапазона 4-19 дней, указанное в Руководстве МЭБ по лабораторной диагностике [22], либо только тенденциозный максимальный показатель 15-ти дней, указанный в Наземном Кодексе МЭБ [34]. Это сильно затрудняет работу эпизоотологов при расследованиях вспышек (расчёты для определения даты заноса вируса на ферму и способа заражения, идентификацию вторичных вспышек), определение длительности карантина, торговле при транспортировке живых свиней или полутуш из 2-й угрожаемой зоны.
Таким образом, отсутствие утверждённого инкубационного периода на стадии контроля и ликвидации АЧС в Российской Федерации является актуальной проблемой. В научных исследованиях для изучения патогенеза и оценки эффективности лабораторных методов также требуется использование утверждённого статистически подтверждённого показателя инкубационного периода.
Цель исследования - на основании статистического анализа данных выборок инкубационных периодов, взятых из публикаций, экспериментальных моделей острой инфекции АЧС и объединённых наблюдений определить формулу полного инкубационного периода при АЧС и дать рекомендации для его практического применения.
Материалы и методы.
Выборка данных инкубационных периодов из публикаций.
Всего было идентифицировано и использовано 16 ранних (1958-1999 годы) и 5 поздних (2004-2013 годы) публикаций, а также 2 официальных документа МЭБ с представленными величинами инкубационных периодов, из которых в 4-х работах были наблюдения естественных экспозиций (то есть наблюдения при вспышках), а в 17-ти - после экспериментальных заражений домашних свиней вирулентными изолятами или штаммами вируса АЧС африканского и "неафриканского" происхождения. В таблице 1 представлены объединенные суммарные сведения публикаций, из которых часть содержали оригинальные сведения по инкубационному периоду, началу лихорадки и/или продолжительности болезни после экспозиции, из которых для статистического анализа были выбраны данные Коваленко Я.Р. [5, 6], W. Plowright [30, 31], Wilkinson, PJ. [36, 37], Thomson G. [35], Вильямс К.Д.[4], Mebus C.A. [23], Zsak L. [38], Kleiboeker S.B. [18], Ekue N.F. [15], Howey E. [17], Варенцовой А.А. [3]. Таблица 1. Инкубационные периоды у домашних свиней при разных моделях экспозиции (дозы и пути) вирусом АЧС
Таблица 2. Год и географическое происхождение полевых изолятов вируса АЧС
Обозначение: *-ЛПХ (личное подсобное хозяйство), >1000 - свиноферма с поголовьем более 1000 гол; **- база данных Музея микроорганизмов ГНУ ВНИИВВиМ; дик- дикий кабан.
Для экспозиции свиней использовали экстракты 20%-ных суспензий селезёнок от животных, концентрация вируса в которых была определена титрованием в культуре клеток костного мозга свиней (ККМС) в величинах ГАЕ^/г . Исследования проводили на свиньях
крупной белой породы 2 - 4-х мес. возраста живой массой 20-45 кг, выращенных в Секторе подготовки подопытных животных (ГНУ ВНИИВВиМ Россельхозакадемии).
Моделирование инфекции АЧС и оценка экспериментальных инкубационных периодов, продолжительности лихорадки и продолжительности болезни. Экспозиции вируса свиньям были выполнены парентерально (методом внутримышечной инокуляции), энтерально (оро-интраназальным вливанием 3-5 мл вируссодержащей жидкости испытуемых изолятов, в которых концентрация вируса была от 10 до 105,0 и более ГАЕ50 ) и методом одно- или многократной контактной его передачи при совместном содержании реципиентов (интактных поросят) с инфицированными вирусом АЧС донорами (около 15 час). Первый донор - поросёнок, инфицированный внутримышечно 104,0 ГАЕ50 вируса АЧС и имевший гипертермию (40,8-41,10С) продолжительностью 1-2 дня. Для реципиентов последующих пассажей в качестве донора был предыдущий подсвинок, инфицированный контактно и также имевший гипертермию длительностью не менее 1-2 дней.
Для расчётов инкубационного периода в днях нулевой точкой отсчёта времени была дата инокуляции или оро-интраназального введения вируса или момент от отъёма реципиента от донора до даты первого повышения ректальной температуры тела выше 400С (при контактном пути передачи вируса). Для оценки продолжительности лихорадки подсчитывали общее время гипертермии до гибели, а продолжительность болезни - от момента экспозиции вируса (или после 15-ти час. совместного содержания при контактной передаче) до гибели в днях.
При расчётах оценок полевых инкубационных периодов использовали данные эпизоотологических расследований вспышек АЧС, когда были доступны даты введения инфицированных свиней в ферму и первичного случая (инцидента).
Для того, чтобы были максимально учтены данные экспериментального заражения применяли объединённый анализ выборок наблюдений всех инкубационных периодов, взятых из публикаций 1967-1999 годов (ранние вирусные изоляты и штаммы) и собственных исследований 2007-2015 годов (изоляты от вспышек АЧС на Кавказе и в РФ).
Статистические методы. Среднюю величину инкубационного периода оценивали по медиане (в днях) после антилогарифмирования, уровень изменчивости - расчётом фактора дисперсии с использованием метода квантилей для log-нормального распределения. Оценки кумулятивных 5, 25, 75 , 95, 97,5 и 99,7 процентилей инкубационных периодов с доверительными интервалами были получены, используя пакет программ MedCalc, версия 12.7.
Сравнения между средними величинами инкубационного периода, продолжительностью гипертермии и продолжительностью болезни оценивали тестом Манна-Уитни U, сопровождаемым Стьюдент t-тестом. Корреляция связи между переменными (продолжительность лихорадки и болезни) с инкубационным периодом были оценены коэффициентами Pearson’s. Уровень статистической значимости Р=0,05.
Результаты и обсуждение.
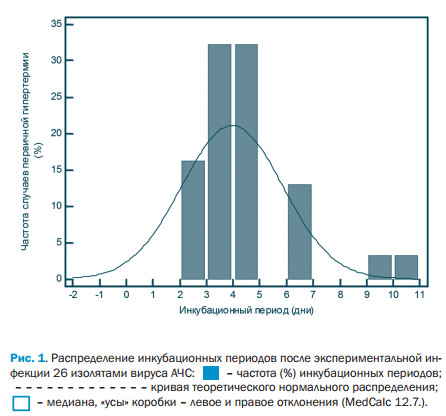
Инкубационные периоды после экспериментальной парентеральной (внутримышечной и интраназальной) экспозиции полевых изолятов вируса АЧС 2007-2015 годов. У всех подсвинков, инфицированных 26 изолятами, независимо от места, вида и времени происхождения изолята вируса, дозы и способа введения развивалась острая форма течения АЧС, а исход инфекции всегда был летальным (100%). Гистограмма (рисунок 1) распределения log-транс-формированных частот (диапазон один день) значений инкубационных периодов имела вид нормального с выраженным отклонением вправо, что согласуется с признанным log-нормальным распределением инкубационных периодов при острых инфекциях с правой асси-метрией [25, 26, 33].
После антилогарифмирования для перевода в числовые значения (в дни) расчётные величины медианы и фактор дисперсии инкубационного периода были 4,0±1,07 (95% CI 3,0-4,0) дня, средние величины продолжительности лихорадки - 6,0 (95% CI 5,0-7,0) дней, а болезни от заражения до гибели - 11,0 (95% CI 10,0-12,0) дней (табл. 3). Таблица 3. Продолжительности инкубационных периодов, лихорадки и болезни после экспериментальной внутримышечной (в/м) и интраназальной (и/н) экспозиции полевых изолятов вируса АЧС, вызвавших вспышки в 2007-2015 годах
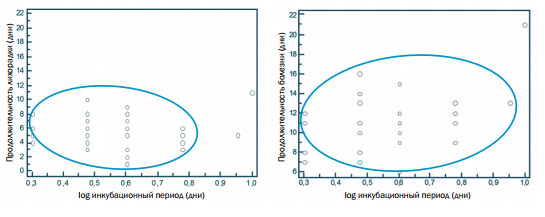
Для объяснения вариабельности инкубационного периода, а также продолжительности и изучения течения болезни (сверхострой, острой или подострой) многие исследователи часто используют влияние феномена дозо-зависимого эффекта и пути заражения. Сравнивая две выборки инкубационных периодов у свиней, заражённых изоля-тами вируса АЧС в минимальных (10 ГАЕ50) и максимальных (>105,0 ГАЕ50) концентрациях, не установлены корреляция между переменными "доза" и "инкубационный период" (r=0,2 при Р=0,4 ) и значимые различия инкубационных периодов в группах после парентеральной и энтеральной экспозиции указанных доз вируса (Р=0,78). На рисунке 2 (а,б) видно, что инкубационный период не имел практически никакой связи с продолжительностью лихорадки (г = -0,1; Р=0,7), но имел очень слабую положительную корреляцию с продолжительностью болезни (г=0,3; Р>0,05).
Рис. 2. Сравнения связи между инкубационным периодом и продолжительностью лихорадки (а) r= -0,1 (Р=0,7) и между инкубационным периодом и продолжительностью болезни (б) г= 0,3 (Р>0,05) после внутримышечной и интраназальной экспозиции разными дозами вируса Инкубационные периоды после контактной экспозиции. Очень сложно экспериментально воспроизвести передачи, экспозиции и заражающие дозы вируса, которые будут отражать все возможные естественные ситуации. Медиана, как средняя величина инкубационного периода, которая выше была определена экспериментально, отражает вероятность 4-х дневного периода только в случае попадании вируса в организм свиньи или оро-назально (например, скармливание контаминированных вирусом АЧС помоев) или внутримышечно (например, в результате иньекций вакцин или антибиотиков, но когда о заносе вируса АЧС в стадо пока ничего неизвестно). Однако, в условиях эпизоотического процесса передача вируса может произойти при контактах с инфицированными АЧС свиньями (особенно в популяциях диких кабанов) или в результате контактов с контаминирован-ным вирусом АЧС транспортом. Мы предполагаем, что хотя при любых вариантах развития случайных событий путь проникновения вируса в организм будет в основном оро-назальный, но время между попаданием вируса в клетки-мишени "в субминимальных" концентрациях и первым патофизиологическим ответом хозяина (в виде первичной гипертермии) может иметь более широкую вариацию. Поэтому для определения инкубационного периода при контактной передаче акцент был сделан на модели экспозиции вируса в течение нескольких последовательных контактов "донор-реципиент", когда человеком контролируется только заражение донора и время начала контакта с реципиентом, но доза вируса и путь заражения случайные. В качестве испытуемого вируса был выбран изолят N° 393 (табл. 2), выделенный от отстрелянного дикого кабана в Тверской области при эпизоотии АЧС в ГК "Завидово" в 2012 году. После совместного содержания в течение 15 часов с инфицированным внутримышечно вирусом АЧС донором, а также в процессе последующих 4-х контактов передача вируса была успешной. В статистический анализ, как и ранее, были включены инкубационные периоды, продолжительность лихорадки и болезни после контактной передачи полевых изолятов "Богучарский 06/2013" и Кашинский 04/2013". Результаты абсолютных значений показателей в днях (средние - после антилогарифмирования) представлены в таблице 4. Таблица 4. Схема выполнения и определения продолжительности инкубационного периода, длительности лихорадки и болезни после контактной экспозиции изолята N° 393 вируса АЧС подсвинкам
Обозначенния. * - изолят "Богучарский 06/2013"; ** - изолят "Кашинский 04/2013" [3]. Из данных таблицы 4 видно, что медиана и доверительные интервалы инкубационного периода по сравнению с внутримышечными и интраназальными заражениями была существенно выше [7,9±1,02 (95% CI 6,0-10,0) ], а также установлено различие средней продолжительности болезни - 11,0 (95% CI 10,0-12,0) дней и 15,0 (95% CI 14,019,5) дней, соответственно (Р=0,0002). Различий в продолжительности лихорадки между моделями экспозиций не установлено, 6,0 (95% CI 5,0-7,0) и 6,3 (95% CI 4,0-9,4), соответственно (Р=0,2).
Анализ результатов. В связи с тем, что результаты наших экспериментальных заражений показали правое отклонение инкубационного периода от медианы, а также по данным публикаций существенную вариабельность инкубационного периода, было необходимо объяснить потенциальный эффект различий между иерархическими (оценёнными) экспериментальными моделями инфекции и объединёнными наблюдениями, которые бы включали все известные (кроме естественных) инкубационные периоды (табл. 1). В таблице 5 представлены распределения частот (процентили) инкубационных периодов из выборок публикаций экспериментальных инфекций АЧС, данные собственных наблюдений (табл. 3, 4) и объединённой (суммарные выборки публикации и собственные).
Таблица 5. Распределения случаев первичной гипертермии для 5, 25, 50, 75, 95, 97, 5 и 99,7 процентилей (MedCalc 12.7.)
*- выборки выполнены, от экспериментальных инфекций АЧС, включая все пути экспозиции (внутримышечное, интраназальное, контактная передача) и разные дозы (табл. 3, 4) Сравнивая полученные полные распределения инкубационного периода между тремя видами анализов, мы можем видеть практически идентичные величины медианы, то есть 4 дня (50 процентиль) и 2/3 отклонений (25% - 3 дня и 75% - 5-6 дней), которые согласуются с величинами инкубационного периода, предсказанными ранее многими исследователями (табл. 1). Однако, максимальные значения инкубационного периода выборки от собственных экспериментов в 97,5 и 99,7 % случаев, хорошо отражая правое отклонение log-нормального распределения (25,33), существенно отличаются и как от расчётных максимальных величин объединённого анализа (10 дней против 15, N° 1, 3 табл. 5) так и от рекомендованных МЭБ 15-19 дней [22, 34].
Инкубационные периоды полевых наблюдений. Для того, чтобы подтвердить необходимость использования максимального инкубационного периода были оценены инкубационные периоды полевых наблюдений вспышки АЧС, когда точно были известны дата первичной экспозиции и случаи гипертермии.
Пример 1. Вспышка АЧС в подсобном хозяйстве (г. Североморск Мурманской области). Из данных эпизоотологического расследования установлено, что через 10 дней после введения инфицированного вирусом АЧС хряка (донора инфекции АЧС) у одной свиньи (реципиент) был установлен первый случай гипертермии.
Пример 2. Вспышка в свинокомплексе СПК "Большевик" (Краснодарский край) приблизительное время латенции, то есть момента введения единственной инфицированной АЧС свиньи извне ("соседство", подтверждённое также лабораторными исследованиями) в станок откормочного модуля до первого случая установления симптома болезни реципиента было 3 дня.
Первый случай укладывается в 95-й, второй - в 50-й процентиль.
Заключение и рекомендации применения инкубационного периода. Инкубационный период, как биологический признак, является одним из ключевых определителей любой инфекции. Так как по природе и происхождению вирус АЧС - африканский "эндемик", представлялось важным сравнить инкубационные периоды, оценённые разными исследователями в разные годы в прошлом и в настоящее время, после заражения "российскими" изолятами вируса АЧС и уточнить формулу инкубационного периода для практического применения. Как и у других авторов, нами были установлены статистически значимые вариации инкубационных периодов, но только на уровне их сравнения медиан и при разных способах экспозиции - парентеральном и контактном. Очевидно, этот факт имеет отношение не к свидетельству обнаружения каких-либо изменений вирулентности вируса, а скорее - к различиям в скорости проникновения вируса в клетки-мишени и времени ответной реакции хозяина на патоген. Статистически не подтверждён дозо-зависимый эффект испытуемых изолятов вируса АЧС на инкубационный период. Короткие инкубационные периоды в совокупности с короткими во времени лихорадкой и длительностью болезни после внутримышечного или интраназального заражения до гибели (100% смертность), дают веское основание считать, что все изоляты вируса АЧС, независимо от времени и пути заражения свиней (домашних или кабанов) в 2007-2015 годах имели высокую вирулентность и контагиозность, и в каждом случае (вспышки) индуцировали острое развитие инфекции у инфицированных индивидуумов.
Конечно, в условиях неблагополучия страны по АЧС, предпочтительно ужесточать временные интервалы режима проведения проти-воэпизоотических мероприятий, однако, необоснованное увеличение ограничений также вредно не только с экономической, но и с социальной точки зрения. Поэтому, для вдумчивого применения инкубационного периода целесообразно иметь данные полного распределения. Имея в виду варьирование оценок инкубационных периодов от разных исследователей, для сравнения, кроме собственных наблюдений, мы использовали опубликованные и высказанные в общем контексте эмпирические данные и объединённую выборку. Располагая общепринятым log-нормальным распределением инкубационных периодов при острых инфекциях [19, 20, 25, 26, 33] и применив общую статистику пакета программ MedCalc частоты инкубационных периодов были рассмотрены по процентилям (5-25-50 - 75-95-97,5-99,7). Это позволило, кроме медианы (50 процентиль) и фактора дисперсии, иметь данные левого (5 процентиль) и правого (99,7 процентиль) отклонений распределения от средней на 3о вправо (рис. 1). Хотя эти, последние значения можно отнести к "выскакивающим" величинам инкубационного периода, в биологическом и эпизоотологическом смыслах вероятностей событий, они очень важны в оптимизации эпи-зоотологических расследований и вводимых ограничений, и более полно понимать динамику развития вспышек АЧС и потенциальную эффективность мер контроля.
Рекомендованные МЭБ оценки инкубационного периода в основном обозначают только его центральную тенденцию, то есть одну (15 дней) или две пороговые величины (4-19 дней), которые на практике использовать весьма проблематично. Представленные максимальные распределения частот инкубационного периода дают потенциал для большего количества вариантов его использования. Так инкубационный период 2-3 дня, может быть использован для расследования ситуаций, когда проникновение вируса в группу домашних свиней имеет отношение либо к кормлению контаминированными вирусом АЧС помоями (это примерно, 70% всех вспышек АЧС в ЛПХ) или при распространении вируса "с иглы", например, при плановой вакцинации антибиотикотерапии, но при этом о заносе АЧС пока не подозревают, или при проведении биопробы в диагностических исследованиях. В качестве других примеров, использование инкубационного периода 10 дней может быть для установления первичной даты заражения в свинофермах (контактная передача), расчётов периода между диагностическими отстрелами диких кабанов. Центральный регион распределения (25-50-75 процентили) - использовать для расчётов даты заноса и потенциального источника вируса, репродукции и скорости распространения болезни, установления непредубеждённого (оптимального) периода ограничений при перемещении живых свиней и продуктов при различных эпизоотических ситуациях в свободных от АЧС зонах, а также при планировании противоэпизоо-тических мероприятий. Хотя установленный средний инкубационный период 4 дня, в случае заражения свиней вирусом АЧС, даёт надежду о быстром появлении клинических признаков и, следовательно, раннем обращении владельцев к ветеринарному врачу, всегда надо помнить, что на практике использование слишком короткого инкубационного периода может привести к недооценке, а слишком длинного - к переоценке принимаемых решений, особенно когда дата заражения часто не известна. Поэтому, в ситуациях для вынужденного продления карантина в субъекте с целью ужесточения контроля после установления вторичных вспышек АЧС или для оценки потенциала мониторинга, можно ссылаться и на более длительный максимальный инкубационный период 15 дней публикационного или объединённого анализов (табл. 5) или, даже 19 дней [33].
Таким образом, на основе статистических анализов, эпизоотической ситуации и практической целесообразности исчерпывающая формула максимальной вероятности инкубационного периода для утверждения и практического применения при АЧС может включать медиану и минимальное-максимальное значения полного квантильного распределения: 4 (2-10) дней. Список литературы:
Резюме. Представлены результаты сравнений инкубационных периодов при острой форме течения АЧС с использованием экспериментальных моделей экспозиций свиней изолятами вируса, вызвавшие 26 вспышек болезни в 20072015 годах после интродукции АЧС в РФ, информации из публикаций и объединённого анализа. На основе концепции log-нормального распределения и метода максимальной вероятности оценок для каждой сравниваемой выборки рассчитаны медиана, фактор дисперсии. С учётом вариабельности инкубационного периода случаям первой гипертермии представлены в виде кумулятивных частот при 5-25-50-75-95-97,5 и 99,7 процентилях. Во всех выборках медиана 4 дня инкубационного периода (50% процентилей) была с очень маленькой дисперсией (1,03-1,11) и значения распределения частот инкубационного периода при левом отклонении от медианы (5% процентилей) - 2,0-3,0 дня были подобны предсказанным ранее. Но значения инкубационного периода правого отклонения распределения (97,5-99,7% случаев) были 10 дней, что существенно отличалось против 15 дней, полученных из собственного статистического анализа (объединённой выборки и из публикаций) и рекомендаций МЭБ (15-19 дней). Поэтому, для утверждения и практического применения рекомендована формула инкубационного периода при АЧС, включающая центральную тенденцию -медиану и минимальное-максимальное значения полного квантильного распределения: 4 (2-10) дней. Даны предложения по практическому использованию инкубационного периода в различных ситуациях для эпизоотологического расследования, контроля и изучения АЧС.
Ключевые слова: африканская чума свиней, изоляты, экспозиция, доза, инкубационный период, медиана, дисперсия, процентиль, доверительный интервал (CI), отклонение.
Сведения об авторах:
Куриннов Виктор Васильевич, доктор ветеринарных наук, профессор, заведующий лабораторией диагностики ГНУ ВНИИВВиМ Россельхозакадемии; 601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Академика Бакулова, стр. 1; тел.: 8(49223)7-92-51; e-mail: vniivvim@petush.elcom.ru.
Балышев Владимир Михайлович, доктор ветеринарных наук, профессор, заведующий лабораторией музея микроорганизмов ГНУ ВНИИВВиМ Россельхо-закадемии; 601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Академика Бакулова, стр. 1; тел.: 8(49223)7-92-51; e-mail: vniivvim@petush. elcom.ru.
Шкаев Артём Эхкамович, кандидат биологических наук, научный сотрудник лаборатории диагностики ГНУ ВНИИВВиМ Россельхозакадемии, магистрант кафедры прикладной биотехнологии Национальный исследовательский университет Южно-Уральский государственный университет; 601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Академика Бакулова, стр. 1; тел.: 8(49223)7-92-51; e-mail: vniivvim@petush.elcom.ru.
Васильев Александр Павлович, кандидат биологических наук, старший научный сотрудник лаборатории диагностики ГНУ ВНИИВВиМ Россель-хозакадемии; 601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Академика Бакулова, стр. 1; тел.: 8(49223)7-92-51; e-mail: vniivvim@petush.elcom.ru.
Стрижакова Ольга Михайловна, кандидат ветеринарных наук, ведущий научный сотрудник лаборатории диагностики ГНУ ВНИИВВиМ Россельхозакаде-мии, 601125, Владимирская обл., Петушинский район, пос. Вольгинский, ул. Академика Бакулова, стр. 1; тел.: 8(49223)7-92-51, e-mail: vniivvim@petush.elcom.ru.
Аликова Галина Анатольевна, кандидат ветеринарных наук, руководитель Комитета ветеринарии Волгоградской области; 400005, г. Волгоград, ул. 13-й Гвардейской, 13; тел.: 8(917)8493433; e-mail: vet@volganet.ru.
Стариков Александр Михайлович, кандидат ветеринарных наук, заместитель директора ГБУ ВО "Волгоградская областная ветеринарная лаборатория": 400127, г. Волгоград, ул. Неждановой, 4; 8 (844) 295-11-08; e-mail: vet_lab@mail.ru.
Миронова Людмила Павловна, доктор ветеринарных наук, профессор, директор Ростовской областной ветеринарной лаборатории; 344010, г. Ростов-на-Дону, пер. Ахтарский, 4; тел.: 89281171431; e-mail: brucella@aaanet.ru
Шевкопляс Владимир Николаевич, доктор ветеринарных наук, профессор, начальник управления внутреннего ветеринарного надзора Россельхознад-зора России; 107139, г. Москва, Орликов переулок, 1/11; тел: 8(499)975-19-56; e-mail: shevkoplyasvn@gmail.com.
Джаилиди Георгий Анастасович, кандидат биологических наук, руководитель государственного управления ветеринарии Краснодарского края; 350000, г. Краснодар, ул. Рашпилевская, 36; тел.: 8(861)262-19-23; e-mail: dga@uv.krasnodar.ru. Ответственный за переписку с редакцией: Черных Олег Юрьевич, доктор ветеринарных наук, директор ГБУ КК "Кропоткинская краевая ветеринарная лаборатория"; 352380, Краснодарский край, г. Кропоткин, ул. Красноармейская, д. 303; 8 (86138) 6-23-14; e-mail: gukkvl50@kubanvet.ru.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|