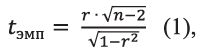|
||||

Изучение влияния различных схем вакцинации цыплят против высокопатогенного гриппа подтипа H5N1 на показатели метаболизма и гуморального иммунитетаУДК 577.112:612.1:636.5-053.2:616.98:578.832.1-085.371 Оригинальное эмпирическое исследование Васильева С.В., Тарлавин Н.В., Веретенников В.В., Хрипункова Д.С. Федеральное государственное бюджетное Аннотация. В статье описываются результаты исследования влияния различных схем применения экспериментальной кандидатной вакцины из рекомбинантного реассортантного штамма A/Syktyvkar/PR8/6:2/HA20 (H5N1) на иммуно-биохимические процессы цыплят. Цыплят-самцов яичного кросса Декалб Уайт вакцинировали однократно и двухкратно с интервалом 14 дней, начиная с первого или десятого дня жизни. У иммунизированных цыплят в возрасте 45 дней произошли изменения различной степени важнейших показателей метаболизма, которые проявлялись в увеличении интенсивности катаболических процессов. Наиболее выраженные неблагоприятные изменения - увеличение концентрации мочевины, мочевой кислоты на фоне снижения уровня холестерина и альбуминов выявлены у цыплят, которых начали вакцинировать на десятый день жизни. При этом у цыплят, иммунизированных дважды, эти изменения проявлялись более заметно и были статистически достоверны в сравнении с группой контроля. Корреляционный анализ, выполненный путём сравнения средних групповых показателей метаболизма, выявил сильную отрицательную взаимосвязь между холестерином и продуктами азотистого обмена - мочевиной и мочевой кислотой, что подтверждает зависимость анаболических и катаболических процессов у растущих цыплят от применяемой схемы иммунизации. Вакцинация, начатая в суточном возрасте, в меньшей степени отразилась на системном метаболизме, при этом однократное введение вакцины почти не повлияло на белковый, углеводный и липидный обмен птицы. Все использованные схемы вакцинации вызвали увеличение концентрации общих иммуноглобулинов на 65,9-81,6% и возрастание экстинкции циркулирующих иммунных комплексов в 3,3-8,7 раза. Полученные данные внесли важную информацию о реакции организма цыплят на различные схемы вакцинации против вируса гриппа H5N1 в течение полутора месяцев, что поможет в дальнейшем найти оптимальные условия для формирования напряжённого иммунитета. Ключевые слова: птицеводство, эпизоотология, высокопатогенный грипп птиц, метаболические процессы, биохимия крови птицы, вакцинация. Вирус H5N1 является одним из подтипов вируса грип-па А [1]. Он вызывает высокопатогенный грипп птиц, который является причиной массовой гибели диких и домашних птиц. Так, по данным ВОЗ на евразийском континенте от гриппа погибло более 100 млн птиц [2]. Оценка эффективности вакцинации против высокопатогенного гриппа птиц заключается в количественном определении специфических антител к возбудителю после проведённой иммунизации [3, 4]. Отработка оптимальных схем вакцинации заключается не только в поиске наиболее подходящих параметров - дозы, кратности введения, возраста и т.д. Не менее важной характеристикой качественной схемы вакцинации является её минимальное воздействие на нормальные физиологические процессы в организме птицы. В этой связи необходимо учитывать влияние на прирост массы птицы, а также изменения метаболизма, происходящие на фоне активной иммунизации. Вакцинация инициирует иммунный ответ, что приводит к формированию специфического иммунитета, но в этот процесс прямо или косвенно вовлекаются практически все виды обмена веществ. Немаловажную роль в этой связи играет состояние белкового обмена у вакцинированной птицы, так как антитела являются иммуноглобулинами -белками, относящимися к гамма-глобулиновой фракции [5, 6]. На фоне активного антителогенеза может меняться биосинтез структурных и функциональных белков тела птицы. В этой связи возможно количественное и качественное перераспределение аминокислот, так как в синтез иммуноглобулинов вовлекаются незаменимые кислоты, в первую очередь, лейцин, лизин, валин, которые необходимы и для образования мышечных белков. В то же время для реализации иммунного ответа потребуется и дополнительные энергетические ресурсы, что в свою очередь окажет влияние на углеводный и липидный обмен. Поэтому необходимо тщательно исследовать и обосновывать определённые схемы вакцинации с учётом возрастных особенностей птицы. Изучение воздействия вакцинации против гриппа А на метаболизм необходимо для оценки изменений показателей белкового состава крови и улучшения эффективности профилактических мер в птицеводстве. Целью нашего исследования явилась оценка влияния вакцинации против гриппа A (H5N1) на и иммуно-метаболический статус цыплят, использующих кандидатную вакцину из созданного в рамках гранта Российского научного фонда № 24-76-10044 рекомбинантного реассортантного штамма A/Syktyvkar/PR8/6:2/ HA20 (H5N1). Материалы и методы исследований. Исследования проводились в вивариях на кафедре эпизоотологии имени Урбана В.П. и в клинико-биохимической лаборатории СПбГУВМ. В работе использовались цыплята породы Декалб Уайт, которые были разделены на 5 групп по 5 особей в каждой. В эксперименте участвовали четыре опытные группы и одна контрольная. Экспериментальные группы формировались в зависимости от схемы вакцинации, представленной в таблице 1. Таблица 1 Критерии формирования групп
Взятие крови проводили у цыплят всех исследуемых групп в возрасте 45 дней. В клинико-биохимической лаборатории было проведено определение концентрации общего белка биуретовым методом, концентрации альбумина - бромкрезоловым методом, концентрация глюкозы - энзиматическим гексокиназным методом, концентрация холестерина - ферментативно-колориметрическим (CHOD-PAP), концентрация мочевины - уреазно-глута-матдегидрогеназным методом (UV-кинетика, IFCC), концентрация мочевой кислоты - энзиматическим пероксидазным методом с использованием стандартных тест-систем (производство АО «Витал Девелопмент Корпорэйшн», Санкт-Петербург) и биохимического анализатора CLIMA MC-15. Циркулирующие иммунные комплексы исследовали иммуноферментным методом с помощью микропланшетного анализатора вертикального сканирования MULTISCAN и тест-системы «ЦИК-Хема». Концентрацию общих иммуноглобулинов определяли турбидиметрическим цинк-сульфатным методом [7]. Статистический анализ данных выполнялся с использованием программного пакета Microsoft Excel. Для обработки данных применялись методы группировки, вычисления среднего значения (M) и стандартной ошибки среднего (m), также была подсчитана степень достоверности различий значений опытных групп с контрольной с использованием t-критерия Стьюдента. Была проведена оценка корреляционной взаимосвязи между всеми исследуемыми биохимическими показателями попарно по среднегрупповым значениям с вычислением коэффициента корреляции по Пирсону. Уровень значимости коэффициента корреляции определяли методом t-критерия Стьюдента по следующей формуле (1):
где t - значение критерия Стьюдента; r - выборочный коэффициент корреляции; n - объём выборки. Результаты исследований и их обсуждение. При анализе полученных результатов, представленных в таблице 2, можно отметить, что средние значения концентрации глобулинов во всех опытных группах превышают значения группы контроля. Особенно это различие выражено в 1 и 4 группах - на 39,0% и 25,7%, соответственно (P>0,05). Более высокий уровень общего белка в 1, 2, и 3 группах в сравнении с контролем обусловлен вкладом альбуминовых и глобулиновых фракций, тогда как в четвёртой опытной группе концентрация общего белка практически не отличается от контрольного значения. У цыплят 4 группы наблюдается снижение содержания альбуминов в сыворотке крови в сравнении с результатом контрольной группы. Таблица 2 Результаты исследования общего белка и его фракций в крови у цыплят
Примечание: Различия показателей по сравнению с результатами контрольной группы статистически значимы - **(P <0,01). В таблице 3 представлены результаты исследования концентрации мочевины, мочевой кислоты, глюкозы и холестерина в сыворотке крови цыплят всех исследуем
Примечание: Различия показателей по сравнению с результатами контрольной группы статистически значимы - * (P <0,05), **(P <0,01) и *** (P <0,001). Мочевина является конечным продуктом катаболизма белков и аминокислот у уреотелических животных, но не у птиц, так как из их организма азот выводится преимущественно в виде мочевой кислоты [5]. В доступной литературе имеются разноречивые сведения о возможности синтеза мочевины в организме птиц, однако имеется ряд опубликованных работ, в которых обсуждаются результаты исследования уровня мочевины в крови домашней птицы [8,9]. Доказано, что в почках у птицы высокая активность аргиназы [10], и реакция с участием данного фермента приводит к образованию цитруллина и мочевины. Основываясь на данных различных исследований этого вопроса, можно утверждать, что мочевина вполне может синтезироваться в организме птицы, вероятнее всего, в реакциях орнитинового цикла, но активность этого процесса у них значительно ниже, чем у млекопитающих. Тем не менее, нам представляется целесообразным оценить влияние вакцинации на уровень мочевины и мочевой кислоты. Учитывая то, что цыплята всех групп содержались в одинаковых условиях и получали один и тот же рацион, полученные результаты наглядно продемонстрировали признаки увеличения катаболизма белка у всех групп вакцинированных цыплят. Особенно эти процессы активируются в группах 3 и 4, в которых концентрация мочевины превышает значение контрольной группы на 38,2% и 66,3% (P<0,05) и мочевой кислоты - в 1,49 и 1,57 раза (P<0,05), соответственно. Что касается уровня глюкозы в исследуемых группах, то можно отметить относительное постоянство данного показателя и незначительные колебания при межгрупповом сравнении. Так, различие между наименьшим и наибольшим значением составляют 16,6% и не являются статистически достоверными. Однако следует отметить высокую степень однородности уровня глюкозы в первой и второй опытных группах и в группе контроля, тогда как в третьей и четвёртой группах отмечается тенденция к увеличению показателя, что может косвенно свидетельствовать о стрессорном воздействии. В отношении холестерина необходимо отметить снижение показателя в группах 2 и 3 и на 6,9% и 1,5%, а в четвертой группе отмечается достоверное уменьшение на 15,2% (P <0,05) в сравнении с контрольной группой. При исследовании циркулирующих иммунных комплексов в сыворотке крови цыплят (табл. 4) обнаруживается значительное возрастание экстинкции во всех опытных группах. Таблица 4 Результаты исследования циркулирующих иммунных комплексов и общих иммуноглобулинов в крови у цыплят
Примечание: Различия показателей по сравнению с результатами контрольной группы статистически значимы - * (P <0,05), **(P <0,01) и *** (P <0,001). Наибольшая степень формирования ЦИК выявлена в группах 2, 3 и 4 (в 7,0-8,7 раза больше в сравнении с группой контроля). В первой опытной группе показатель достоверно отличается от контрольного значения в 3,3 раза, но оказывается значительно меньше, чем в остальных опытных группах. При рассмотрении результатов исследования уровня общих иммуноглобулинов в крови цыплят обращает на себя внимание увеличение содержания общих иммуноглобулинов у цыплят всех опытных групп в целом на 65,9-81,6% в сравнении с контрольной группой (во всех опытных группах степень различия статистически достоверна). У вакцинированных цыплят обнаруживаются более высокие показатели процентного отношения уровня иммуноглобулинов как от общего белка, так и от глобулинов. В таблице 5 представлены результаты вычисления корре- ляционных взаимосвязей при сравнении среднегрупповых показателей. Примечательно, что однонаправленные изменения, характеризующиеся сильной положительной взаимосвязью, прослеживаются в отношении концентрации холестерина и альбумина, а также в отношении концентрации мочевины и мочевой кислоты. Однако при сравнении холестерина как с мочевиной, так и с мочевой кислотой выявляется сильная отрицательная взаимосвязь. При сравнении альбуминов с показателями катаболизма белка выявляется также отрицательная взаимосвязь -средняя с мочевиной (r= -0,50) и сильная с мочевой кислотой (r= -0,71). Таблица 5 Результаты вычисления коэффициентов Пирсона
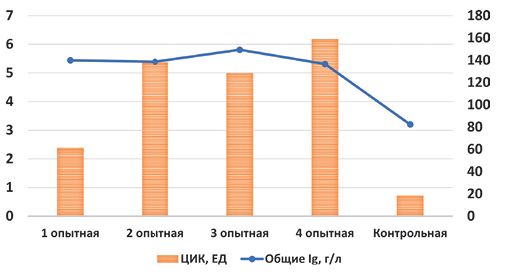
Примечание: уровни значимости коэффициента корреляции статистически достоверны - * (P <0,05) и *** (P <0,001). По результатам проведённого научного исследования, в рамках которого было изучено влияние различных схем вакцинации против вируса гриппа А (H5N1) на иммуно-биохимический статус цыплят, можно сделать ряд выводов. Содержание общего белка и его фракций иллюстрирует состояние белкового обмена и степени перераспределения биосинтеза белков, необходимых для формирования иммунитета - глобулинов, а также альбуминов, синтез которых отражает эффективность анаболических процессов. Так, можно констатировать, что у цыплят первой опытной группы активно синтезируются как альбумины, так и глобулины, в связи с чем у них довольно высокое содержание общего белка. Уровень альбуминов у цыплят, вакцинированных на первый и пятнадцатый дни жизни (2 группа), а также только на десятый день (3 группа) не отличается от контрольных значений, а в четвёртой группе, в которой цыплята прошли двухкратную вакцинацию на 10-й и 24-й дни определяется самое низкое содержание альбуминов в сыворотке крови. При исследовании крови цыплят в возрасте 45 суток после однократной или двухкратной вакцинации наблюдается увеличение концентрации общих иммуноглобулинов в сыворотке крови на 71,0-87,1% в сравнении с контрольной группой. Исходя из того, что в состав общих иммуноглобулинов у птицы входят все их классы - IgA, IgG и IgM, то можно констатировать, что у всех цыплят опытных групп в ответ на вакцинацию должным образом происходил антителогенез. Содержание в крови циркулирующих иммунных комплексов у вакцинированных цыплят также заметно выше, чем у интактных, но выявляется различие по их содержанию у привитых однократно в суточном возрасте в сравнении со всеми другими подопытными группами в 2,1-2,6 раза (рисунок 1).
Рис. 1. Содержание общих иммуноглобулинов и циркулирующих иммунных комплексов в крови у цыплят При том условии, что уровень общих иммуноглобулинов у цыплят первой опытной группы не ниже, чем у остальных вакцинированных особей, то полученный результат можно объяснить более длительным интервалом между иммунизацией и забором крови (45 дней), и это может являться по совокупности факторов благоприятным признаком. Для оценки результатов исследования важнейших показателей метаболизма рассмотрим результаты корреляционного анализа. Вполне логична положительная связь между уровнем холестерина и альбумина, так как оба показателя отражают состояние пластического обмена. Однако для биосинтеза как холестерина, так и белка необходимы не только пластические материалы, но и определённый запас энергии, поэтому синергичное возрастание этих показателей является признаком эффективности анаболических процессов. В свою очередь, мочевина и мочевая кислота, являясь конечными продуктами белкового обмена, могут увеличиваться в двух случаях - как при избытке белка в рационе, так и при активации катаболических реакций в организме. Так как все исследуемые цыплята получали одинаковый рацион кормления, то трудно объяснить увеличение уровня мочевины и мочевой кислоты у птицы третьей и четвёртой опытных групп белковым перекормом, при том, что содержание общего белка и альбуминов у них мало отличалось от такового в группе контроля. В нашем исследовании получены более высокие привесы у цыплят контрольной и первой подопытной группы, у них же выявляются более высокие концентрации холестерина. В то же время, концентрации продуктов азотистого обмена у них самые низкие, что свидетельствует о низкой степени биодеградации аминокислот и эффективному их вовлечению в синтез белков тела растущей птицы. Более выраженные процессы катаболизма у цыплят 3 и 4 опытных групп связаны, по-видимому, с наложением активной стадии поствакцинального иммуногенеза на период интенсивного прироста массы. Увеличение катаболизма аминокислот может быть связано в данной ситуации с возможным дефицитом некоторых незаменимых аминокислот (лизин, лейцина, аргинина), которые требуются в большом количестве как для антителогене-за, так и для биосинтеза мышечных белков. При таком сценарии может иметь место невостребованность отдельных аминокислот ввиду изменения потребностей птицы в нутриентах при активной иммунизации и последующем их выведении из обмена белков и переключение на окислительный метаболизм. Подводя итог проведённым исследованиям, можно сделать вывод о необходимости дальнейшего изучения различных схем вакцинации с учётом возраста и кратности иммунизации, при этом брать в расчёт не только эффективность антителогенеза, но и возможный конфликт ключевых процессов метаболизма, соответствующих определённому этапу роста и развития цыплёнка с происходящим иммунным ответом, требующим дополнительных пластических и энергетических материалов. Также целесообразно отслеживать более отдалённые эффекты различных схем вакцинации в ретроспективе. Результаты, полученные в данном пилотном исследовании, показали наиболее благоприятное и щадящее влияние на метаболизм растущих петушков однократной вакцинации против гриппа A (H5N1) в суточном возрасте. Исследование выполнено за счет гранта Российского научного фонда № 24-76-10044 «Разработка российских рекомбинантных вакцин против высоко- и низкопатогенного гриппа птиц для ветеринарного применения». Список литературы: 1. Chen W., Zhang X., Zhao W., Yang L., Wang Z., Bi H. Environmental factors and spatiotemporal distribution characteristics of the global outbreaks of the highly pathogenic avian influenza H5N1. Environmental science and pollution research (international), 2022, 29(29): 44175-44185 (doi: 10.1007/s11356-022-19016-1). 2. Русанов, Г. М. Эпидемия птичьего гриппа у кудрявых пеликанов в дельтах Дуная, Волги и Кизлярском заливе Северного Каспия весной 2015 г / Г. М. Русанов, И. В. Щеголев // Астраханский вестник экологического образования. - 2018. - № 3(45). - С. 168-174. 3. Джавадов, Э. Д. Грипп птиц / Э. Д. Джавадов, М. Е. Дмитриева. - Санкт-Петербург -Ломоносов : ГНУ Внивип Россельхозакадемии, 2011. - 188 с. 4. Джавадов, Э. Д. Ветеринарная профилактика в промышленном птицеводстве / Э. Д. Джавадов // Птица и птицепродукты. - 2008. -№ 5. - С. 32-34. 5. Конопатов, Ю. В. Биохимия животных / Ю. В. Конопатов, С. В. Васильева. - 1-е, Новое. - Санкт-Петербург : Издательство Лань, 2015. - 176 с. 6. Васильев, Р. М. Иммунологические показатели сыворотки крови коров и телят при микоплазмозе / Р. М. Васильев // Вопросы нормативно-правового регулирования в ветеринарии. - 2012. - № 3. - С. 26-29. 7. Методы ветеринарной клинической лабораторной диагностики : справочник / [И. П. Кондрахин и др.] ; под общ. ред. И. П. Кондрахина. -Москва : КолосС, 2004. 8. Куренков, Е. Е. Показатели крови перепелов при скармливании муки из высушенных личинок Lucilia Caesar / Е. Е. Куренков // Агробиотехнологии и цифровое земледелие. - 2024. - № 2(10). - С. 54-59. - DOI 10.12737/2782-490X-2024-54-59. - EDN JEMBOK.; 9. Сайфутдинова, Л. Н. Белки крови и их информативность в оценке адапатционных ресурсов кур при технологическом стрессе / Л. Н. Сайфутдинова, М. А. Дерхо // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. - 2021. - Т. 245, № 1. - С. 169-176. - DOI 10.31588/2413-4201-1883-245-1-169-176. -EDN GPGGFQ. 10. Wu, G. Arginine metabolism and nutrition in growth, health and disease / G. Wu, F.W. Bazer, T.A. Davis, S.W. Kim, Li.P. Marc // J. Amino Acids. - 2009. - Vol. 37. - No 1. - P.153-168. Сведения об авторах: Васильева Светлана Владимировна, кандидат ветеринарных наук, доцент кафедры биохимии и физиологии ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-904-6399033; e-mail: svvet@mail.ru. Веретенников Владислав Валерьевич, кандидат ветеринарных наук, старший преподаватель кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8778769; e-mail: vlad.veretennikov.96@mail.ru. Хрипункова Дарья Сергеевна, студент 4-го курса факультета ветеринарной медицины ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-904-6953600; e-mail: khripunkova.d1612@gmail.com. Ответственный за переписку с редакцией: Тарлавин Николай Владимирович, кандидат ветеринарных наук, старший преподаватель кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8430353; e-mail: tarlav1995@bk.ru. Заявленный вклад авторов: Васильева С. В.: разработка концепции и методологии, курирование данных, научное руководство, рецензирование и редактирование рукописи. Тарлавин Н. В.: административное руководство исследовательским проектом, получение финансирования, предоставление ресурсов. Веретенников В. В.: формальный анализ, валидация результатов. Хрипункова Д. С.: проведение исследования, визуализация, написание черновика рукописи. Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|