|
||||

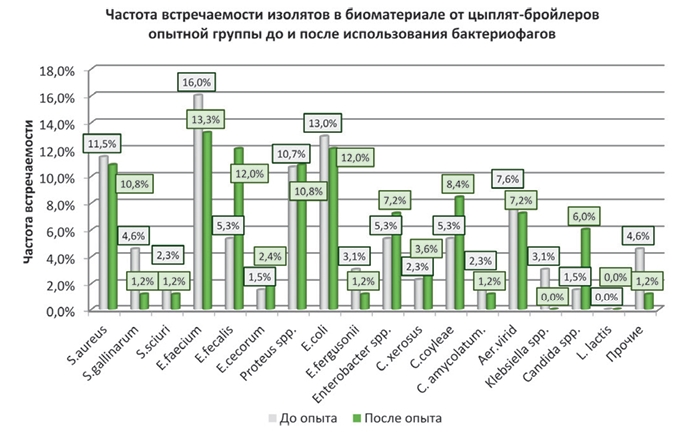
Влияние препарата бактериофага на условно-патогенную микрофлору бройлеровУДК 619:636.5.033:578.347 Кривоногова А. С., Исаева А. Г., Донник И. М., Логинов Е. А., Мусихина Н. Б. Федеральное государственное Растущая проблема антимикробной резистентности возродила интерес к применению бактериофагов в терапии инфекционных патологий человека и животных, связанных с условно-патогенными и патогенными бактериями. Имеющиеся у бактериофагов эволюционно закрепленные механизмы проникновения в бактериальную клетку позволяют им эффективно поражать штаммы, устойчивые к химиопрепаратам, а видовая специфичность определяет целенаправленное действие бактериофагов на отдельных представителей микробиома, имеющих комплементарные рецепторы, избегая негативного влияния на полезную симбионтную микрофлору [2, 4]. Основным агентом фагов, разрушающим бактериальную клеточную стенку, являются эндолизины, гидролизующие молекулы пептидогликана. Фаговые лизины также находят применение в терапии [2]. К 2017 году в базы данных INSDC было депонировано более 25 000 нуклеотидных последовательностей бактериофагов [8, 13]. Для изготовления препаратов бактериофагов применяются только высоковирулентные фаги, обладающие лизирующим действием, и которые не содержат умеренных фагов, встраивающих свои гены в геном бактерии и не вызывающих её гибели. Благодаря этому минимизируется риск переноса фагами мобильных генетических детерминант резистентности бактерий, что особенно важно в терапии инфекций, вызванных устойчивыми к антибиотикам штаммами патогенов [2, 7, 10]. К числу наиболее распространенных бактериальных патогенов, связанными с домашней птицей, относятся Salmonella spp., E. coli, Campylobacter spp. и Clostridium spp. [12]. Кроме того, микробиоценозы продуктивной птицы и окружающей среды на птицеводческих предприятиях значительно контаминированы бактериями родов Staphylococcus, Streptococcus, Pseudomonas, Acinetobacter. Исследования 5 препаратов бактериофагов для перорального введения, проведенные R.W. Miller, E.J. Skinner и соавторами (2010) на 900 цыплятах, инфицированных Clostridium perfringens, показали снижение смертности после обработки фагом на 92% по сравнению с контрольной группой [5]. Одна из вводимых рецептур (INT-401) также способствовала увеличению индексов роста, таких как увеличение уменьшение потери (WG) и индекса конверсии пищи (FCR), по сравнению с птицей в контрольной группе [11]. По данным I.B. Sklar и R.D. Joerger (2001), препарат бактериофага на порядок снижал бактериальную нагрузку Salmonella enterica у бройлеров, в том числе лизировал устойчивый к налидиксовой кислоте штамм Salmonella enterica, серовар Enteritidis (SeE Nalr) после двух недель лечения [12]. Колипротейные бактериофаги успешно использовали для терапии респираторных, менингеальных и септических форм коли-инфекции домашней птицы [1]. A. Gigante и R.J. Atterbury (2019) инфицировали штаммом E. coli (H247 K1+) трехнедельных цыплят, затем вводили внутримышечно препарат фага R в дозе 104 или 106 ПФУ. Фаг R характеризовался способностью размножаться в крови и проникать через гематоэнцефалический барьер. Смертность в группах, обработанных фагом, была нулевой, по сравнению со 100% в необработанной контрольной группе. Ни у одной из птиц, обработанных фагом, не было клинических признаков инфекции. Более того, отсрочка лечения фагом до очевидной клинической манифестации по-прежнему приводила к значительной защите, поскольку все цыплята контрольной группы погибли, а в опытной выживаемость составила 70% при позднем начале терапии. Также A. Gigante и R.J. Atterbury отмечали снижение смертности цыплят при профилактическом введении фага за два дня до заражения бактериями [9]. Результаты исследований D’Angelantonio и соавторов (2021) показали эффективность применения препаратов бактериофагов против Campylobacter jejuni у цыплят-бройлеров. Птице опытных групп вводили фаги на 38 и 39 сутки. После убоя бройлеров анализировали Campylobacter jejuni в содержимом слепой кишки и установили статистически значимое снижение обсемененности C. jejuni в обеих группах, получавших препарат, по сравнению с контрольной группой [6]. Спектр препаратов бактериофагов, разрешенных к применению в медицине и ветеринарии, позволяет использовать их для коррекции дисбиозов, лечения раневых инфекций, гнойно-септических патологий, вызванных условно-патогенными микроорганизмами, в том числе метициллин-резистентными стафилококками (MRSA), ван-комицин-резистентными энтерококками (VRE), энтеробактериями, продуцирующими бета-лактамазы [2, 3]. При этом активно исследуются новые терапевтические подходы, включающие использование бактериофагов в качестве альтернативы антибиотикам либо дополнения к традиционным схемам антибиотикотерапии. Материалы и методы исследований. Исследовали возможность применения бактериофагов в качестве альтернативы антибиотикам для нормализации микрофлоры желудочно-кишечного тракта у кур мясного кросса. Для опыта методом пар-аналогов было отобрано 30 цыплят кросса «Росс 308» из одной партии, цыплят разделили на две группы - опытную (I) и контрольную (II), обе группы поместили в стерильные боксы и содержали при одинаковых условиях до 56 суток. Кормление и поение проводили согласно технологическим инструкциям одинаково в обеих группах. В возрасте 26 суток у всех цыплят были взяты смывы из клоаки для микробиологического анализа. После этого в опытной группе цыплятам перорально давали препарат «Интести-бактериофаг» (НПО «Микроген», Россия) в дозе 1 мл/голову в сутки в течение 10 дней. Производителем заявлена активность препарата в отношении S. flexneri, S. sonnei, S. typhimurium, S. flexneri, Salmonella, Е. coli, Proteus, Enterococcus, Staphylococcus и Р. aeruginosa. Цыплята контрольной группы препарат не получали. Через 4 дня после завершения выпаивания (14 дней от начала опыта) повторно отобрали смывы с клоаки цыплят опытной и контрольной групп. Микробиологические исследования проводили в соответствии с Национальным Стандартом ГОСТ Р ИСО 20776-1-2010; Клиническими рекомендациями, утв. на Расширенном совещании Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (Москва, 15.05.2017 г.); Критериями для интерпретации категорий чувствительности по EUCAST: Clinical breakpoints - bacteria (v.10.0), по CLSI VET06.2017 1th edition. Для микробиологических исследований смывы забирали стерильным тампоном в транспортную среду CARY BLAIR. Биоматериал высевали методом истощающего посева на питательные среды. Засеянные чашки Петри инкубировали по стандартной методике с оценкой роста через 24, 48, 72 часа. Идентификацию выросших колоний производили методами классической микробиологии, а также методом MALDI-TOF масс-спектрометрии, масс-спектры рибосомальных белков сравнивали с базой данных с использованием программного обеспечения Myla. Чувствительность к антибиотикам определяли следующими методами: диско-диффузионным и последовательных микроразведеий с определением минимальной подавляющей концентрации (МПК) по стандартной методике, описанной EUCAST и ГОСТ Р ИСО 20776-1-2010. Математическую и статистическую обработку полученных результатов исследований проводили с использованием программ MS Excel и Statistica 10,0 параметрическими и непараметрическими методами. При нормальном распределении использовали t-критерий Стьюдента, в остальных случаях при анализе независимых выборок U-критерий (Манн-Уитни), при анализе зависимых выборок W-критерий (Вилкоксона). Результаты исследований и их обсуждение. Проведенные микробиологические исследования в опытной группе (I) цыплят-бройлеров после применения бактериофага показали, что частота встречаемости S. aureus не изменилась, S. gallinarum -снизилась в 3,8 раза, а S. sciuri - снизилась почти в 1,9 раза. Изоляты E. faecium после применения препарата выявляли в биоматериале опытной группы в 1,2 раза реже. При этом другие представители энтерококков, такие как E. fecalis и E. cecorum, встречались чаще - в 2,3 и 1,6 раза, соответственно. Снизилась частота выявления изолятов Escherichia fergusonii - в 2,6 раза. При этом изоляты E. coli также обнаруживали реже, чем до применения бактериофага. Установили, что после опыта в биоматериале от цыплят из группы (I) увеличилась в 1,4 раза частота встречаемости изолятов Enterobacter spp., в 1,6 раза - коринебактерий C. xerosis и C. coyleae. В отношении Proteus spp. не установили значимой динамики, а представителей Klebsiella spp. в данном микробиоценозе после опыта не обнаружили (рисунок 1).
Рис. 1. Частота встречаемости изолятов в биоматериале от цыплят-бройлеров опытной группы до и после использования бактериофагов Микробиологический анализ биоматериала цыплят-бройлеров в контрольной группе (II), в которой препарат бактериофага не применялся, показал, что частота встречаемости изолятов S. aureus, S. sciuri, Enterococcus spp., A. viridans и Candida spp. практически не изменилась. Тенденцию к увеличению выявили для изолятов Proteus spp. (в 1,2 раза), E. coli (в 1,5 раза), E. fergusonii (в 1,6 раза) и Klebsiella spp. (в 1,2 раза). При этом отметили снижение частоты обнаружения изолятов S. gallinarum, Enterobacter spp. и Corynebacterium spp. в среднем в 1,5-1,9 раза (рисунок 2).
Рис. 2. Частота встречаемости изолятов в биоматериале от цыплят-бройлеров контрольной группы до и после опыта Средняя микробная обсемененность микробиоценозов после опыта с применением препарата, содержащего бактериофаги, в разных (опытной и контрольной) группах имела отличия в отношении Staphylococcus spp., Enterococcus spp., Corynebacterium spp., Klebsiella spp., Proteus spp. и Escherichia spp. В опытной группе (I) обсемененность стафилококками составила 11x103 КОЕ/обра-зец, что в 2 раза меньше, чем в контрольной группе (II). В контрольной группе (II) также в 2,3 раза выше была обсемененность биоматериала изолятами Enterococcus spp. - 281,6x103 КОЕ/ образец. Количество КОЕ Corynebacterium spp. в опытной группе (I) было в 1,8 раза меньше, чем в контрольной (II). Изоляты Klebsiella spp. в микробиоценозе цыплят-бройлеров после проведенного опыта с бактериофагами в опытной группе (I) не встретились совсем, тогда как в контрольной группе (II) их численность составила 4,5x103 КОЕ/образец. Обсемененность кишечными палочками и Proteus spp. почти не изменилась (рисунок 3).
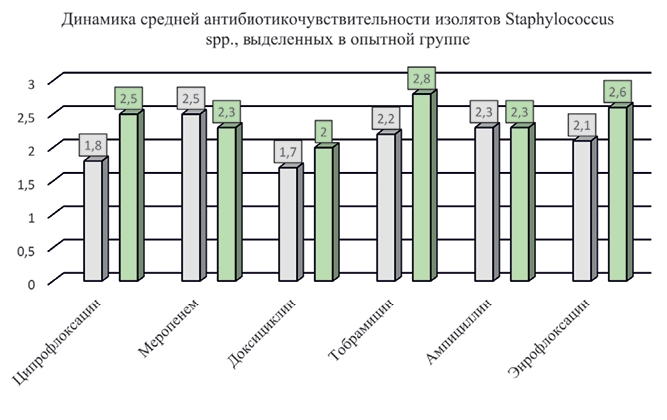
Рис. 3. Средняя микробная обсемененность биоматериала от бройлеров опытной и контрольной групп после применения бактериофагов Анализировали чувствительность изолятов к антибиотикам с оценкой от 0 (резистентность) до 3 (чувствительность). Средняя чувствительность к антимикробным препаратам изолятов Staphylococcus spp. в опытной группе (I) до применения препарата с бактериофагами составила: к ципрофлоксацину - 1,8, энрофлоксацину - 2,1, меропенему - 2,5, доксициклину - 1,7, тобрамицину - 2,2 и ампициллину - 2,3. Наиболее часто изо-ляты стафилококков проявляли хорошую чувствительность (3) к ципрофлоксацину, меропенему, тобрамицину, ампициллину и эн-рофлоксацину, когда как к доксициклину большинство изолятов имели низкую чувствительность - 1. После проведения опыта средняя чувствительность к АМП у стафилококков к ципрофлоксацину, доксициклину, тобрамицину и энрофлоксацину увеличилась до 2,5, 2,0, 2,8 и 2,6 соответственно. К меропенему и ампициллину не изменилась. После опыта увеличилось количество изолятов, чувствительных к доксициклину (рисунок 4).
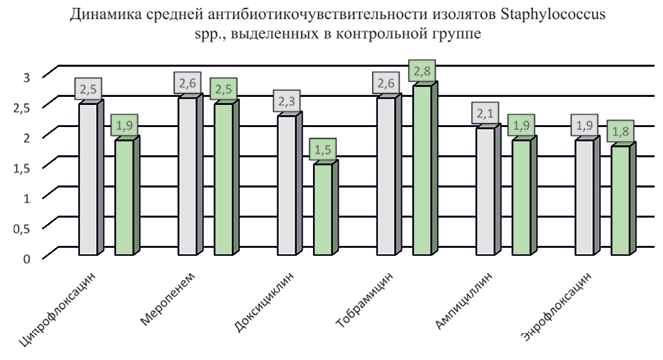
Рис. 4. Динамика средней антибиотикочувствительности изолятов Staphylococcus spp., выделенных в опытной группе (до и после применения препарата) Средняя чувствительность к антимикробным препаратам выделенных изолятов стафилококков в контрольной группе (II) перед началом опыта составила: к ципрофлоксацину - 2,5, ме-ропенему - 2,6, доксициклину - 2,3, тобрамицину - 2,6, ампициллину - 2,1 и энрофлоксацину - 1,9. При повторном отборе проб биоматериала в контрольной группе, проведенном после завершения опыта, и тестировании изолятов на АБЧ, установили, что средняя чувствительность Staphylococcus spp. к ципрофлоксацину снизилась в 1,3 раза, к доксициклину - в 1,5 раза, а к меропенему, тобрамицину, ампициллину и энрофлоксацину почти не изменилась. В смывах до начала опыта, и в смывах после опыта высевали стафилококки, которые чаще всего имели хорошую чувствительность (3) ко всем исследованным антимикробным препаратам (рисунок 5).
Рис. 5. Динамика средней антибиотикочувствительности изо-лятов Staphylococcus spp., выделенных в контрольной группе (перед началом опыта и после завершения) Анализ E. coli из биоматериала группы I, взятого до опыта, показал, что средняя чувствительность изолятов была максимальной к тобрамицину (2,4) и меропенему (2,3) и низкой к амоксициллину (0,9), левомицетину (0,3), и энрофлоксацину (0,6). После применения бактериофагов отметили тенденцию к увеличению средней чувствительности изолятов E. coli к тобрамицину, ме-ропенему, левомицетину и энрофлоксацину. Чувствительность к амоксициллину и цефазолину, напротив, снизилась (рисунок 6).
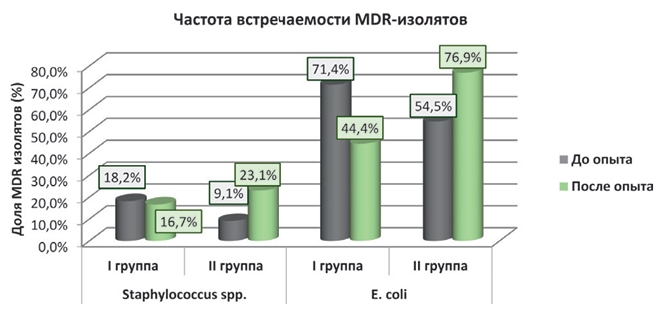
Рис. 6. Динамика средней антибиотикочувствительности изоля-тов E. coli, выделенных в опытной группе (до и после применения препарата) В контрольной группе (II) средняя чувствительность изолятов E. coli к АМП до опыта составила: к тобрамицину - 1,8, к меропе-нему - 2,6, к амоксициллину - 0,6, к левомицетину - 0,9, к цефа-золину - 1,7 и к энрофлоксацину - 0,9. После опыта отметили тенденцию к улучшению средней восприимчивости к тобрамицину и меропенему (до 2,2 и 2,8, соответственно) на фоне снижения чувствительности изолятов к остальным антибиотикам. До опыта мода чувствительности к тобрамицину и цефазолину составляла 2,0, к меропенему - 3,0, а к оставшимся - 0. В тестах изолятов, взятых после опыта, мода увеличилась у левомицетина до 1,0, а у цефазолина снизилась до 1,0 (рисунок 7). В опытной группе (I) наблюдали тенденцию к снижению частоты встречаемости мультирезистентных к антимикробным препаратам изолятов (MDR) E. coli - она уменьшилась в 1,6 раза, что могло свидетельствовать об изменении соотношения резистентных и восприимчивых штаммов в кишечном микробиоценозе после применения фагов.
Рис. 7. Динамика средней антибиотикочувствительности изо-лятов E. coli, выделенных в контрольной группе (перед началом опыта и после завершения) В контрольной группе (II) цыплят-бройлеров встречаемость MDR-изолятов в биоматериале, взятом после завершения опыта, выросла: Staphylococcus spp. - в 2,5 раза, а E. coli - в 1,4 раза (рисунок 8). Результаты полученных данных могут косвенно свидетельствовать о быстром росте числа бактерий, имеющих фенотипическую резистентность к антибиотикам в кишечном микробиоме. Предположительно, увеличение количества муль-тирезистентных к антимикробным препаратам изолятов связано с численным ростом популяции Staphylococcus spp. и E. coli, а также с горизонтальным переносом генов резистентности между бактериями в пределах смежных локусов микробиома, что согласуется с имеющимися в литературе данными [7, 10].
Рис. 8. Частота встречаемости мультирезистентных изолятов Перед убоем на 56 сутки анализировали живой вес цыплят опытной и контрольной групп (табл. 1). Таблица 1 Живой вес бройлеров опытной и контрольной групп перед убоем на 56 сутки, г
В опытной группе средний вес составил 3 997 г, а в контрольной - 3 847 г, разница составила 149,6 г. При этом разброс между крайними значениями в контрольной группе был больше (2 160 г), чем в опытной (1 736 г), а медианное значение - меньше (3 640 в контрольной группе и 3 930 в опытной). Таким образом, живой вес бройлеров опытной группы характеризовался большей однородностью при положительной разнице в среднем значении. Заключение. Проведенные исследования показали, что применение препарата бактериофага у цыплят-бройлеров оказало влияние на частоту встречаемости изолятов условно-патогенной микрофлоры в биоматериале. После опыта реже выявляли изоляты Staphylococcus spp., Enterococcus faecium, Escherichia fergusonii, а изоляты Klebsiella spp. в пробах после применения бактериофагов не обнаруживали. Также выявили тенденцию к изменению частоты встречаемости у Corynebacterium spp., Aerococcus viridans, Candida spp. В биоматериале, взятом после окончания опыта в опытной (I) и контрольной группах (II), установили различия обсемененности Staphylococcus spp. и Enterococcus faecium - в опытной (I) группе она была в среднем в 2 раза ниже, чем в контрольной (II). Полученные данные согласуются с заявленной производителем активностью бактериофага, однако виды бактерий в пределах одного рода имели разную восприимчивость к препарату, о чем косвенно свидетельствовали отличия в динамике обсемененности и частоты встречаемости изолятов. Средняя антибиотикочувствительность изолятов Staphylococcus spp. и E. coli, выделенных из биоматериала до и после опыта в обеих группах имела отличия. Изоляты Staphylococcus spp., выявленные после применения препарата с бактериофагами в опытной группе (I), проявляли более высокую чувствительность к ципрофлоксацину, доксициклину, тобрамицину и энрофлоксацину, чем изоляты, выделенные до начала опыта. В контрольной группе отметили снижение восприимчивости стафилококков к ципрофлоксацину и доксициклину. Количество MDR-изолятов Staphylococcus и E. coli снизилось в опытной группе и увеличилось в контрольной. Анализ живого веса бройлеров перед убоем показал, что применение препарата бактериофага не имело негативного влияния на данный показатель, и наоборот, среднее значение живого веса цыплят было выше на 149 г в опытной группе, получавшей бактериофаг. Таким образом, использование бактериофагов у продуктивной птицы мясных кроссов может быть перспективным для коррекции микробиоценозов и снижения их обсеменённости изолятами, резистентными к антибиотикам, а также для профилактики дисбиозов. Исследование выполнено за счет средств гранта Российского научного фонда (проект № 18-16-00040 П). Список литературы: 1. Барроу, П. Использование литического бактериофага для борьбы с экспериментальной септицемией и менингитом, вызванным кишечной палочкой, у цыплят и телят / П. Барроу, М. Ловелл, А. Беркьери // Клин. Диагн. Лаб. Иммунол. -1998. - № 5 (3). - C. 294-298. 2. Перепанова, Т. С. Терапевтическое применение бактериофагов: назад в будущее / Т. С. Перепанова, А. В. Казаченко, П. Л. Хазан, Ю. А. Малова // Клиническая микробиология и антимикробная терапия. - 2021. - Т. 23. - № 1. - C. 55-64. 3. Bacteriophage EF-P29 Efficiently Protects against Lethal Vancomycin-Resistant Enterococcus faecalis and Alleviates Gut Microbiota Imbalance in a Murine Bacteremia Model / M. Cheng, J. Liang, Y. Zhang [et al.] // Front Microbiol. - 2017. -No. 8. - p. 837. 4. Bacteriophage receptors, mechanisms of phage adsorption and penetration into host cell / D. V. Rakhuba, E. I. Kolomiets, E. S. Dey, G. I. Novik // Pol J Microbiol. -2010 - Vol. 59. - pp. 145-155. 5. Bacteriophage therapy for control of necrotic enteritis of broiler chickens experimentally infected with Clostridium perfringens. / Miller, R.W.; Skinner, E.J.; Sulakvelidze, A.; Mathis, G.F.; Hofacre, C.L. // Avian Dis.- 2010. - 54.- 33-40. 6. Bacteriophage Therapy to Reduce Colonization of Campylobacter jejuni in Broiler Chickens before Slaughter/ D. D’Angelantonio, S. Scattolini, A. Boni [et al.] // Viruses. - 2021. - Vol. 13 (8). - pp. 14-28. 7. Forecasting the dissemination of antibiotic resistance genes across bacterial genomes / M.M.H. Ellabaan, C. Munck, A. Porse [et al.] // Nature Communications. -2021. - No. 12. 8. Kakasis A., Panitsa G. Bacteriophage therapy as an alternative treatment for human infections. A comprehensive review. - Int J Antimicrob Agents. - 2019. -No. 53 (1) - pp. 16-21. 9. Gigante A., Atterbury R. J. Veterinary use of bacteriophage therapy in intensively-reared livestock. - Virol J. - 2019. No. 16 (1). - p. 155. 10. Lerminiaux N. A., Cameron A. D. S. Horizontal transfer of antibiotic resistance genes in clinical environments. - Canadian Journal of Microbiology. - 2019. -No. 65 (1). - p. 34-44. 11. Phage Therapy in Veterinary Medicine / R. Loponte, U. Pagnini, G. Iovane, G. Pisanelli // Antibiotics. - 2021. - No. 10 (4). - p. 421. 12. Sklar I. B., Joerger R. D. Attempts to utilize bacteriophage to combat Salmonella Enterica Serovar Entemtidis infection in chickens. - J. Food Saf. - 2001. -21. - p. 15-29. 13. Wernicki A., Nowaczek A., Urban-Chmiel R. Bacteriophage therapy to combat bacterial infections in poultry. - Virol J. - 2017. - No. 14 (1). - p. 179. Сведения об авторах: Кривоногова Анна Сергеевна, доктор биологических наук, доцент, ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта,42; тел.: 8-343-371-33-63; e-mail: tel-89826512934@yandex.ru. Донник Ирина Михайловна, доктор биологических наук, профессор, академик РАН, заведующий кафедрой инфекционной и незаразной патологии ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-343-371-33-63; e-mail: ktqrjp7@yandex.ru. Логинов Егор Александрович, аспирант факультета ветеринарной медицины ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; e-mail: loginov.ea19@gmail.com. Мусихина Нина Борисовна, старший преподаватель кафедры инфекционной и незаразной патологии ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург ул. К. Либкнехта, 42, e-mail: musikhina83@mail.ru. Резюме. Исследовали возможность применения бактериофагов для коррекции состава микробиоценоза желудочно-кишечного тракта у цыплят-бройлеров. Опытной группе цыплят выпаивали препарат, содержащий бактериофаги, активные против условно-патогенных и энтеропатогенных бактерий - S. flexneri, S. sonnei, S. typhimurium, S. flexneri, Salmonella, Е. coli, Proteus, Enterococcus, Staphylococcus и Р. aeruginosa. Установили, что использование препаратов бактериофага оказывало положительный эффект на состав микрофлоры кишечника бройлеров, уменьшая в его структуре долю клинически значимых условно-патогенных бактерий, в том числе, имеющих резистентность к антибиотикам. После использования бактериофагов снизилась частота встречаемости изолятов Staphylococcus spp., Enterococcus faecium, Escherichia fergusonii, Klebsiella spp. в биоматериале цыплят опытной группы. В опытной группе увеличилась средняя чувствительность изолятов Staphylococcus spp. после применения бактериофагов - к ципрофлоксацину - в 2,5 раза, к доксициклину - в 2, к тобрамицину - в 2,8 раза и к энрофлоксацину - 2,6 раза. В контрольной группе отметили снижение восприимчивости стафилококков к ципрофлоксацину и доксициклину. Количество MDR-изолятов Staphylococcus и E. coli снизилось в опытной группе и увеличилось в контрольной. При этом у получавших бактериофаг бройлеров была отмечена положительная тенденция увеличения живой массы к сроку убоя. При этом среднее значение живого веса было выше на 149 г в опытной группе, получавшей бактериофаг. Таким образом, использование бактериофагов у продуктивной птицы мясных кроссов может быть перспективным для коррекции микробиоценозов и снижения их обсеменённости изолятами, резистентными к антибиотикам, а также для профилактики дисбиозов. Ключевые слова: poultry farming, broiler chickens, meat cross, bacteriophage, antimicrobial resistance, intestinal microflora, microbial contamination, opportunistic bacteria, enteropathogenic bacteria, microbiocenosis, isolate. Ответственный за переписку с редакцией: Исаева Альбина Геннадьевна, доктор биологических наук, доцент, профессор кафедры инфекционной и незаразной патологии, Федеральное государственное бюджетное образовательное учреждение высшего образования «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-343-371-33-63; e-mail: isaeva.05@bk.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|