|
||||

Молочнокислые и спорообразующие бактерии: формирование сообществ как основы функциональных добавок с пробиотическими свойствами для птицеводстваУДК 579.62 Мухаммадиев Риш. С., Мухаммадиев Рин. С., Валиуллин Л. Р. Федеральное государственное бюджетное научное учреждение Для коррекции вызванных действием патогенных фак-торов микроэкологических нарушений кишечника молодняка сельскохозяйственной птицы особое значение приобрела заместительная терапия, направленная на регулярное введение живых пробиотических микроорганизмов [12]. Согласно определению, который сформулирован членами группы экспертов ФАО и ВОЗ, «пробиотики» представляют собой «живые активные штаммы различных микроорганизмов, приносящих пользу здоровью организма хозяина при их использовании в необходимых количествах» [7]. Аспекты их действия связаны с воздействием их на кишечную микробиоту стимуляцией иммунных механизмов слизистой оболочки кишечника и активизацией неиммунных механизмов за счет антагонизма/конкуренции с потенциальными условно-патогенными и патогенными микроорганизмами. Эффективность пробиотических препаратов определяется многими факторами, в связи этим при их использовании важны выбор микробных штаммов [7, 12]. В этом плане пробиотические микроорганизмы должны соответствовать определенным требованиям: обладать способностью к подавлению широкого спектра патогенных и условно-патогенных бактерий; характеризоваться колонизационным потенциалом (выживаемость при транзите по пищеварительному тракту, адгезия к энтероцитам кишечника); не оказывать негативного воздействия на активность нормальной микрофлоры; восстанавливать кишечную микробиоту; демонстрировать позитивные эффекты на организм хозяина; являться нетоксичными и непатогенными; сохранять устойчивость и жизнеспособность в процессе изготовления лиофилизированных препаратов, при их хранении и использовании в производственных условиях [15]. В связи с тем, что на сегодняшний день пробиотическим добавкам присвоен статус GRAS (Generally Recognized As Safe) они широко применяются в кормах для сельскохозяйственных птиц [12]. В большинстве случаев в их качестве используют молочнокислые бактерия - лактобациллы (род Lactobacillus), являющиеся представителями облигатной микробиоты кишечника птицы, преобладающие в ней по численности и физиологической важности [7, 15]. В последние годы в качестве моновидовых пробиотиков и комплексных препаратов для птицеводства все больше применяют представителей рода Pediococcus и Bacillus [1, 15]. Особый интерес вызывают поливидовые добавки на основе вышеуказанных бактериальных культур, которые способны компенсировать, расширять или усиливать функциональные свойства друг друга. При разработке указанных препаратов ключевым этапом, определяющей эффективность получаемого продукта, является формирование бактериального сообщества [16]. Создание консорциума как основы поливидовых добавок представляет сложную задачу, так как в процессе выращивания различные виды бактерий способны вступать друг с другом в следующие варианты взаимодействия: антагонизм - взаимное подавление зависимого положительного фактора, который учитывается в процессе культивирования; нейтралитет - взаимодействие, при котором компоненты консорциума не оказывают воздействия на зависимый положительный фактор; синергизм -взаимная стимуляция зависимого положительного фактора [6]. В предыдущих работах нами была показана способность штаммов Pediococcus sp. PA-12, Lactobacillus sp. SG66, Lactobacillus sp. WS-90, Lactobacillus sp. IV138, Bacillus sp. GA24 и Bacillus sp. RF-45 проявлять антимикробные свойства в отношении возбудителей кишечных инфекций и микотоксикозов молодняка сельскохозяйственной птицы [2, 3, 4]. В данном исследовании была предпринята попытка по созданию на основе вышеуказанных молочнокислых и спорообразующих бактерий сообществ для возможности использования последних в качестве поливидовых пробиотических и метапробиотических добавок в промышленном птицеводстве. Цель исследований - создание бактериальных консорциумов как основы функциональных добавок с пробиотическими свойствами для возможности применения их в птицеводстве. Материалы и методы исследований. В работе использованы штаммы Pediococcus sp. PA-12, Lactobacillus sp. SG66, Lactobacillus sp. WS-90, Lactobacillus sp. IV138, Bacillus sp. GA24 и Bacillus sp. RF-45 из фонда Коллекции микроорганизмов Всероссийского научно-исследовательского института фитопатологии (Московская обл., Одинцовский р-н, Россия). Бактериальные культуры поддерживали путем периодических пересевов при (4±1)°С на агаризованные среды LB (Luria Bertani) (Condalab, Испания) и MRS (DeMan, Rogosa and Sharpe) (ФБУН ГНЦ ПМБ, Россия). Оценку биосовместимости штаммов бактерий осуществляли способом прямого совместного их выращивания на поверхности различных плотных питательных сред (капельная методика) [6, 16]. В качестве контроля жизнеспособности микробных культур служили свободные части их пятен. Выращивание бактерий проводили при температуре (37±1)оС в течение 24-48 ч. Особенности взаимодействий бактериальных штаммов выявляли визуально по характеру роста и развития их колоний: 1 тип - антагонизм: подавляющее влияние подсеваемой культуры на рост исследуемого штамма; 2 тип - нейтралитет: независимый рост исследуемой культуры; 3 тип - контактная прогрессия: стимулирующее действие исследуемого штамма подсеваемой культурой. Родовую принадлежность отобранных бактериальных штаммов устанавливали согласно морфолого-культуральным и физиолого-биохимическим их свойствам [5, 8]. Способность отобранных микроорганизмов к росту при различных температурах определяли культивированием их в агари-зованной среде MRS (для молочнокислых бактерий) и LB (для бациллы) при (15±1) и (45±1)°С в течение 48 ч [12]. Способность бактериальных штаммов к росту в условиях различной концентрации солености оценивали инкубированием их на вышеуказанных жидких средах с содержанием хлористого натрия 4 и 6,5% при (37±1)°С в течение 24 ч [8]. Для установления каталазной активности отобранных микроорганизмов на поверхность агаризованных питательных сред с выросшими на них бактериальными колониями наносили 3% раствор перекиси водорода в объеме 5 мкл [8]. По образованию пузырьков кислорода при воздействии на клетки культур перекиси водорода судили о способности исследуемых штаммов к продукции фермента каталазы. В случае появления пузырьков газа через 1-5 мин культуры относили к каталазоположительным микроорганизмам, отсутствия - каталазоотрицательным. Видовую принадлежность отобранных бактериальных штаммов подтверждали молекулярно-генетическим анализом [5]. Для проведения амплификации участка гена 16S рРНК использовали коммерческий набор Taq ДНК-полимераза и универсальные праймеры 27F (5’-GA GTT TGA TCC TGG CTC AG-3’) и 1492R (5’-ACG GYT ACC TTG TTA CGA CTT-3’) (ЗАО «Евроген», Россия). Секвенс ПЦР-фраг-ментов проводили на генетическом секвенаторе в ЗАО «Евроген» (Москва, Россия). Сравнение секвенированных нуклеотидных последовательностей с известными в GenBank (U.S. National Library of Medicine, Bethesda, Maryland, США) производили с помощью системы BLASTn (https://blast.ncbi.nlm.nih.gov/Blast.cgi, National Center for Biotechnology Information, NCBI, США). Для более точного определения особенностей взаимодействия отобранных бактерий проведено изучение динамики их роста на разработанной нами модифицированной среде MRS следующего состава: (г/л): мясо-пептонный бульон - 20,0; глюкоза - 21,0; дрожжевой экстракт - 5,0; пептон - 2,0; ацетат натрия - 4,0; сульфат аммония - 2,0; фосфат калия - 1,5; сульфат магния - 0,1; сульфат марганца - 0,05; pH среды - 6,9. Штаммы культивировали в течение 10 ч в термошейкере при (37 ± 1)°C, 50 об/мин с аэрацией. Через каждые 2 ч осуществляли отбор культуральной жидкости для подсчета количества вегетативных клеток в единице ее объема (КОЕ/мл). Имитацию транзита отобранных для создания консорциумов штаммов по пищеварительному тракту молодняка сельскохозяйственной птицы in vitro проводили последовательным инкубированием их в жидкой модифицированной среде MRS с рН 3.0 в течение 1,5 ч (соответствует желудку) и 1% желчью цыплят-бройлеров в течение 6 ч (соответствует кишечнику) [11, 12]. Начальный титр жизнеспособных клеток для L. acidophilus IV138 составил 9,01x108 КОЕ/мл, для P acidactici PA-12 -9,98x108 КОЕ/мл, для B. subtilis GA24 - 8,70x108 КОЕ/мл (контроль). Количество бактериальных клеток штаммов (КОЕ/мл) устанавливали стандартным чашечным способом или способом десятикратных разведений. В качестве среды для подсчета числа жизнеспособных клеток бактерий использовали вышеуказанную питательную среду. Субстрат-гидролизующую активность ферментов отобранных микроорганизмов определяли с использованием модифицированной агаризованной среды MRS (для молочнокислых бактерий) и синтетической среды (для бациллы), содержащей (г/л) натрия цитрат - 1,29; K2HPO4 - 9,6; (NH4)2HPO4 - 4,75; MgSO4^7H2O - 0,18 (рН 7,0±0,2) [9]. В качестве субстратов и индукторов синтеза ферментов применяли натрий карбоксиме-тилцеллюлозу, ксилан, крахмал, пектин, фитат натрия, казеин, оливковое масло, твины 20, 40, 60 и 80. Культивирование микроорганизмов осуществляли при (37±1)°C до появления вокруг их колоний зон гидролиза, по которым судили о способности бактериальных штаммов продуцировать гидролитические ферменты. Оценку способности отобранных бактерий к продукции кислот осуществляли по ГОСТ Р 56145-2014. Штаммы культивировали на LB и MRS-бульонах при (37±1)°C в течение 10-12 ч. По окончанию инкубации бактерий осуществляли отбор культуральной жидкости для установления кислотности последней. Способность отобранных штаммов к образованию сидерофоров устанавливали на дифференциальной агаризованной среде, содержащей краситель хромазурол S (CAS среда) [22]. Для посева бактерий на указанную среду применяли 12-часовые инокуляты, выращенные на MRS и LB-бульонах при (37±1)°С и 50 об./ мин. Культивирование штаммов осуществляли при (35±1)°C в течение 5 суток. По формированию зон просветлений (от синего до оранжевого) на CAS-агаре судили о способности бактерий секретировать сидерофоры. Исследование способности отобранных бактерий к продукции бактериоцинов в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы осуществляли диско-диффузионным способом [17]. Способность отобранных микроорганизмов к образованию экзополисахаридов (EPS) устанавливали на агаризованной среде, содержащей краситель рутениевый красный (Sigma, США) [25]. Для посева штаммов на питательную среду применяли 12-часовые инокуляты, выращенные на LB и MRS-бульонах (37°С, 50 об./мин). Культивирование бактерий осуществляли при (35±1)°C до появления изменений цвета их колоний. Отсутствие изменений цвета колоний свидетельствовало о способности штаммов образовывать EPS. Оценку способности отобранных бактерий к продукции метаболитов с антирадикальными свойствами осуществляли методом гашения свободных радикалов с применением реактива 2,2-ди-фенил-1-пикрилгидразила (Alfa Aesar, США) и FRAP-способом с использованием реактива феррицианида калия (Sisco Research Laboratories Pvt. Ltd., Индия) [19]. Для исследования применяли культуральную жидкость штаммов, полученной после их выращивания в питательных бульонах при (37±1)°С и 50 об./мин. Статистическую обработку трех независимых экспериментов осуществляли способом, описанным в [5]. Результаты и их обсуждение. Одним из основных требований, которые должны предъявляться к входящим в состав многовидовых добавок микроорганизмам с пробиотическим потенциалом, является их биосовместимость [16]. Тем не менее, при разработке указанных средств в большинстве случаев не проводят анализ межвидовых взаимодействий микроорганизмов, что служит причиной низкой эффективности получаемого продукта [6]. Исследование биосовместимости бактериальных штаммов, обладающих антимикробными свойствами в отношении возбудителей кишечных инфекций и микотоксикозов молодняка сельскохозяйственной птицы, чашечным методом показало, что большинство из них проявляют по отношению друг к другу взаимоотношения по типу «нейтралитет» (независимый рост исследуемых культур) (табл. 1 и рисунок 1). Таблица 1 Результаты исследования биосовместимости бактериальных штаммов с пробиотическими свойствами
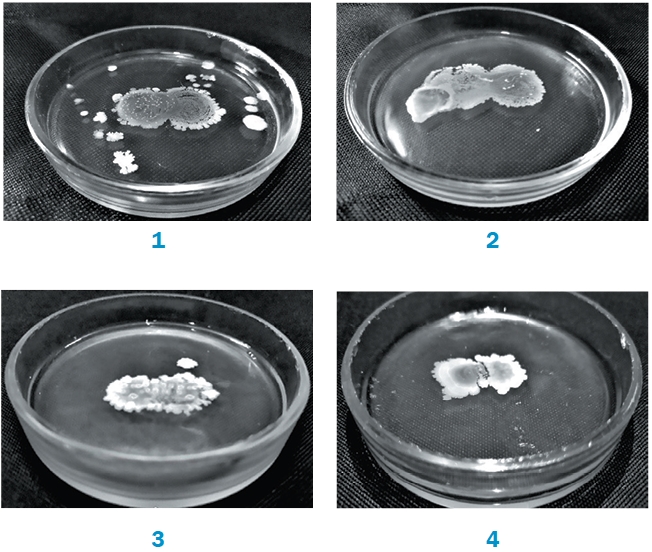
Примечание: 1 тип - антагонизм, 2 тип - нейтралитет, 3 тип -контактная прогрессия В зоне культивирования Lactobacillus sp. IV138 с Bacillus sp. GA24, Lactobacillus sp. SG66 с Bacillus sp. GA24, Lactobacillus sp. SG66 с Bacillus sp. RF-45 отмечали усиление роста исследуемых штаммов. При совместном культивировании штаммов Pediococcus sp. PA-12 и Lactobacillus sp. SG66, Pediococcus sp. PA-12 и Lactobacillus sp. WS-90, Lactobacillus sp. IV138 и Lactobacillus sp. WS-90, Bacillus sp. RF-45 и Lactobacillus sp. WS-90 наблюдали взаимодействие по типу «антагонизм». На рисунке 1 (4) показана способность штаммов Bacillus sp. RF-45 и Lactobacillus sp. WS-90 оказывать антагонистическое воздействие на друг друга, о чем свидетельствует наличие зоны задержки роста исследуемых культур.
Рис. 1. Оценка биосовместимости культур Lactobacillus sp. IV138 (слева) с Bacillus sp. GA24 (справа) (1), Lactobacillus sp. SG66 (слева) с Lactobacillus sp. IV138 (справа) (2), Bacillus sp. GA24 (слева) с Bacillus sp. RF-45 (справа) (3), Lactobacillus sp.WS-90 (слева) с Bacillus sp. RF-45 (справа) (4) методом капель С учетом полученных данных о биосовместимости, а также способности к ингибированию роста возбудителей кишечных инфекций и микотоксикозов молодняка сельскохозяйственной птицы [2, 3, 4] были отобраны наиболее перспективные штаммы Lactobacillus sp. IV138, Pediococcus sp. PA-12 и Bacillus sp. GA24. По данным анализа физиолого-биохимических особенностей и молекулярно-генетической идентификации штамм IV138 отнесен к представителю вида Lactobacillus acidophilus, штамм PA-12 - к Pediococcus acidactici, штамм GA24 - Bacillus subtilis (табл. 2 и 3). Таблица 2 Некоторые физиолого-биохимические особенности отобранных бактериальных штаммов
Примечание: (-) - отсутствие, (+) - наличие признака Таблица 3 Результаты идентификации отобранных бактериальных штаммов молекулярно-генетическим методом
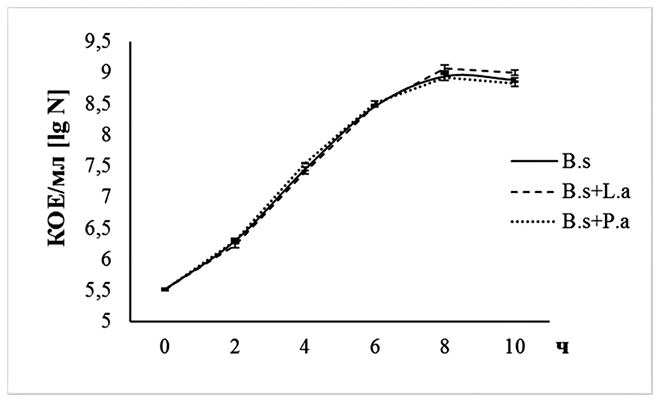
В процессе глубинного культивирования нескольких микробных видов зачастую наблюдается обусловленная процессами антагонизма смена одних микроорганизмов другими [10]. Для более точного установления особенностей взаимодействия отобранных штаммов проведено изучение динамики роста их клеток на предложенной нами жидкой модифицированной среде MRS, позволяющей осуществлять совместное культивирование различных видов молочнокислых и спорообразующих бактерий. Большинство из отобранных штаммов в условиях совместного их глубинного культивирования не оказывали существенного влияния на развитие друг друга (рисунок 2 и 3). Исключение составили штаммы L. acidophilus IV138 и B. subtilis GA24, совместное культивирование которых на 10 ч роста приводило к статистически значимому повышению количества их клеток в 2,24 (4,27x109 КОЕ/мл) и 1,32 (1,00x109 КОЕ/мл) раза, соответственно, по сравнению с содержанием бактерий в монокультурах (соответственно 1,91x109 КОЕ/мл и 7,59x108 КОЕ/мл) (р<0,05).
Рис. 2. Изменение содержания жизнеспособных клеток (КОЕ/мл) L. acidophilus IV138 (слева) и P. acidactici PA-12 (справа) при их культивировании на жидкой модифицированной среде MRS совместно с исследуемыми бактериальными штаммами (различия между значениями количества клеток L. acidophilus IV138 и L. acidophilus IV138 в условиях совместного его роста с B. subtilis GA24 на 6-10-е часы культивирования статистически значимы при p=0,05) (L.a+P.a - количество клеток L. acidophilus IV138 при совместном его росте с P. acidactici PA-12, L.a+B.s — количество клеток L. acidophilus IV138 при совместном его росте с B. subtilis GA24, P.a+L.a - количество клеток P. acidactici PA-12 при совместном его росте с L. acidophilus IV138, P.a+B.s -количество клеток P. acidactici PA-12 при совместном его росте с B. subtilis GA24)
Рис. 3. Изменение содержания жизнеспособных клеток (КОЕ/мл) B. subtilis GA24 в условиях глубинного его выращивания на модифицированной среде MRS в присутствии штаммов L. acidophilus IV138 и P. acidactici PA-12 (различия между значениями количества клеток B. subtilis GA24 и B. subtilis GA24 при совместном его росте со штаммами молочнокислых бактерий статистически не значимы при p=0,05) (B.s+L.a - количество клеток B. subtilis GA24 при совместном его росте с L. acidophilus IV138, B.s+L.a - количество клеток B. subtilis GA24 при совместном его росте с L. acidophilus IV138, B.s+P.a - количество клеток B. subtilis GA24 при совместном его росте с P. acidactici PA-12) Необходимо отметить, что накопление биомассы исследуемых штаммов при совместном и раздельном их культивировании на жидкой модифицированной среде MRS достигал максимальных значений к 8-10 ч роста. Это свидетельствует о переходе бактериальных культур в стационарную фазу роста, что делает дальнейшие испытания по повышению времени их выращивания нецелесообразным. Данные, полученные нами в ходе установления особенностей взаимодействия бациллы и молочнокислых бактерий в условиях глубинного их выращивания, согласуются с результатами ранее проведенных зарубежными авторами аналогичных исследований, в которых установлено, что штаммы Bacillus subtilis оказывают стимулирующий эффект на рост Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus rhamnosus, Lactobacillus reuteri, Streptococcus lactis, Lactobacillus casei, Lactobacillus murinus, и не оказывают существенного воздействия на данный параметр Pediococcus acidactici [10, 18, 20, 21, 23]. Согласно теории «Биологического захвата кислорода» («Biological OxygenCapturing Theory»), создаваемая при росте B. subtilis анаэробная среда играет ключевое значение в процессе стимуляции роста лактобактерий [24]. За рубежом начали появляться сведения, которые касаются способности образуемых бациллами метаболитов, включая поверхностных белков, субтилизина, антиоксидантных (каталаза, супероксиддисмутаза) и гидролитических (амилаза, протеаза) ферментов, стимулировать в модельных условиях развитие тест-культур молочнокислых микроорганизмов [20, 21, 24]. На основании полученных результатов составлены бактериальные сообщества, включающие L. acidophilus IV138 и P. acidactici PA-12 (консорциум № 1), L. acidophilus IV138 и B. subtilis GA24 (консорциум № 2), P. acidactici PA-12 и B. subtilis GA24 (консорциум № 3), с целью дальнейшего исследования их в качестве основы поливидовых пробиотиков и метапробиотиков для птицеводства. Входящие в состав поливидовых добавок микробные штаммы должны соответствовать определенным требованиям, одним из которых является наличие их колонизационного потенциала, а именно, выживаемости при транзите по пищеварительному тракту сельскохозяйственных животных [15, 23]. Штаммы с пробиотическими свойствами способны утрачивать до 99,9% своего функционального потенциала к моменту попадания в кишечник молодняка птицы вследствие воздействия на них различных стресс-факторов его желудочно-кишечного тракта. После последовательного выдерживания L. acidophilus IV138, P. acidactici PA-12 и B. subtilis GA24 в среде с рН 3.0 в течение 1,5 ч (соответствует желудку) и 1% желчью цыплят-бройлеров в течение 6 ч (соответствует кишечнику) их выживаемость составила соответственно 29,6 (2,67*108 КОЕ/мл), 52,2 (5,21*108 КОЕ/мл) и 65,8 (5,72*108 КОЕ/мл)% относительно числа микроорганизмов (на единицу объема суспензии) в начале эксперимента (рисунок 4).
Рис. 4. Выживаемость отобранных штаммов в условиях in vitro, имитирующих их транзит по пищеварительному тракту молодняка сельскохозяйственной птицы (различия между значениями количества жизнеспособных бактериальных клеток P. acidactici PA-12 после инкубации в среде с рН 3.0 и P. acidactici PA-12 после выдерживания в среде с 1 % желчью статистически не значимы при p=0,05; содержания B. subtilis GA24 после инкубации в среде с рН 3.0 и B. subtilis GA24 после выдерживания в среде с 1 % желчью статистически не значимы при p=0,05) Результаты, полученные нами в процессе исследования устойчивости отобранных бактерий к основным стресс-факторам пищеварительного тракта молодняка птицы, позволяют рассматривать их в качестве основы моновидовых пробиотиков для промышленного птицеводства. На сегодняшний день на рынке кормовых добавок особое внимание привлекают препараты, которые состоят из различных активных штаммов и обладают комплексным действием, например, совмещают свойства пробиотика и фермента [5]. Проявлением пробиотических функций штаммов молочнокислых бактерий и бацилл может являться способность их к продукции физиологически активных соединений - гидролитических ферментов, которые играют значимую роль в процессе пищеварения, улучшая перевариваемость компонентов рациона (пшеница, рожь, ячмень, овес, соя, отруби, подсолнечный жмых, подсолнечный шрот, и др.) с высоким содержанием некрахмалистых полисахаридов (арабиноксиланы, целлюлоза, в—глюканы, (галакто) маннаны, пектиновые соединения, и др.) и, повышая всасывание питательных соединений в кишечнике сельскохозяйственных животных [12, 13]. В таблице 4 представлены результаты исследования способности штаммов L. acidophilus IV138, P. acidilactici PA-12 и B. subtilis GA24 к продукции кормовых ферментов. Таблица 4 Способность отобранных штаммов к образованию биологически активных соединений
Примечание: (-) - отсутствие, (+) - наличие признака Из числа отобранных бактерий, только штамм L. acidophilus IV138 не гидролизовал полисахариды ксилан и пектин, штамм P. acidilactici PA-12 - целлюлозу. Оба штамма не обладали способностью образовывать внеклеточные ферменты пектиназного комплекса. Наиболее активным штаммом относился B. subtilis GA24, ферменты которого одновременно расщепляли несколько субстратов. Ранее нами было установлено, что бациллярный штамм GA24 на среде с ксиланом в концентрации 1,0 % и пептоном в концентрации 0,75 % на первые сутки глубинного его культивирования синтезирует внеклеточные ксиланазы и протеазы с ферментативной активностью (9,9±0,3) и (51,3±1,3) Ед/мл, соответственно [13]. Данные, полученные в результате исследований, свидетельствуют о характерных особенностях образования внеклеточных ферментов отобранных штаммов, что открывает перспективу создания на их основе взаимно дополняющих по спектру секретируемых гидролаз и усиливающих свойства друг друга сообществ, использование которых в птицеводстве значительно повысит эффективность гидролиза ими, прежде всего, антипитательных факторов (некрахмалистых полисахаридов) кормов, и, тем самым, способствуя снижению вязкости химуса, модулированию кишечной микробиоты и нормализации процесса пищеварения сельскохозяйственных птиц, положительному влиянию на обмен веществ в макрорганизме, скорость роста и их продуктивность, уменьшению уровня затрат рациона на единицу получаемой продукции. С целью возможности создания добавок с антимикробным, антитоксическим, антиоксидантным и иммуномодулирующим потенциалом для птицеводства определяли способность штаммов L. acidophilus IV138, P. acidilactici PA-12 и B. subtilis GA24 к образованию кислот, сидерофоров, бактериоцинов и экзополисаха-ридов (EPS). Установлено, что L. acidophilus IV138 и P. acidilactici PA-12 секретировали в окружающую среду кислоты, однако не обладали способностью образовывать сидерофоры (табл. 4). Из указанных молочнокислых бактерий только L. acidophilus IV138 синтезировал EPS в условиях роста, использованных в нашем исследовании. Наиболее активным штаммом в плане продукции широкого спектра биологически активных соединений оказался B. subtilis GA24. Бациллярный штамм продуцировал 3 из 4 проанализированных антимикробных метаболитов, а именно сидерофоры, бактериоцины и EPS. Необходимо отметить, что все исследуемые бактерии были способны образовывать в культуральном супернатанте соединения с антиоксидантными свойствами (результаты не показаны). Процесс образования биологически активных метаболитов молочнокислыми и спорообразующими микроорганизмами, прежде всего, обусловлен условиями выращивания (кислотность, температура и аэрация), составом культуральной среды (источники питания), фазой роста и особенностями их генома, обусловливающей штаммоспецифические свойства [5, 11, 12, 14, 17, 19, 25]. Результаты наших исследований согласуются с данными, полученными отечественными и зарубежными авторами, установившие способность штаммов L. acidophilus, P. acidilactici и B. subtilis к образованию внеклеточных гидролитических ферментов и соединений с антимикробным потенциалом [1, 11, 12, 15, 17, 23]. Заключение. В результате исследований созданы консорциумы на основе отобранных молочнокислых и спорообразующих бактерий, проявляющих антимикробные свойства в отношении возбудителей кишечных инфекций и микотоксикозов молодняка сельскохозяйственной птицы. Входящие в состав подобранных консорциумов бактерии обладают высокой степенью желче- и рН-устойчивости, способностью к образованию гидролитических ферментов (целлюлаза, ксиланаза, амилаза, пектиназа, фитаза, протеаза и липаза) и антимикробных метаболитов (кислоты, сидерофоры, бактериоцины и экзополисахариды), что определяет их перспективность для использования в качестве добавок с пробиотическим эффектом в птицеводстве. Работа выполнена при финансовой поддержке гранта Президента Российской Федерации № МК-2439.2022.5 (соглашение № 075-15-2022-414/1 от «30» марта 2023 г.). Авторы выражают огромную благодарность Шамилю Завдатовичу Валидову (НИЛ «Микробные биотехнологии» ИФ-МиБ Казанского (Приволжского) федерального университета), Алексею Анатольевичу Набатову (кафедра биохимии Казанского государственного медицинского университета) и Татьяне Вадимовне Багаевой (кафедра биохимии, биотехнологии и фармакологии ИФМиБ Казанского (Приволжского) федерального университета) за помощь и ценные советы по проведению аналитических экспериментов. Список литературы: 1. Альтернативное решение по снижению применения в птицеводстве антибактериальных препаратов за счет коррекции микробиоты кишечника птицы/ О.В. Молоканова, В.Н. Куркин, Л.С. Хошафян, С.Г. Дорофеева// Птицеводство. 2023. № 3. С. 29-32. 2. Антагонистическая активность новых штаммов микроорганизмов в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы/ Р.С. Мухаммадиев, Р.С. Мухаммадиев, А.С. Мухаммади-ева, Л.Р. Валиуллин// Молодежные разработки и инновации в решении приоритетных задач АПК: материалы Международной научной конференции студентов, аспирантов и учащейся молодежи, посвященной памяти академиков М.П. Тушнова и А.З. Равилова. Казань, 2022. С. 348-350. 3. Антагонистический потенциал молочнокислых микроорганизмов в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы/ Р.С. Мухаммадиев, Р.С. Мухаммадиев, В.Г. Гумеров, С.В. Рудь, Л.Р. Валиуллин// Агропромышленный комплекс: проблемы и перспективы развития: материалы всероссийской научно-практической конференции. В 4 т. Благовещенск, 2022. С. 138-144. 4. Антифунгальные свойства новых штаммов микроорганизмов/ Р.С. Мухаммадиев, Р.С. Мухаммадиев, В.Г. Гумеров, А.И. Яруллин, А.С. Мухам-мадиева, Л.Р. Валиуллин // Научные разработки и инновации в решении стратегических задач агропромышленного комплекса: материалы Международной научно-практической конференции. В 2-х томах. Ижевск, 2022. С. 186-193. 5. Бактерии - антагонисты возбудителей кишечных инфекций и продуценты комплекса целлюлаз как основа для создания добавок, объединяющих функции пробиотика и кормового фермента/ Л.Р. Валиуллин, Риш.С. Мухаммадиев, Рин.С. Мухаммадиев, В.И. Егоров, В.Ю. Рудь, А.П. Глинушкин// Достижения науки и техники АПК. 2021. Т. 35. № 9. С. 60-66. 6. Биосовместимость и ферментативные свойства новых пробиотических штаммов микроорганизмов/ Р.С. Мухаммадиев, Р.С. Мухамма-диев, И.Г. Каримуллина, А.И. Яруллин, В.Г. Гумеров, Л.Р. Валиуллин// Современные проблемы экспериментальной и клинической токсикологии, фармакологии и экологии: материалы Международной научно-практической конференции. Казань, 2021. С. 232-236. 7. Влияние пробиотиков Bacillus subtilis GM2 и GM5 на рост и усвояемость кормов у цыплят-бройлеров/ Г.Ф. Хадиева, М.Т. Лутфуллин, А.А. Николаева, Н.К. Мочалова, С.Ю. Смоленцев, А.М. Марданова, М.Р. Шарипова// Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2019. Т. 161, кн. 3. С. 472-489. 8. Выделение и изучение морфологических и биохимических свойств новых штаммов молочнокислых бактерий, перспективных для создания пробиотических препаратов/ А.С. Мухаммадиева, Р.С. Мухаммадиев, Р.С. Мухаммадиев, Л.Р. Валиуллин// Ветеринарный врач. 2020. № 3. С. 39-46. 9. Гидролазная активность антарктических бацилл/ А.И. Осадчая, Л.А. Сафронова, А.Н. Полтавский, В.М. Иляш// М!кробюлопя i бютехноло-пя. 2009. № 4. С. 33-40. 10. Изучение механизмов пробиотического действия штамма Bacillus subtilis 8130// Н.А. Ушакова, Е.В. Котенкова, А.А. Козлова, А.В. Нифатов// Прикладная биохимия и микробиология. 2006. Т. 42. № 3. С. 285-291. 11. Новые штаммы Bacillus subtilis как перспективные пробиотики/ Г.Ф. Хадиева, М.Т. Лутфуллин, Н.К. Мочалова, О.А. Ленина, М.Р. Шарипова, А.М. Марданова// Микробиология. 2018. Т. 87. № 4. С. 356-365. 12. Новые штаммы Lactobacillus acidophilus как перспективные пробиотики для птицеводства/ Л.Р. Валиуллин, Р.С. Мухаммадиев, Р.С. Мухам-мадиев, Р.Р. Тимербаева, И.Г. Каримуллина, А.И. Яруллин// Ветеринария Кубани. 2022. № 6. С. 16-21. 13. Оптимизация состава питательной среды пробиотического штамма B. subtilis GA24 - продуцента кормовых ферментов/ Р.С. Мухамма-диев, Л.Р. Валиуллин, Р.С. Мухаммадиев, А.С. Мухаммадиева, А.С. Сайфуллин, А.П. Глинушкин// Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2022. Т. 250. № 2. С. 155-159. 14. Особенности генома пробиотических бифидобактерий, детерминирующие их штаммоспецифические свойства/ А.Г. Точилина, И.В. Белова, Т.Н. Ильичева, В.Ю. Марченко, В.А. Жирнов, С.Б. Молодцова, А.В. Иконников, И.В. Мухина, А.С. Благонравова, И.В. Соловьева// Современные технологии в медицине. 2022. Т. 14. № 5. С. 36-44. 15. Пробиотики на основе бактерий рода Bacillus в птицеводстве/ Н.В. Феоктистова, А.М. Марданова, Г.Ф. Хадиева, М.Р. Шарипова// Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2017. Т. 159. № 1. С. 85-107. 16. Antagonistic properties and biocompatibility as important principles for development of effective and biosafety probiotic drugs/ Rish.S. Mukhammadiev, A.S. Mukhammadieva, E.V. Skvortsov, E.V. Skvortsov, L.R. Valiullin, A.P. Glinushkin// IOP Conf. Ser. Earth Environ. Sci. 2021. 663. 012008. 17. Characterization and profiling of bacteriocin-like substances produced by lactic acid bacteria from cheese samples/ S. Afrin, M.A. Hoque, A.K. Sarker, M.A. Satter, M.N.I. Bhuiyan// Access Microbiol. 2021 3(6). 000234. 18. Encapsulation of beneficial probiotic bacteria in extracellular matrix from biofilm-forming Bacillus subtilis/ S. Yahav, Z. Berkovich, I. Ostrov, R. Reifen, M. Shemesh// Artif. Cells Nanomed. Biotechnol. 2018. 46. 974-982. 19. Evaluation of dermal wound healing and in vitro antioxidant efficiency of Bacillus subtilis SPB1 biosurfactant/ R. Zouari, D. Moalla-Rekik, Z. Sahnoun, T. Rebai, S. Ellouze-Chaabouni, D. Ghribi-Aydi// Biomed. Pharmacother. 2016. 84. 878-891. 20. Evaluation of probiotic and prebiotic-like effects of Bacillus subtilis BN on growth of lactobacilli/ M. Horie, T. Koike, S. Sugino, A. Umeno, Y. Yoshida// J. Gen. Appl. Microbiol. 2018. 64(1). 26-33. 21. Improved growth and viability of lactobacilli in the presence of Bacillus subtilis (natto), catalase, or subtilisin/ T. Hosoi, A. Ametani, K. Kiuchi, S. Kaminogawa// Can. J. Microbiol. 2000. 46(10). 892-897. 22. Itkina D.L., Suleimanova A.D., Sharipova M.R. Pantoea brenneri AS3 and Bacillus ginsengihumi M2.11 as potential biocontrol and plant growthpromoting agents// Microbiology. 2021. 90(2). 210-218. 23. Kimelman H., Shemesh M. Probiotic bifunctionality of Bacillus subtilis-rescuing lactic acid bacteria from desiccation and antagonizing pathogenic Staphylococcus aureus// Microorganisms. 2019. 7(10). 407-423. 24. New crosstalk between probiotics Lactobacillus plantarum and Bacillus subtilis/ T. Yu, J. Kong, L. Zhang, X. Gu, M. Wang, T. Guo// Sci. Rep. 2019. 9(1). 13151-13160. 25. Ruas-Madiedo P., de los Reyes-Gavilan C.G. Invited review: methods for the screening, isolation, and characterization of exopolysaccharides produced by lactic acid bacteria// J. Dairy Sci. 2005. 88(3). 843-856. Резюме. В работе представлены результаты исследований по созданию на основе молочнокислых и спорообразующих бактерий консорциумов, открывающих перспективы их применения в качестве поливидовых добавок с пробиотическим потенциалом в птицеводстве. Изучено 6 бактериальных штамма, проявляющих антимикробные свойства в отношении возбудителей кишечных инфекций и микотоксикозов молодняка сельскохозяйственной птицы. Их особенности взаимодействия устанавливали в условиях совместного выращивания на плотной (капельный метод) и жидкой средах. Показано, что штаммы L. acidophilus IV138, P. acidilactici PA-12 и B. subtilis GA24 не оказывают антагонистического воздействия друг на друга. Совместное глубинное культивирование штаммов L. acidophilus IV138 и B. subtilis GA24 на 10 ч роста приводило к статистически значимому повышению количества их клеток соответственно в 2,24 (4,27 х 109 КОЕ/мл) и 1,32 (1,00 х 109 КОЕ/мл) раза по сравнению с содержанием бактерий в монокультурах (соответственно 1,91 х 109 КОЕ/мл и 7,59 х 108 КОЕ/мл). После последовательного выдерживания отобранных для создания консорциумов штаммов в среде с рН 3.0 в течение 1,5 ч (соответствует желудку птицы) и 1 % желчью цыплят-бройлеров в течение 6 ч (соответствует кишечнику) их выживаемость составила соответственно 29,6, 52,2 и 65,8 % относительно числа микроорганизмов (на единицу объема суспензии) в начале эксперимента. Установлено, что отобранные бактериальные штаммы обладают способностью к образованию различных биологически активных соединений. Бациллярный штамм отличался широким спектром синтеза гидролитических ферментов (целлюлаза, ксиланаза, амилаза, пектиназа, протеаза и липаза) и антимикробных метаболитов (сидерофоры, бактерио-цины и экзополисахариды). Следует отметить, что все проанализированные бактерии образовывали в культуральном супернатанте соединения с антибактериальными и антиоксидантными свойствами. Ключевые слова: Lactobacillus acidophilus, Pediococcus acidactici, Bacillus subtilis, штамм, пробиотический потенциал, бактериальные сообщества, функциональные добавки, птицеводство, цыплята-бройлеры. Сведения об авторах: Мухаммадиев Ринат Салаватович, кандидат биологических наук, научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; научный сотрудник сектора пробиотических препаратов и ферментов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-987-4214127; е-mail: tanirtashir@mail.ru. Валиуллин Ленар Рашитович, кандидат биологических наук, старший научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; заведующий лабораторией кормов и кормовых добавок ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-950-9698469; е-mail: valiullin27@mail.ru. Гибадуллин Радик Зифарович, кандидат биологических наук, доцент кафедры таксации и экономики лесной отрасли ФГБОУ ВО «Казанский государственный аграрный университет»; 420015, г. Казань, ул. Карла Маркса, 65; тел.: 8-917-2510182; e-mail: hflbru@list.ru. Гумеров Вали Галиевич, доктор ветеринарных наук, ведущий научный сотрудник, заведующий лабораторией вирусных заболеваний животных ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-917-3976244; е-mail: gumerowali@mail.ru. Медетханов Фазил Акберович, доктор биологических наук, доцент, заведующий кафедрой фармакологии, токсикологии и радиобиологии ФГБОУ ВО «Казанская государственная академия ветеринарной медицины имени Н.Э. Баумана»; 420029, г. Казань, ул. Сибирский Тракт, 35; тел.: 8-927-4178351; е-mail: ffazilak2@mail.ru. Ответственный за переписку с редакцией: Мухаммадиев Ришат Салаватович, кандидат биологических наук, научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; научный сотрудник лаборатории кормов и кормовых добавок ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-939-3728789; e-mail: tashir9891@mail.ru.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|