|
||||

Изучение влияния препарата Ветом 21.77 на гематоморфологические показатели цыплят-бройлеровУДК 619:615:636.2 + 619:618.14-002:636.2 Рафикова Э.Р. ФГБОУ ВО «Новосибирский государственный аграрный университет», г. Новосибирск Введение. В зарубежных научных публикациях последних десятилетий присутствуют данные о положительном действии средств растительного происхождения, доказанном в экспериментах на птицах [4, 5, 6]. Так, согласно результатов сравнительного исследования Sarica и др., включение растительных кормовых добавок в базовый корм бройлеров выразился в приросте живой массы, не имеющем статистически значимых различий от группы, где применялся антибиотик [8].
Абсолютное большинство исследований с использованием апа-тогенного гриба Duddingtonia flagrans были сфокусированы на его нематофаговом действии. Новый микробиологический препарат Ве-том 21.77, влияние которого на морфологические показатели крови цыплят-бройлеров является предметом настоящей работы, содержит спорово-мицелиальную биомассу данного гифомицета (1*109 КОЕ/1 см3). Препарат находится на стадии доклинических испытаний, в ходе которых уже был доказан его ростостимулирующий эффект при применении на мышах [2].
В качестве индикатора состояния обменных процессов, протекающих в организме птицы, может быть использована морфологическая картина крови. Данный аспект в работах с применением D. flagrans до сих пор был представлен весьма отрывочно. Так, уровень гематокрита регистрировался в исследовании Faessler и др., посвященном эффективности хламидоспор D. flagrans против нематод молочных овец. Авторы сообщают об обнаруженной ими отрицательной корреляции между данным показателем и количеством яиц Haemonchus contortus в фекалиях исследуемых животных [3, с. 99].
Vilela с соавт. трактуют статистически значимо больший в сравнении с контролем уровень гематокрита в крови козлов, получавших изолят D. flagrans, как признак более активного физиологического отклика на паразитарную нагрузку [10]. Авторами изучалась также лейкограмма крови подопытных животных, однако однозначных выводов по полученным результатам сформулировано не было.
В свою очередь в работе Silva и др. утверждается, что значение гематокрита в крови овец, получавших пеллеты с изолятом D. flagrans, было несколько ниже, чем в прочих исследуемых группах [9].
В исследовании Rocha с соавт. говорится об отсутствии статистически значимых различий в содержании гематокрита и общего белка плазмы крови между группой ягнят, где применялись пеллеты с мицелием D. flagrans, и контрольной группой [7].
Нами было проведено научно-экспериментальное исследование препарата Ветом 21.77 на опытных цыплятах-бройлерах. Цель проведения исследования - установить влияние применения препарата Ветом 21.77 на гематоморфологические показатели цыплят-бройлеров кросса Hubbard ISA F15 для оценки воздействия препарата на физиологический статус подопытной птицы.
Для реализации цели исследования были поставлены следующие задачи:
1) изучить влияние Ветома на морфологический состав крови цыплят-бройлеров на 2-е сутки (возраст 7 суток) и на 7-е сутки исследования (возраст 12 суток);
2) произвести мониторинг клинического состояния подопытной птицы с целью выявления нежелательных побочных эффектов препарата.
Материалы и методы исследований. Опыты проводились на 24 базе Научно-исследовательской ветеринарной лаборатории Агротехнопарка при Государственном Университете имени Шакарима (г. Семей, Казахстан).
В качестве объектов исследования были использованы клинически здоровые пятидневные цыплята-бройлеры кросса Hubbard ISA F15 массой (102 ± 4) г, предварительно содержащиеся в условиях карантина на протяжении пяти дней. Цыплята-бройлеры содержались согласно зоогигиеническим нормам: содержание напольное на глубокой несменной подстилке. В качестве основного рациона птицы получали в рассыпном виде сбалансированный по питательным веществам полнорационный гранулированный комбикорм ПК 5-1 «Старт» и имели неограниченный доступ к комбикорму и воде.
Для проведения исследования по принципу пар-аналогов (М ± 5%) было сформировано 5 групп цыплят - контрольная и 4 опытные, по 20 птиц в каждой. Дополнительно использовали 5 цыплят для гематологического анализа, проводимого до начала исследования. Бройлерам 1-ой опытной группы Ветом назначали на протяжении 7 суток перорально кратностью раз в сутки в дозе 2, 2-ой - 5, 3-ей - 50, 4-ой - 300 мкл/кг массы с последующим наблюдением за птицами. Цыплятам контрольной группы препарат не назначали.
Учет результатов исследования производили путем ежедневного клинического осмотра, взвешивания и изучения гематологических и зоотехнических показателей: количество птиц в начале и в конце эксперимента; падеж (%); сохранность (%); живая масса (г). Контроль за сохранностью и падежом осуществляли ежедневно, взвешивание производили до начала опыта, затем через 2 и 7 суток.
Взятие крови у цыплят-бройлеров проводили утром до кормления и поения птицы в соответствии с правилами взятия крови [1], из сердечной мышцы, предварительно умерщвляя птиц гуманным способом. 5 дополнительных птиц до начала исследования, по 5 птиц из контрольной и опытных групп через 2 и 7 суток после многократных введений препарата опытным группам.
Исследование гематологических показателей проводили на автоматическом гематологическом анализаторе для ветеринарии PCE 90 vet производства HTI (США). Для определения СОЭ (скорость оседания эритроцитов) использовали анализатор коагуляции Sunostik Sclot S2 производства Sunostik Medical Technology Co. (Китай). Гематологические исследования проведены по следующим показателям: эритроциты (млн/мкл), лейкоциты (тыс/мкл), тромбоциты (тыс/мкл), гематокрит (%), гемоглобин (г/л), МСН (пг), MCV (фл), эозинофилы (%), псевдоэозинофилы (%), лимфоциты (%), моноциты (%), ретикулоциты (%), СОЭ (мм/час).
Длительность научно-экспериментального исследования составила 7 суток.
Полученные цифровые экспериментальные данные обрабатывались с помощью компьютерной программы StatsDirect 3.1.14 (StatsDirect Ltd, UK). Сравнение выборок проводилось с помощью U-критерия Манна-Уитни. Различия считали статистически значимыми при уровне значимости Р <0,05.
Результаты исследований. На протяжении экспериментального периода (7 суток) заболеваемости и падежа подопытных птиц не регистрировали. До назначения препарата опытным группам физиологическое состояние цыплят всех групп не имело достоверных различий: птицы были клинически здоровы.
По данным ежедневного клинического обследования птиц выяснено, что при назначении препарата в изучаемых дозах опытным группам не установлено его отрицательного воздействия на физиологическое состояние организма птиц. В исследуемых группах абсолютная масса птиц не имела статистически значимых различий.
Результаты гематологических исследований до применения препарата показаны в таблице 1. Таблица 1. Гематоморфологические показатели у цыплят до начала исследования (Х ±р)
Как следует из таблицы 1, до начала эксперимента все физиологические показатели крови находились в пределах физиологической нормы. Лишь по содержанию эритроцитов было отмечено незначительное отставание от заданного интервала нормальных значений.
Через 2 суток после применения препарата опытным группам получены следующие результаты (табл. 2): Таблица 2. Гематоморфологические показатели крови подопытных цыплят через 2 суток от начала исследования (Х ±р)
Примечание: различия между выборками статистически незначимы Таким образом, на 2 сутки не наблюдалось статистически значимых различий между контрольной и опытными группами. Сохранение гематологических показателей в пределах значений физиологической нормы свидетельствует об отсутствии патологических процессов в организме исследуемых цыплят, что согласуется с результатами клинического осмотра.
Данные о морфологической картине крови птиц на 7 сутки исследования представлены в таблице 3.
Таблица 3. Гематоморфологические показатели крови подопытных цыплят через 7 суток от начала исследования (Х ±р)
Примечание: * - различия достоверны на уровне значимости P <0,05; ** - различия достоверны на уровне значимости P <0,01
Прежде всего, отметим, что на 7 сутки изучаемые морфологические показатели крови цыплят-бройлеров снова оставались в пределах соответствующих референтных диапазонов.
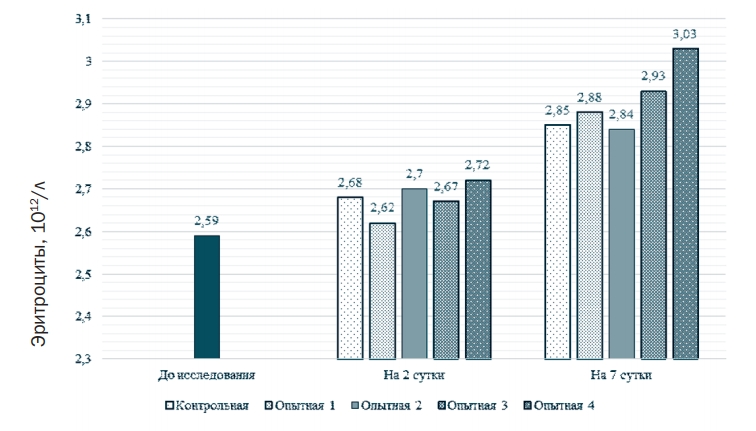
Величина параметров, отражающих дыхательную функцию крови и активность органов эритропоэза, превышала таковые в контрольной группе. Исключение составили лишь значения содержания эритроцитов и тромбоцитов во 2-ой опытной группе. В 1-ой опытной группе число эритроцитов (рисунок 1) было выше по сравнению с контролем на 1,1%, в 3-ей - на 2,8%, в 4-ой - на 6,3% (P<0,05). Относительно значений, полученных на 2 сутки, количество эритроцитов возросло на 6,3% в контроле, на 9,9% в 1-ой опытной группе, на 5,2% во 2-ой группе, на 9,7% в 3-ей и на 11,4% в 4-ой.
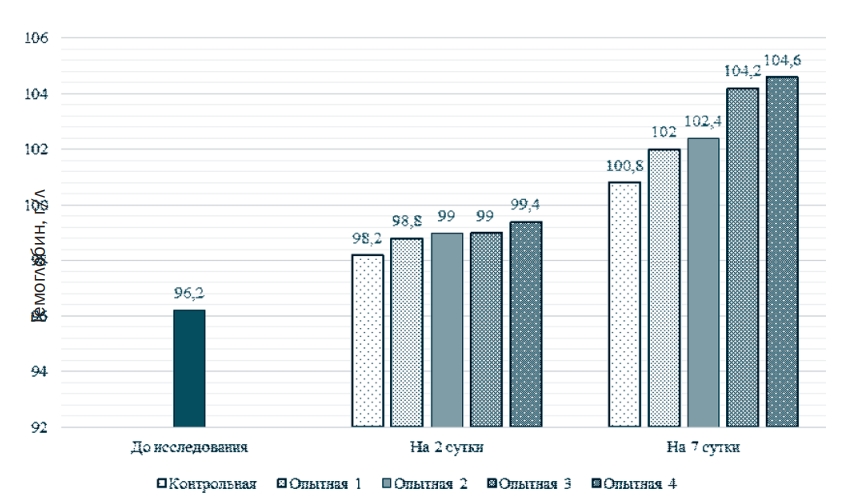
Рис. 1. Содержание эритроцитов В крови бройлеров, 1012/л Содержание гемоглобина (рисунок 2) на 7 сутки превышало таковое в контроле на 1,2% в 1-ой опытной группе, на 1,6 во 2-ой группе, на 3,4% (P <0,01) в 3-ей группе, и на 3,8 (P <0,01) в 4-ой. Относительно значений, достигнутых на 2 сутки, уровень гемоглобина увеличился в контроле на 2,6%, в 1-ой опытной группе на 3,2%, во 2ой группе на 3,4%, в 3-ей на 5,3%, в 4-ой - на 5,2%.
Рис. 2. Содержание гемоглобина в крови бройлеров, г/л При этом немаловажно обозначить, что в течение исследования показатель среднего содержания гемоглобина в эритроците (MCH), во многом определяющий интенсивность окислительно-восстановительных процессов в организме, оставался в пределах физиологической нормы.
Из данных лейкограммы крови подопытных цыплят следует, что число лимфоцитов во всех опытных группах на 7 сутки были незначительно выше (на 0,3-0,7%) контрольных значений. В сравнении с величиной данного показателя на 2 сутки, его прирост составил 0,4% в контроле, 0% в 1-ой опытной группе, 0,3% во 2-ой группе, 0,7% в 3-ей и 0,3% в 4-ой. Подобная динамика вряд ли может указывать на повышение уровня общей резистентности организма исследуемых птиц, однако, можно, по крайней мере, говорить о ее стабилизации.
По прочим показателям белых клеток крови также наблюдалась равномерная картина, без статистически значимых сдвигов. Отметим, что на протяжении всего эксперимента концентрация эозинофилов в опытных группах была ниже, чем в контроле (за исключением 4-ой опытной группы на 7 сутки), что является индикатором отсутствия аллергических реакций на препарат.
Заключение. Микробиологический препарат Ветом 21.77 способствует оптимизации физиологического статуса организма цыплят-бройлеров посредством активизации обменных процессов за счет увеличения содержания в крови эритроцитов, гемоглобина в пределах физиологической нормы. При этом значения среднего содержания гемоглобина в эритроците отражали достаточную их насыщенность гемоглобином.
В лейкограмме наблюдались, в целом, более высокие значения, достигнутые в опытных группах, в сравнении с контрольной, где препарат не применялся. Из этого можно заключить, что общая резистентность организма опытных бройлеров за время исследования не была снижена.
Следует отметить, что лучшие результаты были получены при применении препарата в дозировке 300 мкл/кг массы.
Во время исследований побочных действий, воспалительных и аллергических реакций, связанных с применением препарата, не выявлено, что подтверждается более низким относительно контроля уровнем эозинофилов в опытных группах.
Список литературы:
Резюме. В статье описывается исследование, предметом которого является определение влияния нового препарата Ветом 21.77 на гематоморфологические показатели птиц. Ранее подобные исследования препарата не проводились. Объектом исследования являлись цыплята-бройлеры кросса Hubbard ISA F15 пятидневного возраста массой (102 ± 4) г. Подопытные птицы были распределены на контрольную и 4 опытные группы, по 20 птиц в каждой. В опытных группах препарат применяли в дозах 2, 5, 50 и 300 мкл/кг массы с основным рационом. Контрольной группе препарат не назначали. Контроль изучаемых показателей производили до исследования, а затем после ежедневного введения препарата (кратностью раз в сутки) в вышеуказанных дозах опытным группам через 2 и 7 суток. По результатам исследования установлено, что при применении препарата Ветом 21.77 в вышеуказанных дозах во всех опытных группах гематоморфологические показатели оставались в пределах физиологической нормы, как и в контрольной группе. У птиц опытных групп регистрировали статистически значимое увеличение содержания эритроцитов и гемоглобина. Делается вывод об отсутствии негативного влияния препарата на физиологический статус организма исследуемых птиц.
Ключевые слова: Ветом 21.77, гематологические показатели, Duddingtonia flagrans, цыплята-бройлеры, доза, токсичность, эритроциты, гемоглобин.
Сведения об авторе: Рафикова Эльмира Рамильевна, аспирант кафедры фармакологии и общей патологии факультета ветеринарной медицины ФГБОУ ВО «Новосибирский государственный аграрный университет»; 630039, г. Новосибирск, ул. Добролюбова, 160; тел.: 8-913-9582964; e-mail: pchelka_leta@mail.ru - ответственный за переписку с редакцией.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|