|
||||

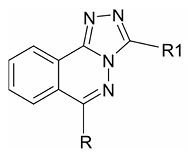
Синтез и биологическая активность триазолофталазиновУДК 576.89 Оригинальное эмпирическое исследование Зубенко А. А., Фетисов Л. Н., Святогорова А. Е., Чекрышева В. В. Северо-Кавказский зональный научноисследовательский Аннотация. Получены десять новых соединений ряда триазолофталазинов взаимодействием соответствующих хлор фталазинов с гира-зидами кислот. В результате тестирования биологической активности синтезированных соединений было установлено, что вещества проявили наиболее высокую активность в отношении реснитчатых простейших вида Colpoda steinii. Структура №7, имеющая заместители в виде метильной группы (R) и 2-гидрокси-5-хлорфенильного производного (R1) активна в концентрации 0,975 мкг/мл, что превышает активность антипротозойного препарата хлорохина в 8 раз. Отметим, что широко применяемый препарат толразурил, применяющийся в ветеринарной практике для лечения кокцидиоза, активен в концентрации 62 мкг/мл (литературные данные). Замена атома брома на атом хлора при одинаковых прочих заместителях (соединение №5) приводит к резкому падению активности до 250 мкг/мл. Соединения №2, №6 и №10 по активности сравнимы с контрольным препаратом хлорохином. При данной выборке (10 структур) не представляется возможным сделать заключение о влиянии тех или иных заместителей на антипротозойную активность, учитывая при этом их объём и донорно-акцепторные свойства. Обращает на себя внимание тот факт, что все представленные соединения обладают выраженной антибактериальной активностью, а соединения №2 и №5 не уступают по активности препарату нитрофуранового ряда фуразолидону. Представляется перспективным поиск высокоэффективных антибактериальных структур в ряду [1,2,4]триазоло[3,4-а]фталазинов. Из всех представленных веществ только три из них (№1, №7 и №8) проявили слабую активность, значительно уступая при этом фундазолу. Ключевые слова: соединения ряда триазолофталазинов, антибактериальная активность, антипротозойная активность, фунгистатическая активность Азотистые гетероциклы играют ключевую роль в медицинской химии. В обзоре Christopher M. Marshall et all одобренных FDA США низкомолекулярных лекарственных препаратов (1938-2012), содержащих азотистые гетероциклы, авторы приводят анализ структуры и свойств 321 новых уникальных низкомолекулярных лекарственных средств, одобренных с января 2013 по декабрь 2023 года, а также предоставили информацию о частоте встречаемости важных гетероатомов, таких как сера и фтор, и ключевых малых азотистых заместителей (CN и NO2). Наиболее заметным изменением является невероятное увеличение количества препаратов, содержащих по крайней мере один азотистый гетероцикл, на 82%, по сравнению с 59% за предыдущие десятилетия, а также значительное увеличение количества азотистых гетероциклов в каждом лекарственном средстве [11]. В работе David P. Rotella отмечено, что гетероциклы уже давно являются важной особенностью как разрабатываемых, так и зарегистрированных препаратов. Химики-фармацевты хорошо знают, какую важную роль играют гетероциклы в разработке и оптимизации лекарств. Известно, что замена канцерогенного бензола на пиридиновый цикл является обычной процедурой оптимизации предполагаемого лекарственного средства. Гетероциклы, необходимые для разработки лекарств, также включают ряд насыщенных гетероциклических колец, таких как пиперидин, пиран и морфолин, которые при правильном применении могут придать полезные характеристики получаемым молекулам [12]. В работе Howard B. Broughton, Ian A. Watson отмечается, что нельзя отрицать важнейшую роль, которую играют гетероциклы в разработке лекарств. Даже если природный субстрат или лиганд биологической мишени не содержит гетероцикл, лекарства - как природного, так и искусственного происхождения, - воздействующие на эту мишень, часто содержат гетероциклические группы. Они могут имитировать гетероциклы, содержащиеся в природных лигандах или субстратах, или другие функциональные группы, например амиды пептидного лиганда. В последнем случае гетероцикл часто обеспечивает стабильность лиганда, который в противном случае быстро разрушался бы in vivo, или, что не менее важно, позволяет лиганду всасываться в кишечнике и/или проникать через гематоэнцефалический барьер [5]. В статье Qianwen Guan et all отмечаются уникальные структурные особенности триазола, которые обеспечивают разнообразные нековалентные взаимодействия с различными биологическими мишенями, демонстрируя его способность выступать в качестве как донора, так и акцептора водородных связей. Эта двойная роль делает его незаменимым при создании биологически активных структур Производные триазола обладают широким спектром фармакологических свойств, включая противоопухолевые, антибактериальные, противовирусные, противогрибковые, противотуберкулезные, обезболивающие [9]. В работе Ayushi Bhatnagar и Gangotri Pemawat отмечается перспективность создания аннелированных соединений на основе 1,3-диазинового (пиримидинового) кольца, содержащегося в различных природных соединениях, включая нуклеотиды, нуклеиновые кислоты, витамины, коферменты, пурины, птерины и мочевые кислоты. Доказано, что лекарственные средства на основе конденсированных пиримидинов обладают полезными биологическими свойствами, включая противоопухолевое, противовирусное, противовоспалительное, антибактериальное, гипотензивное. Синтезированные производные пиримидина, являющиеся неотъемлемыми элементами организма, могут легко взаимодействовать с ферментами, генетическим материалом и биологическими элементами в клетках. Основное внимание уделяется клиническому значению функционализированного пиримидина и его аннелированных аналогов, что существенно помогает в проведении новых исследований в этой области. Авторы отмечают, что анализ зависимости структура-активность показывает, что замена во втором, четвертом, пятом и шестом положениях усиливает как противоопухолевую, так и антибактериальную активность [4]. В работе Rohit Pal et all также отмечается, что на основе N-гетероциклических аннелированных молекул возможно создание перспективных с точки зрения медицинской химии препаратов. Несколько примеров стратегий конструирования N-гетероциклических колец, включая пирролоазепиновые, пуриновые, 1Н-пи-разоло[3,4-С]пиримидиновые, 1Н-пирроло[2,3-Ь]пиридино-вые, пиразольные, тиено[3,2-С] пиримидиновые и производные на основе пиримидина, и их взаимосвязи структуры и активности представлены в данной работе [12]. В работе Kamal Usef Sadek et all отмечено, что при разработке антибактериальных препаратов интересной и эффективной стратегией является сочетание двух биологически активных каркасов, воздействующих на разные мишени. Гетероциклы являются очень важными фармакофорами в областях, связанных с фармацевтикой и исследованиями в области разработки лекарств. В этом контексте гетероциклы, согласно данным Всемирной организации здравоохранения (ВОЗ), составляют почти 8595% выпускаемых на рынок лекарств. Ограничения, связанные с антибактериальными препаратами, - это серьёзные побочные эффекты, лекарственная устойчивость, недостаточная эффективность, а также необходимость длительной терапии с применением токсичных препаратов для лечения устойчивых штаммов. Необходимость поиска новых антибактериальных средств продолжает побуждать учёных искать эффективные препараты, решающие такие проблемы. Перспективной стратегией, связанной с этой проблемой, является синтез гибридных молекул, включающих комбинацию двух биологически значимых гетероциклических фрагментов, действующих на разные мишени. В литературе упоминалось множество гибридных гетероциклов, обладающих интересными и замечательными антибактериальными свойствами. Наличие двух различных биологически активных гетероциклов в таких структурах оказалось ценным и полезным, поскольку улучшило их терапевтические свойства [10]. Авторы статьи Nutan V. Sadgir et al. отмечают, что лекарственная устойчивость затрудняет или делает невозможным лечение заболеваний и делает бесполезными антибиотики, а также другие противомикробные препараты. Чрезмерное использование антибиотиков, неадекватная гигиена и санитария, а также нехватка новых открытий в области антибиотикотерапии являются основными факторами устойчивости к противомикробным препаратам. Частое возникновение и быстрое распространение микробиологических инфекций представляют существенную опасность для здоровья человека и неизбежно стали серьезной проблемой для современной медицины. В настоящее время многие популярные противомикробные препараты бесполезны. Это связано с повышенной устойчивостью микроорганизмов к антибиотикам. Поэтому существует острая необходимость в создании новых, более эффективных антибактериальных препаратов. Наиболее перспективный путь поиска, по мнению авторов - это создание гибридных молекул. Подтверждением этому явилось создания гибридных молекул на основе тиазола и кумарина, обладающих высокими антибактериальными свойствами [15]. Как отмечают Guimiao Tian et all, в связи с широким использованием антибиотиков, а иногда даже злоупотреблением ими, проблема устойчивости бактерий к антибиотикам стала очень серьезной и представляет серьезную угрозу для здоровья людей во всем мире. Поэтому разработка новых антибиотиков является насущной необходимостью. Триазолы представляют собой пятичленные азотсодержащие ароматические гетероциклические каркасы, состоящие из двух изомерных форм, то есть 1,2,3-триазола и 1,2,4-триазола. Соединения, содержащие триазол, обладают широким спектром биологической активности, такой как антибактериальная, противогрибковая, противоопухолевая, антиоксидантная, противотуберкулезная, противомалярийная, анти-ВИЧ, противосудорожная, противовоспалительная, противоязвенная, обезболивающая и так далее. Биологическая активность и разнообразие препаратов, содержащих триазол, вызвали широкий интерес к этим гетероциклам. Были разработаны различные гибриды антибиотиков-триазолов, большинство из которых продемонстрировали мощную антимикробную активность. В этом обзоре авторы обобщили последние достижения в области гибридов триазола как потенциальных антибактериальных средств и их взаимосвязи между структурой и активностью [17]. На фоне достижений в области лечения малярии появление гибридных соединений с триазолом авторами работы Lekkala Ravindar et all представлено как новаторская разработка. Сочетая преимущества триазола и других компонентов, эти гибридные соединения открывают новые горизонты в борьбе с малярией. По мнению авторов, их потенциал в качестве эффективных противомалярийных средств обещает помочь в преодолении проблем, связанных с лекарственно-устойчивыми штаммами малярии. Авторы определили широкий спектр противомалярийной активности различных гибри-дизованных 1,2,3-триазолов и 1,2,4-триазолов, что обусловлено во многом их структурным сходством с известными лекарственными средствами, биодоступности и фармакокинетических свойствах, которые нацелены на различные стадии жизненного цикла плазмодия. Эта универсальность делает их высокоэффективными как против чувствительных к лекарствам, так и против устойчивых штаммов P. falciparum, что делает их бесценными инструментами в регионах, где распространена резистентность. Синергетический эффект сочетания триазольной части с другими фармакофорами привел к еще большему противомалярийному эффекту. Этот подход потенциально позволяет обойти существующие механизмы резистентности. [13] Целью нашей работы также является синтез и изучение биологической активности аннелированных производных триазола, а именно производных [1,2Д]триазоло[3Д-а]фталазина, представленных на рисунке 1.
Рис. 1. Общая формула производных триазолофталазинов Материалы и методы исследований. Соединения ряда триазолофталазинов получены взаимодействием соответствующих хлорфталазинов с гиразидами кислот. Конкретные соединения и их активность представлены в таблице 1. Таблица 1 Структуры новых триазолофталазинов и их биологическая активность
Антибактериальную активность в отношении E. coli WKM B-820 и St.aureus WKM B-128 определяли диско-диффузионным способом. На английском языке методика описана в высокорейтинговых журналах Polyhedron, 2018 [6, 7]. Фунгиста-тическую активность в отношении P.italicum F-1279 изучали по модифицированной нами методике, описанной в журнале №7 «Ветеринария и кормление» (2020 г.) [1, 2]. Результаты оценивали по величине зоны задержки роста культуры в мм. Протисто-цидная активность изучалась методом серийных разведений. Результаты оценивали в мкг/мл [3, 6, 7, 8, 17]. Результаты исследований и их обсуждение. Синтезированные вещества проявили наиболее высокую активность в отношении простейших C.steinii. Структура №7, имеющая заместители в виде метильной группы (R) и 2-гидрокси-5-хлор-фенильного производного (R1) активна в концентрации 0,975 мкг/мл, что превышает активность хлорохина в 8 раз. Отметим, что толразурил, применяющийся в ветеринарной практике для лечения кокцидиоза активен в концентрации 62 мкг/мл (литературные данные). Замена атома брома на атом хлора при одинаковых прочих заместителях (соединение №5) приводит к резкому падению активности до 250 мкг/мл. Соединения №2, №6 и №10 по активности сравнимы с контрольным препаратом хлорохином. При данной выборке (10 структур) не представляется возможным сделать заключение о влиянии тех или иных заместителей на антипротозойную активность, учитывая при этом их объём и донорно-акцепторные свойства. Обращает на себя внимание тот факт, что все представленные соединения обладают выраженной антибактериальной активностью, а соединения №2 и №5 не уступают по активности фуразолидону. Представляется перспективным поиск высокоэффективных антибактериальных структур в ряду [1,2,4]триазо-ло[3,4-а]фталазинов. Из всех представленных веществ только три из них (№1, №7 и №8) проявили слабую активность, значительно уступая при этом фундазолу. Заключение. Среди синтезированных производных триазолофталазинов обнаружены соединения как с высокой антипрото-зойной активностью 2, 6, 7, 10 с уровнем активности 15,6 - 0,975 мкг/мл, так и со значительной антибактериальной активностью 2, 5, 7, 10 с уровнем активности 15-20 мм. Список литературы: 1. Зубенко А. А., Диваева Л. Н., Фетисов Л. Н. [и др.] Поиск фунгистати-ков в ряду имидазола. Ветеринария и кормление. 2022; (5): 14-16. 2. Фетисов Л.Н., Зубенко А.А., Кононенко К.Н., Дробин Ю.Д., Клименко А.И., Бодряков А.Н. Определение фунгистатической активности новых соединений / Ветеринария и кормление. 2020. № 7. С. 61-63. 3. Ermakova E. A., Golubeva Ju. A., Smirnova K. S. [et al.] Bioactive mixed-ligand zinc(II) complexes with 1H-tetrazole-5-acetic acid and oligopyridine derivatives. Polyhedron. 2023; (230): 116213. 4. Bhatnagar A, Pemawat G. Anticancer and Antibacterial Activeness of Fused Pyrimidines: Newfangled Updates. Bioorg Chem. 2024; (153): 107780. 5. Broughton H., Watson I. Selection of heterocycles for drug design. J Mol Graph Model. 2004; (23 (1): 51-58. 6. Burlov A.S., Koshchienko Y.V., Makarova N.I. et al. Complexes of zinc(ii) with n-[2-(hydroxyalkyliminomethyl)phenyl]-4-methylbenzenesulfonamides: synthesis, structure, photoluminescence properties and biological activity. Polyhedron. 2018; (144): 249-258. 7. Burlov A.S., Koshchienko Y.V., Makarova N.I. et al. Synthesis, characterization, luminescent properties and biological activities of zinc complexes with bidentate azomethine schiff-base ligands. Polyhedron. 2018; (154): 65-76. 8. Ermakova E. A., Golubeva Yu. A., Smirnova K. S. et al. Cytotoxic mixed-ligand copper(ii) complexes with 1H-tetrazole-5-acetic acid and oligopyridine derivatives. New Journal of Chemistry. 2023; (47 (19): 9472-9482. 9. Guan Q., Gao Z., Chen Y. et al. Structural modification strategies of triazoles in anticancer drug development. Eur J Med Chem. 2024; (5 (275): 116578. 10. Sunny Manohar, U. Chinna Rajesh, Shabana I. Khan et al. Novel 4-Aminoquinoline-Pyrimidine Based Hybrids with Improved in Vitro and in Vivo Antimalarial Activity. ACS Medicinal Chemistry Letters. 2012; (3 (7): 555-559. 11. Marshall C., Federice J., Bell C., Cox P., Njardarson J. An Update on the Nitrogen Heterocycle Compositions and Properties of U.S. FDA-Approved Pharmaceuticals (2013-2023). J Med Chem. 2024; (67 (14): 11622-11655. 13. Pal R., Matada G., Teli G., Saha M., Patel R. Therapeutic potential of anticancer activity of nitrogen-containing heterocyclic scaffolds as Janus kinase (JAK) inhibitor: Biological activity, selectivity, and structure-activity relationship. Bioorg. Chem. 2024; (152): 107696. 14. Ravindar L., Hasbullah S., Rakesh K., Hassan N. Triazole hybrid compounds: A new frontier in malaria treatment. Eur J Med Chem. 2023; (5 (259): 115694. 15. Rotella D. Heterocycles in drug discovery: Properties and preparation. Advances in Heterocyclic Chemistry. 2021: 149-183. 16. Nutan V. Sadgir, Vishnu A. Adole, Sunil L. Dhonnar et al. Synthesis and biological evaluation of coumarin appended thiazole hybrid heterocycles: Antibacterial and antifungal study. Journal of Molecular Structure. 2023; (1293): 136229. 17. Ermakova E. A., Golubeva Yu. A., Smirnova K. S. [et al.] Synthesis, structure and biological properties of the zinc(II) complexes with 5-(4-chlorophenyl)-1H-tetrazole and oligopyridine derivatives. Inorganica Chimica Acta. 2024; (571): 122217. 18. Tian G., Song Q., Liu Z. et al. Recent advances in 1,2,3- and 1,2,4-triazole hybrids as antimicrobials and their SAR: A critical review. European Journal of Medicinal Chemistry. 2023; (259): 115603. Сведения об авторах: Зубенко Александр Александрович, доктор биологических наук, главный научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-928-6049743; e-mail: alexsandrzubenko@yandex.ru. Фетисов Леонид Николаевич, кандидат ветеринарных наук, ведущий научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-908-1978224; e-mail: fetisoff.leonid2018@yandex.ru. Чекрышева Виктория Владимировна, доктор ветеринарных наук, доцент, директор СКЗНИВИ - филиал ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-918-5943886; e-mail: veterinar1987@mail.ru. Клименко Александр Иванович, академик РАН, доктор сельскохозяйственных наук, профессор, директор ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346735, Ростовская область, Аксайский район, п. Рассвет, ул. Институтская, 1; e-mail: dzni@mail.ru. Ответственный за переписку с редакцией: Святогорова Александра Евгеньевна, кандидат сельскохозяйственных наук, старший научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-988-9525755; e-mail: sviatogorova.a@yandex.ru. Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|