|
||||

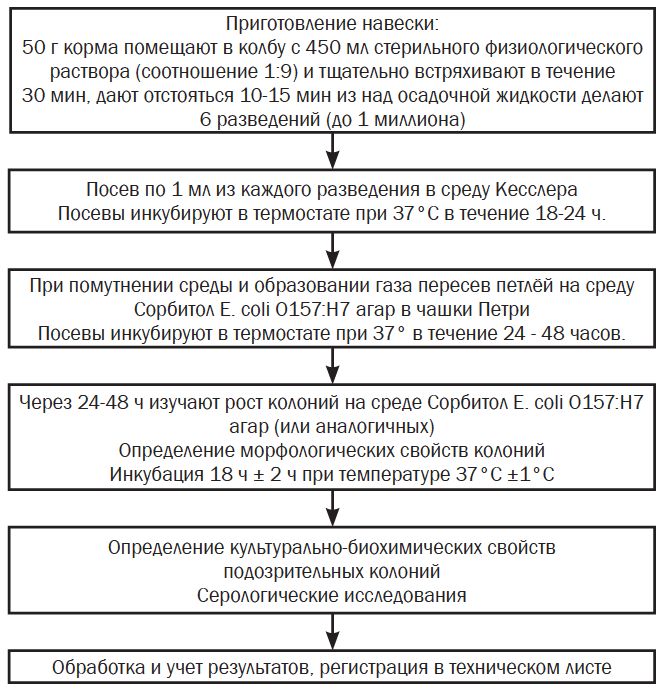
Метод обнаружения бактерий e. Coli, продуцирующих шигатоксин, в кормах для животныхУДК 579.62 Оригинальное эмпирическое исследование Попов П. А., Банникова Д. А., Бабунова В. С., Тюменцева В. С. Всероссийский научно-исследовательский институт ветеринарной санитарии, Аннотация. Шигатоксинпроизводные кишечные палочки представляют собой значительную опасность для здоровья человека. Клинические проявления инфекций, вызванных энтерогеморрагическими эшерихиями, варьируются от бессимптомного носительства до геморрагического колита и гемолитико-уремического синдрома. Более тяжелые последствия вызываются энтерогеморрагической кишечной палочкой, которая включает в себя серогруппы O157: H7. Классические штаммы группы ЕНЕС содержат ген ЕАЕ, кодирующий синтез белка внешней мембраны клетки интимина, участвующего в адгезии возбудителя к поверхности кишечного эпителия, а также ген hlyA, который контролирует продукцию энтерогемолизина. Острые кишечные инфекции, вызванные шигатоксинпродуцирующими кишечными палочками разных серогрупп, включая Escherichia coli О157:Н7, регистрируются практически повсеместно. Шигатокси-ны кодируются и распространяются путем преобразования лямбдовидных бактериофагов, называемыми Stx-фагами. Они помимо повышения патогенных профилей вирулентных штаммов E. coli могут еще и за счет горизонтального переноса и встраивания в геном бактерии превратить комменсальных членов семейства Enterobacteriaceae в кишечнике в производителей огромного количества разнообразных токсинов. Ключевые слова: бактерии Escherichia coli, шигатоксин, корма, метод обнаружения, верификация. Для этиологии колибактериоза крупного рогатого скота и других животных, а так же людей, наиболее значимы энтеротоксигенные (enterotoxigenic Escherichia coli -ETEC), энтеропатогенные (enteropathogenic Escherichia coli - EPEC) и энтерогеморрагические (enterohemorrhagic Escherichia coli - EHEC) типы E. coli, что делает эту проблему актуальной для ветеринарии и для медицины. Для группы бактерий эшерихий патогенность не является видовым признаком, и не связана с конкретной серогруппой. Они реализуют патогенность, вызывая нарушения в организме человека или животных, ограниченные только теми генетическими детерминантами патогенности, которыми обладает конкретный штамм E. coli. Ключевым поражающим фактором энтероге-моррагических эшерихий (EHEC) являются шигатоксины - stx1 (высоко гомологичный шига-токсину S. dysenteriae) и stx2 [1]. Кишечные палочки, продуцирующие шига-подобный токсин, обозначаются как STEC. STEC также называются вероцитоток-сигенными E. coli. Серотипы STEC названы в соответствии с их соматическими (O) и жгутиковыми (H) антигенами. Классическим представителем EHEC-группы является шигатоксинпродуцирую-щие E. coli серотипа O157:H7, который считается наиболее опасным патогеном. Все STEC с O-антигеном 157 обозначаются как O157 STEC, независимо от того, был ли идентифицирован антиген H7 или подтверждена выработка шигатоксина. STEC с другими O-антигенами обозначаются как STEC, отличные от O157, или по их специфическому O-антигену [3, 4, 13, 14, 15, 16]. С этим патогенным микроорганизмом связаны крупные вспышки пищевых инфекций, зарегистрированные в разное время в США, Канаде, Японии и других странах. Первые две вспышки колибакте-риозного геморрагического колита, сочетавшегося с симптомами ГУС, зарегистрировали в США в 1982 г. [8, 9], при этом был выделен неферментирующий сорбит штамм серотипа O157:H7. Кроме серотипа E. coli O157:H7 спорадические и вспышечные случаи заболеваний могут вызывать следующие серогруппы O26, O55, O103, O111, O121 и O145. Так, например в 2011 г произошла крупнейшая вспышка STEC-инфекции в Германии, когда было зарегистрировано в общей сложности около четырех тысяч случаев заболевания и более пятидесяти летальных исхода. Выделенные штаммы, относились к энтероагрегативной геморрагической кишечной палочке (EAHEC) O104: H4, продуцирующей stx2. До этой вспышки данный возбудитель крайне редко встречался у людей и никогда не обнаруживался у животных или в пищевых продуктах [5, 6, 10]. Эффективных методов лечения STEC-инфекций до настоящего времени не предложено, использование антибиотиков при этом ограничено, лицензированных вакцин против STEC-инфекций на сегодня так же нет. Основное внимание должно быть уделено продуктам животного происхождения, которые часто выступают в роли резервуаров для патогенных штаммов E. coli. Так, вспышка острой кишечной инфекции в Санкт-Петербурге в 2013 г. среди детей, которая протекала в форме геморрагического колита с проявлением в некоторых случаях гемолитико-уремического синдрома, энтероколита и острого гастроэнтерита, была вызвана потреблением сырого коровьего молока, контаминированного шигатоксинпро-дуцирующими эшерихиями. Было зарегистрировано более 5000 случаев заболевания. Предположительно фактором передачи возбудителей STEC-инфекции в этой вспышке являлось сырое молоко, которое реализовывалось через молокоавтоматы. Была установлена этиологическая роль двух энтерогеморагических штаммов E. coli - серотипов O157:H7 и 0101:H33 [6]. Таким образом, наиболее частый путь распространения этой инфекции - пищевой. Считается, что одним из естественных резервуаров бактерий шигатоксинпродуцирующих бактерий, в том числе Е. coli О157: Н7, служит крупный рогатый скот и другие жвачные животные. Колибактериоз по заболеваемости и летальности, несмотря на широкое применение для лечения различных антибиотиков и вакцин, остается основной инфекционной патологией животных. Основным фактором передачи является сырое молоко и сырая говядина, в том числе фарш и мясные полуфабрикаты, прошедшие недостаточную термическую обработку [6]. Основным источником возбудителя инфекции являются фекалии внешне здоровых животных, поскольку штаммы эшерихий энтеропатогенных серогрупп могут персистировать в кишечнике взрослых особей. С фекальными массами от животных бактерии попадают во внешнюю среду, в воду, почву, на сельскохозяйственные и кормовые растения. Данные микробиологического исследования кормов на территории Российской Федерации в период с 2014 по 2018 годы свидетельствуют, что представители энтеропатогенных E. coli чаще всего выделялись из кормов растительного происхождения и комбикормов [7, 11, 12]. Присутствие шигатоксинобразующие штаммы Escherichia coli (STEC) в кормах вызывает обеспокоенность. Из-за их устойчивости к неблагоприятным условиям окружающей среды, эти штаммы могут выживать и размножаться, создавая потенциальную угрозу для здоровья животных и, в конечном итоге, человека. Контроль за STEC должен включать в себя регулярное микробиологическое тестирование кормов, применение методов термической обработки и ведение строгой гигиенической практики на всех этапах производства и хранения. Осознание значимости этих патогенов в цепочке поставок корма является важным шагом на пути к обеспечению безопасности продовольствия (продовольственной безопасности) и защиты здоровья населения. В настоящее время микробиологический контроль качества кормов и комбикормового сырья стал особенно актуален, так как к крупным промышленным предприятиям по изготовлению кормов прибавились мелкие производства, располагающие недостаточными производственными мощностями, и не всегда имеющие хорошо оснащенные лаборатории и подготовленные, высококвалифицированные кадры, что несомненно отражается на общем уровне качества выпускаемых кормов и особенно по микробиологическим показателям, характеризующим загрязненность кормов патогенной и условно-патогенной микрофлорой, ответственной за качество и безопасность кормов и продукции животноводства, что имеет огромное эпизоотическое и эпидемиологическое значение. Разработка нового метода контроля микробиологической контаминации кормов, в настоящее время, является актуальной задачей. На настоящий момент в лабораторной практике для идентификации возбудителей болезней животных и ретроспективной диагностики применяют такие методы, как твердофазный иммунофермент-ный анализ (ТФ ИФА) и полимеразная цепная реакция в режиме реального времени (ПЦР-РВ), позволяющие быстро и точно выявить антитела к возбудителю и его геном, провести его идентификацию, типизацию, дифференциацию выделенных изолятов, также проводят сравнительный анализ нуклеотидных последовательностей геномов возбудителей, полученных с помощью секвенирования, однако эти методы дорогостоящие и трудны в исполнении [13]. На территории Российской Федерации в настоящее время отсутствует нормативно-методическая база и не проводится контроль по обнаружению эпидемиологически значимых ши-гатоксинобразующих штаммов Escherichia coli (STEC), Listeria monocytogenes, Campylobacter. Микробиологический контроль безопасности кормов по показателям сальмонеллы, токсин образующие анаэробы, бактерии рода Протеус и энтеропатогенные типы кишечной палочки проводится согласно следующих нормативных документов: «Правила бактериологического исследования кормов», утвержденные в 1975 году, и «Методика индикации бактерий рода Протеус в кормах животного происхождения», утвержденные в 1981 г. Необходимо актуализировать методики в соответствии с современными подходами. Материалы и методы исследований. Для реализации данного метода необходимо соответствующее лабораторное оборудование (термостат, автоматические одноканальные дозаторы со стерильными наконечниками, перемешивающее устройство шейкер) с обязательной поверкой и аттестацией температурного режима. Испытания должны проводится в асептических условиях в ламинарных установках и чистых помещениях. Для данного метода потребуются следующие питательные среды «ГКПМ Оболенск», Россия: Среда Кесслера, Питательная среда № 14 (Цитрат Симмонса), Среда Гисса с маннитом, Среда Гисса с индолом, Питательный агар (МПА) или аналогичные других производителей. Так же необходима среда для выделения и дифференциации E. coli 0157:H7/0157:H: названия указаны в соответствии с наименованиями производителя «ГКПМ Оболенск», Россия - Сорбитол Е. coli О157:Н7 агар, АО «НПО «Микроген», Россия - Питательная среда для выделения и дифференциации Escherichia coli 0157:Н7 и других энтеробактерий по признаку ферментации сорбита сухая (ЭДКС-агар), НПЦ «Биокомпас-С», Россия - Сорбитол МакКонки агар, diaGene, Россия - Агар МакКонки с сорбитом для селективного выделения и дифференциации E. coli 0157:H7 или МакКонки-сор-битол-агар Sorbitol MacConkey Agar от Thermo Fisher Scientific (США), Мегск (Германия), либо Condalab, Pronadisa (Испания) и т.д. Для определения О- и Н-антигенов используется сыворотка к антигенам Е. coli О157:Н7 или антительная латексная тест-система для индикации E.coli серогруппы 0157, в реакции латексной агглютинации (РЛА). Схема проведения испытания на обнаружение шигатоксин продуцирующего штамма Е. coli представлена ниже (рисунок 1).
Рис. 1. Рекомендуемая схема проведения испытания определения Escherichia coli О157:Н7 в кормах для животных. В колбу с 450 мл стерильного физиологического раствора помещают 50 г корма (разведение 1:10). Из полученной взвеси готовят последовательные разведения 1:100, 1:1000, 1:10000, 1:100000, 1:1000000. Из каждого разведения вносят по 1 мл в пробирки со средой обогащения Кесслера. Посевы инкубируют в термостате при 37°С в течение 18-24 ч. Из пробирок делают посев на среду Сорбитол Е. coli О157:Н7 агар или аналогичные среды в бактериологических чашках. Отличительной биохимической особенностью Е. coli О157:Н7 является неспособность штамма к ферментации сорбитола, использовать для его выделения среду Эндо не рекомендуется, так как в её составе содержится лактоза. А поскольку данный микроорганизм является лактозоположительным подобно другим сероварам эше-рихий, могут возникнуть трудности с идентификацией. Характеристика роста Е. coli О157:Н7 на плотных питательных средах представлена в таблице 1. Посевы инкубируют в термостате при 37°С в течение 24-48 ч. Высев рекомендуется производить на не менее чем 3 чашки Петри с сорбитол-агаром, что повышает вероятность обнаружения колоний E. coli O157:H7. Через 24-48 ч изучают рост колоний на среде Сорбитол Е. coli О157:Н7 агар. Во время инкубации периодически просматривают посевы. Наличие роста микроорганизмов определяют визуально в проходящем свете. Таблица 1 Характеристика роста Escherichia coli О157:Н7 на плотных питательных средах
Такие неокрашенные сорбитол отрицательные колонии, характерные для E. coli O157:H7, пересевают на МПА для проведения дальнейших биохимических и серологических идентификаций. Принадлежность культуры к роду эшерихий проводят на основании биохимических свойств, представленных в таблице 2. Таблица 2 Биохимические свойства штаммов Escherichia coli, включая О157
Определение О- и Н-антигенов проводится в обычной реакции агглютинации на стекле с эшерихиозными сыворотками к Е. coli 0157:Н7. Реакция агглютинации осуществляется в соответствии с наставлениями по применению данных сывороток. Либо используется антительная латексная тест-система для индикации E. coli серогруппы O157, в реакции латексной агглютинации (РЛА). Все штаммы, дающие положительную реакцию агглютинации, подлежат обязательной биохимической идентификации для подтверждения видовой принадлежности. При получении результатов по выявлению Е. coli О157:Н7 их записывают: «обнаружены или не обнаружены в 50 г (мл) корма». В том случае, если ни один из отсевов колоний, полученных со сред обогащения, не был отнесен к E. coli O157, работу с этими культурами прекращают, и сдают в убивку. Результаты могут быть признаны недостоверными в случае, если были получены неудовлетворительные результаты контроля питательной среды, микробиологического контроля окружающей среды или при выявлении ошибок, допущенных в ходе испытания. Заключение. Разработка новых и усовершенствование существующих средств и методов диагностики инфекционных заболеваний, а также защита животных от негативного воздействия патогенов является актуальной и важной задачей научных исследований. Убой неблагополучных по инфекционным заболеваниям животных не рентабелен для животноводческих хозяйств. Более практичным представляется применение таких технологий выращивания скота, при которых снижается риск контаминации воды и кормов бактериями, в том числе из группы STEC. Важным этапом при этом является и соблюдение санитарных правил, применение современных дезинфицирующих средств. Это в комплексе приведет к уменьшению распространения различных инфекции в стаде. Методы выявления и идентификации шигатоксинобразующих энтеробактерий из кормов, кормовых добавок и сырья для производства комбикормов повысят биологическую безопасность и будут полезны в повседневной лабораторной практике. Список литературы: 1. Иванова Е. И., Попкова С. М., Джиоев Ю. П., Ракова Е. Б., Немченко У. М., Рычкова Л. В. Выявление шигатоксинпродуцирующих штаммов Escherichia coli в популяциях нормальной кишечной микробиоты у детей с функциональными нарушениями желудочно-кишечного тракта. Клиническая лабораторная диагностика. 2014; (11): 56-60. 2. МУК 4.2.992-00. Методы выделения и идентификации энтерогеморрагиче-ской кишечной палочки E. coli 0157:Н7. Fogg P.C., Saunders J.R., McCarthy A.J., Allison H.E. Cumulative effect of prophage burden on Shiga toxin production in Escherichia coli. Microbiology. 2012; (58 (2): 488-497. 3. Melton-Celsa A., Mohawk K., Teel L., O’Brien A. Pathogenesis of Shiga toxin producing Escherichia coli. Curr. Top. Microbiol. Immunol. 2012; (357): 67-103. 4. Beutin L., Martin A. Outbreak of Shiga toxin-producing Escherichia coli (STEC) O104:H4 infection in Germany causes a paradigm shift with regard to human pathogenicity of STEC strains. J. Food Prot. 2012; (75 (2): 408-418. 5. Онищенко Г.Г., Дятлов И.А., Светоч Э.А., Воложанцев Н.В., Баннов В.А. Молекулярно-генетическая характеристика шигатоксинпродуцирующих Escherichia coli, выделенных при вспышке пищевой инфекции в Санкт-Петербурге в 2013 году. Вестник РАМН. 2015; (1). 6. Ferens W.A., Hovde C.J. Escherichia coli O157:H7: animal reservoir and sours of human infection. Foodborne pathog. Dis. 2011; 8 (4): 465-80. 7. Riley L.W., Remis R.S., Helgerson S.D. et al. Hemorrhagic colitis associated with a rare E. coli serotype. N. Engl. J. Med. 1983; (308). P. 681-685. 8. O’Brien S.J., Murdoch P.S., Riley A.H. et al. A foodborne outbreak of Vero cytotoxin-producing E. coli O157:H7 phage type 8 in hospital. J .Hosp. Infect. 2001; (49): 167-172. 9. Кафтырева Л.А., Егорова С.А., Макарова М.А., Забровская А.В., Матвеева З.Н., Сужаева Л.В., Артамонова Ю.А. Характеристика биологических свойств E. coli 0104:H4 - возбудителя крупной пищевой вспышки, возникшей в Германии в мае 2011 г. Клиническая лабораторная диагностика. 2012; (1): 44-47. 10. Кремлева А., Скоморина Ю., Белоусов В., Варенцова А., Полосенко О., Шепелин А. Оценка распространенности патогенных эшерихий в кормах на территории РФ в 2014-2018 годах. Комбикорма. 2020; (3): 68-70. 11. Hancock D.D., Besser T., Lejeune J. et al. The control of VTEC in the animal reservoir. Int J Food Microbiol. 2001; (66): 71-78. 12. ГОСТ ISO/TS 13136-2016. Межгосударственный стандарт. Микробиология пищевой продукции и кормов для животных. Полимеразная цепная реакция в режиме реального времени для определения патогенных микроорганизмов. Горизонтальный метод определения бактерий Escherichia coli, продуцирующих шигатоксин, в том числе серогрупп О157, О111, О26, О103 и О145. 13. Дорожкин В.И., Смирнов А.М., Попов П.А., Гуненкова Н.К. Основные направления научной деятельности по обеспечению качества и биологической безопасности животноводческой продукции и охраны окружающей среды. Российский журнал Проблемы ветеринарной санитарии, гигиены и экологии. 2021; (2 (38): 104-113. 14. Бутко М.П., Попов П.А., Лемясева С.В., Онищенко Д.А. Фальсификация продукции животного происхождения. Российский журнал Проблемы ветеринарной санитарии, гигиены и экологии. 2017; (3 (23): 17-23. 15. Герасимов А.С., Посконная Т.Ф., Попов П.А., Ивчина Е.Ю., Лемясева С.В., Онищенко Д.А. Ветеринарно-санитарные требования по обеспечению безопасности производства мяса и мясопродуктов. 2017. Сведения об авторах: Банникова Дарья Андреевна, кандидат ветеринарных наук, ведущий научный сотрудник лаборатории санитарной микробиологии Всероссийского научно-исследовательского института ветеринарной санитарии, гигиены и экологии -филиал ФНЦ ВИЭВ РАН; 123022, г. Москва, Звенигородское шоссе, 5; e-mail: andreevna.07@mail.ru. Бабунова Вероника Сергеевна, кандидат ветеринарных наук, ведущий научный сотрудник Всероссийского научно-исследовательского института ветеринарной санитарии, гигиены и экологии - филиала ФНЦ ВИЭВ РАН; 123022, г. Москва, Звенигородское шоссе, 5; e-mail: veronikavniivs@mail.ru. Тюменцева Валерия Сергеевна, научный сотрудник, аспирант Всероссийского научно-исследовательского института ветеринарной санитарии, гигиены и экологии - филиал ФНЦ ВИЭВ РАН; 123022, г. Москва, Звенигородское шоссе, 5; e-mail: 89296712838v@gmail.com. Ответственный за переписку с редакцией: Попов Петр Александрович, доктор ветеринарных наук, руководитель Всероссийского научно-исследовательского института ветеринарной санитарии, гигиены и экологии -филиала ФНЦ ВИЭВ РАН; 123022, г. Москва, Звенигородское шоссе, 5; e-mail: popov.petr18@gmail.com. Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|