|
||||

Новый подход с использованием пробиотика, метабиотика и бактериальных ферментов для коррекции вызванных действием патогенных факторов микроэкологических нарушений кишечника молодняка сельскохозяйственной птицыУДК 579.62 Мухаммадиев Риш. С., Мухаммадиев Рин. С., Валиуллин Л. Р. Федеральное государственное бюджетное Доктриной продовольственной безопасности Российской Федерации предусмотрено устойчивое развитие птицеводства для возможности удовлетворения населения страны полноценной и сбалансированной продукцией [22, 24].Для решения указанной задачи при промышленном про изводстве мяса применяют высокопродуктивные кроссы птиц, генетический потенциал которых реализуется при соблюдении отвечающих физиологическим потребностям их организма оптимальных условий содержания и кормления [8, 9, 29]. Тем не менее, многие птицефабрики в большинстве случаев не способны обеспечить необходимые условия для сельскохозяйственной птицы, что приводит к изменению устойчивости ее микробиома [3, 14, 27]. В соответствии с современными представлениями под термином «микробиом» понимают единую экологическую систему биотопов органов и систем организма хозяина [1, 16]. Ключевым элементом экосистемы является микробиота кишечника, представляющая собой резервуар симбиотических микроорганизмов, изменения количественного и качественного состава которой при определенных условиях способны приводить к развитию различных инфекций [2, 21, 36]. В промышленном птицеводстве в качестве препаратов для предотвращения распространения и лечения различных инфекций используются антибиотики [4, 25, 32]. Проблема применения профилактических и терапевтических антимикробных средств связана с возникновением к последним резистентности у энтеропатогенных микроорганизмов, а также расстройствами органов пищеварения животных [5, 21, 30]. В тоже время используемые в кормлении сельскохозяйственных птиц зерно, пораженное структурно разнообразными низкомолекулярными метаболитами микроскопических грибов, в основном, родов Fusarium, Aspergillus и Penicillium, в ряде случаев способно вызывать отравления, или микотоксикозы [10, 12, 35]. В связи с этим остро встает вопрос разработки биологически активных препаратов или подходов с их применением для коррекции вызванных действием патогенных факторов нарушений состава микробиома кишечника молодняка птицы. При совместном применении пробиотических микроорганизмов в качестве средств лечения кишечных инфекций и профилактики микотоксикозов сельскохозяйственных животных их биотехнологический потенциал существенно расширяется [25, 33, 34]. К числу таких средств относится, например, Энтероспорин, Спас или Биоспорин [6, 20, 23]. В этом плане огромный интерес вызывают препараты на основе биологически активных метаболитов (метапробиотики, метабиотики) антагонистов возбудителей кишечных инфекций и микотоксикозов животных, включая птиц. Указанные препараты способны характеризоваться высокой эффективностью с точки зрения их функциональных свойств. Тем не менее, к настоящему времени существенная часть представленных в отечественной и зарубежной литературе данных относится к исследованиям, которые касаются оценки профилактической и терапевтической эффективности пробиотиков при кишечных инфекциях или микотоксикозах сельскохозяйственной птицы [7, 26, 30, 37]. Число работ, связанных со сравнительным изучением эффективности пробиотиков, метапробиотиков и метабиотиков, в профилактике и лечении кишечных инфекций и микотоксикозов птицы отсутствуют. Необходимость проведения дальнейших научно-исследовательских работ в этом направлении безусловна и связана с возможностью расширения арсенала отечественных препаратов на основе микроорганизмов с пробиотическим потенциалом и/или их биологически активных метаболитов. Целью работы являлась оценка эффективности нового подхода с использованием пробиотика, метабиотика и бактериальных ферментов для коррекции вызванных действием патогенных факторов микроэкологических нарушений кишечника молодняка сельскохозяйственной птицы. Материалы и методы исследований. Объектами для исследований служили экспериментальные образцы метабиотика, метабиотика, метапробиотика и полиферментного препарата, разработанные Всероссийским научно-исследовательским институтом фитопатологии (Московская обл., Одинцовский р-н, Россия). Пробиотическая добавка содержала штаммы L. acidophilus IV138, P. acidactici PA-12 и B. subtilis GA24 с титром (3,11 ± 0,36) х 109 КОЕ/мл; метабиотическая добавка - продукты метаболизма указанных бактериальных штаммов; метапробиотическая добавка - биомассу вегетативных клеток указанных бактерий (титр (3,11 ± 0,36) х 109 КОЕ/мл) и продукты их метаболизма; полифер-ментный препарат - бациллярные ксиланазы (3200 ед.), целлюлазы (117 ед.), пектиназы (4000 ед.), амилазы (300 ед.), протеазы (108 ед.), липазы (81 ед.) и фитазы (72 ед.) основных типов. Испытания по оценке эффективности нового подхода с использованием пробиотика, метабиотика и бактериальных ферментов для коррекции вызванных действием патогенных факторов микроэкологических нарушений кишечника молодняка сельскохозяйственной птицы проводили на 48 цыплятах-бройлерах 21-суточного возраста с клиническими признаками кишечного расстройства и микотоксикоза. Содержание цыплят-бройлеров осуществляли в клеточных батареях при постоянном искусственном освещении и температуре 35,0±1,0°С. Контрольную и опытные группы птиц формировали в соответствии с принципом аналогов. Отобранные цыплята были разделены на группы по 8 животных в каждой: 1) опытная группа 1 - цыплята, которые получали экспериментальный образец пробиотической добавки в количестве 1,0 мл/гол в сутки; 2) опытная группа 2 - цыплята, которые получали экспериментальный образец метабиотической добавки в количестве 1,0 мл/гол в сутки; 3) опытная группа 3 - цыплята, которые получали экспериментальный образец метапробиотической добавки в количестве 1,0 мл/гол в сутки; 4) опытная группа 4 - цыплята, которые получали экспериментальный образец метапробиотической добавки в количестве 1,0 мл/гол в сутки и полиферментный препарат из расчета 1,0 мл /кг корма; 5) контрольная группа - цыплята, которые получали физиологический раствор в количестве 1,0 мл/гол в сутки. Длительность дачи птицам экспериментальных образцов биодобавок составила 7 суток с момента начала эксперимента. В ходе исследования осуществляли ежедневное взвешивание цыплят контрольной и опытных групп, а также устанавливали показатели их продуктивности и сохранность [26, 32]. По окончании эксперимента у бройлеров контрольной и опытных групп проводили забор крови и кишечного содержимого для лабораторных исследований. Численность микроорганизмов в содержимом кишечника птицы устанавливали с помощью агаризованных питательных сред рекомендованного состава [27, 28]. В крови птиц определяли гематологические, биохимические и иммунологические показатели. Гематологические исследования включали установление общего количества эритроцитов, лейкоцитов и гемоглобина в крови, а также СОЭ. Биохимические исследования включали определение общего содержания белка сыворотки, концентрации продуктов белкового и липидного обменов (мочевины, билирубина, холестерина), углеводов (глюкозы), активности ферментов аминотрансфераз (ACT, АЛТ) и гидролаз (ЩФ). Иммунологические исследования включали установление количества Т- и В-лимфоцитов, ФА нейтрофилов и ЛА сыворотки крови. Уровень общего белка сыворотки крови бройлеров исследовали рефрактометрическим методом, используя прибор ИРФ-454Б (Россия). Гематологические и биохимические параметры определяли соответственно на анализаторах Mithic 18 (Orphee Geneva, Швейцария) и Microlab 300 (Vital Scientific, Нидерланды) с применением тест-наборов фирмы Ольвекс Диагностикум (Россия). Результаты экспериментов анализировали пакетом электронных таблиц программного обеспечения Microsoft Office Excel 2013 («Windows», США) после предварительной оценки выборки на нормальность распределения критерием Шапиро-Уилка и представляли в виде средних арифметических значений и стандартной ошибки среднего. Оценку достоверности различий между группами устанавливали по t-критерию Стьюдента с поправкой Бонферрони. Различия считали статистически достоверными при 95 % доверительной вероятности (р < 0,05). Результаты исследований и их обсуждение. В настоящей работе проведена сравнительная оценка эффективности разработанных экспериментальных образцов пробиотика, метабио-тика и полиферментного препарата при коррекции нарушений микробиоты кишечника у цыплят-бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза. Следует отметить, что в просматриваемой нами литературе данных об сравнительной эффективности указанных добавок, одновременно полученных с использованием определенных штаммов или консорциумов на их основе, в лечении кишечных инфекций молодняка мясной птицы отсутствуют. Проведенный анализ содержимого кишечника бройлеров контрольной и опытных групп показал, что применение исследуемых биодобавок приводило к повышению численности представителей нормальной микробиоты кишечника (молочнокислых микроорганизмов) до уровней, соответствующих их физиологическим параметрам (рисунок 1).
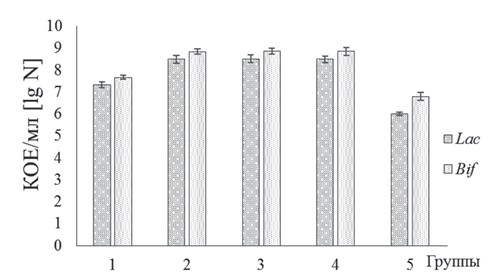
Рис. 1. Численность молочнокислых микроорганизмов (КОЕ/г фека лия) в содержимом кишечника бройлеров кросса Кобб500 с клиниче скими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок Сравнительная оценка содержимого кишечника опытных групп птиц показала следующее: в группе 1, 2, 3 и 4 количество Lactobacillus sp. было выше (p<0,05) соответственно в 21, 312, 325 и 328 раз по сравнению с группой 6. В указанных группах животных содержание Bifidobacterium sp. в кишечнике было больше в 7, 111, 115 и 115 раз (p<0,05) соответственно относительно контроля. Установлено, что в кишечном содержимом опытных бройлеров происходило достоверное снижение численности представителей условно-патогенных и патогенных микроорганизмов по отношению к контролю (рисунок 2).
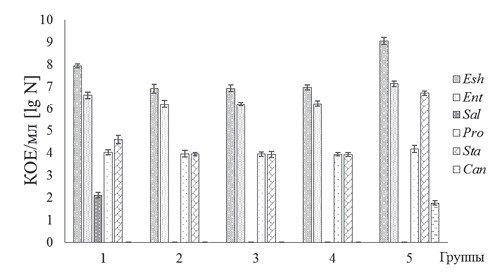
Рис. 2. Численность условно-патогенных и патогенных микроорганизмов (КОЕ/г фекалия) в содержимом кишечника бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок Как видно из рисунка 2, в группе 1, 2, 3 и 4 численность Escherichia sp. в кишечном содержимом птиц была ниже (p<0,05), соответственно, в 13, 139, 133 и 123 раза по сравнению с группой 6. У бройлеров указанных групп в кишечнике отсутствовали Salmonella sp. и Candida sp., в то время как отмечали их незначительное количество (1,30x102 и 5,71x101 К0Е/мл, соответственно) в контрольной группе. Количество остальных условно-патогенных микроорганизмов в кишечном содержимом птицы варьировало в зависимости от используемой добавки и оказалось наименьшим в 3-й опытной группе. У цыплят указанной группы содержание бактерий родов Enterococcus, Proteus и Staphylococcus было меньше (р<0,05), соответственно, в 9, 2 и 617 раз относительно контроля. Показателем, позволяющим установить эффективность разрабатываемых средств лечения кишечных инфекций животных, является скорость восстановления микробиоты кишечника последних (СВМК) [16, 28]. По сравнению с экспериментальным образцом пробиотика исследуемые метабиотик и метапробиотик обладали высокими значениями СВМК молодняка мясной птицы с клиническими признаками кишечной инфекции и микотоксикоза. Скорость восстановления численности кишечных Lactobacillus sp. и Bifidobacterium sp. под влиянием экспериментального образца метапробиотика была выше соответственно в 11 500 и 4 484 раза относительно контроля (самовосстановления микробиоты кишечника). Экспериментальный образец метабиотика не значительно уступал по терапевтической эффективности метапробиотику: скорость восстановления содержания кишечных Lactobacillus sp. и Bifidobacterium sp. была больше соответственно в 11 036 и 4 315 раз по сравнению с контролем. Одновременное применение экспериментальных образцов метапробиотика и полиферментного препарата цыплятам оказывало наибольшее влияния на СВМК. По скорости восстановления Lactobacillus sp. и Bifidobacterium sp. комбинация указанных добавок превосходила в 11 600 и 4 541 раза аналогичные показатели контрольной группы животных. В работе оценивали влияние разработанных нами экспериментальных образцов биодобавок на физиолого-биохимические особенности организма цыплят-бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза. Морфо-биохимические показатели крови имеют существенное значение в установлении физиологического статуса и состояния здоровья сельскохозяйственной птицы [18, 32]. Проведенный анализ гематологических показателей бройлеров контрольной и опытных групп показал, что применение экспериментальных образцов функциональных добавок приводило к повышению количества эритроцитов, лейкоцитов и гемоглобина в крови до уровней, соответствующих их физиологическим параметрам (табл. 1). Таблица 1 Гематологические показатели бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок
Сравнительная оценка показателей птиц показала следующее: в группе 1, 2, 3 и 4 отмечается достоверное повышение (р<0,05), соответственно, количества эритроцитов на 9,86, 15,02, 16,43 и 17,24%, лейкоцитов на 12,71, 18,52, 19,72 и 21,18% и гемоглобина на 10,21, 20,34, 22,90 и 24,91% по сравнению с контролем. Наибольшее увеличение значений указанных параметров отмечали у цыплят 4-й опытной группы. При сравнении результатов гематологических исследований опытных животных наблюдали достоверное повышение (р<0,05) содержания эритроцитов на 7,27%, лейкоцитов на 7,51% и гемоглобина на 13,14% в группе 4 относительно значений данных показателей 1-й группы. Наблюдаемое повышение содержания лейкоцитов в опытных группах птиц свидетельствует о возможном восстановлении функции лимфоидных органов и повышении резистентности организма цыплят-бройлеров. Сравнительное исследование изучаемых биодобавок показало снижение уровня СОЭ в крови птиц экспериментальных групп по отношению к контролю: для 1-й опытной группы она составила 2,30+0,03 мм/ч, для 2-й опытной - 2,14+0,05 мм/ч, для 3-й опытной - 2,13+0,04 мм/ч, для 4-й опытной - 2,07+0,03 мм/ч, а для контрольной - 2,79±0,04 мм/ч. Наибольшая СОЭ отмечали у цыплят 4-й группы. В данной опытной группе наблюдали достоверное уменьшение (р<0,05) уровня СОЭ в крови бройлеров на 17,56 и 23,66 %, по сравнению со значениями данного показателя 1-й опытной и контрольной групп соответственно. Анализ биохимических показателей птиц контрольной и опытных групп показал, что применение экспериментальных образцов функциональных добавок приводило к их нормализации до уровней, соответствующих физиологическим параметрам (рисунок 3, 4 и 5, табл. 2 и 3).
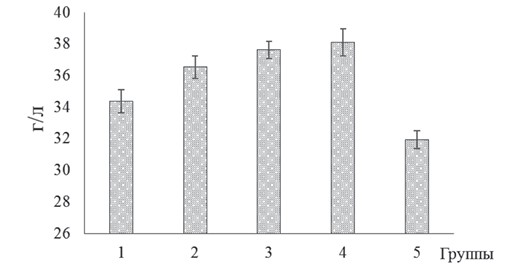
Рис. 3. Содержание общего белка сыворотки крови бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок Установлено, что значение содержания общего белка (рисунок 3) варьировало (34,36-38,10 г/л) в зависимости от используемой добавки и оказалось наибольшей в 4-й опытной группе, где указанный показатель был на 10,88 и 19,29% выше (р<0,05), чем соответственно в 1-й группе и контроле. Сравнительно высокие значения концентрации общего белка в указанной группе птиц происходило за счет увеличения (р<0,05) в сыворотке крови фракции альбуминов и подфракции Y-глобулинов. Результаты исследования влияния экспериментальных образцов функциональных добавок на соотношение белковых фракций сыворотки крови бройлеров с клиническими признаками кишечной инфекции и микотоксикоза приведены в таблице 2. Таблица 2 Процентное соотношение белковых фракций сыворотки крови бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок
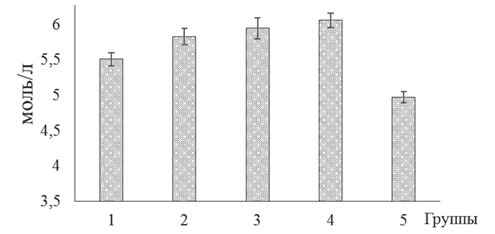
Содержание альбуминов и Y-глобулинов в составе общего белка сыворотки крови находилось соответственно в пределах от 37,68±0,94 и 24,85±0,59% у бройлеров контрольной группы до 50,51±1,26 и 29,77±0,71% в 4-й группе. Наблюдаемые сравнительно высокие значения концентрации общего белка сыворотки крови мясных птиц опытных групп свидетельствует о положительном воздействии экспериментальных образцов биодобавок на показатель усвояемости питательных веществ рациона, а также состав и функциональную активность микробного сообщества кишечника. В результате применения исследуемых биодобавок установлено повышение содержания глюкозы в крови бройлеров экспериментальных групп по отношению к контролю: для 1-й опытной группы оно составила 5,51±0,09 моль/л, для 2-й опытной - 5,83±0,12 моль/л, для 3-й опытной - 5,95±0,15 моль/л, для 4-й опытной - 6,06±0,10 моль/л, а для контрольной - 4,97±0,08 моль/л (рисунок 4).
Рис. 4. Содержание глюкозы сыворотки крови бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок Наряду с этим у птиц опытных групп отмечено значительное снижение уровня показателей белкового и жирового обменов в сыворотке их крови (табл. 3). Так, у цыплят 4-й группы в крови содержание мочевины, билирубина и холестерина было ниже (р<0,05) соответственно на 21,95, 19,97 и 17,45% относительно контроля. Таблица 3 Показатели белкового и жирового обменов бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок
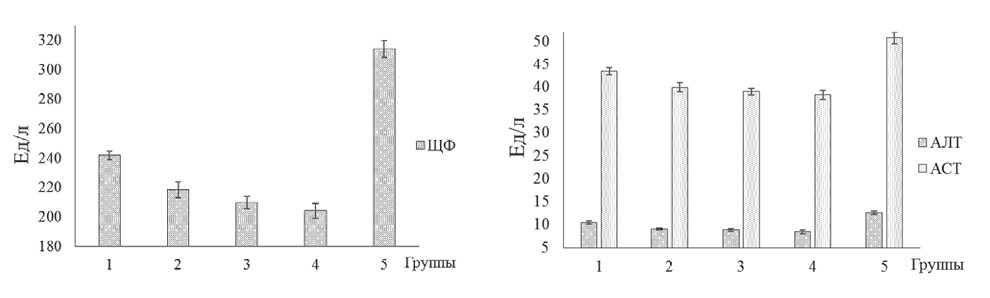
Полученные нами данные свидетельствуют о нормализации процессов метаболизма углеводов, липидов и белков в организме молодняка мясных птиц, которым выпаивали экспериментальные образцы биодобавок. На рисунке 5 представлены результаты исследований по оценке влияния исследуемых биодобавок на показатели функционального состояния печени бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза.
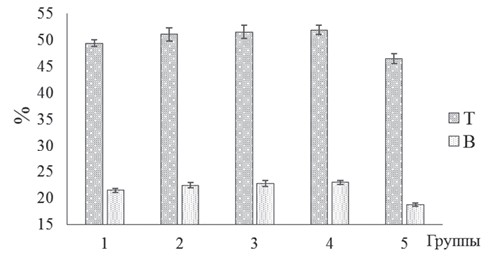
Рис. 5. Активность ЩФ, АЛТ и АСТ сыворотки крови бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок Значения активности специфических ферментов печени молодняка птиц варьировали в зависимости от используемой добавки и оказались наименьшими в 4-й опытной группе. У бройлеров указанной группы в сыворотке крови активность АЛТ, АСТ и ЩФ была ниже (р<0,05), соответственно, на 32,83, 24,91 и 35,03% по сравнению с контролем. Полученные нами данные свидетельствуют о том, что использование экспериментальных образцов биодобавок оказывает положительное влияние на функциональное состояние печени, сердца и пищеварительного тракта молодняка мясных птиц. Исследование показателей неспецифической и специфической резистентности организма цыплят показало, что применение экспериментальных образцов биодобавок приводило к повышению количества В- и Т-лимфоцитов (рисунок 6), ФА нейтрофилов и ЛА сыворотки крови (рисунок 7).
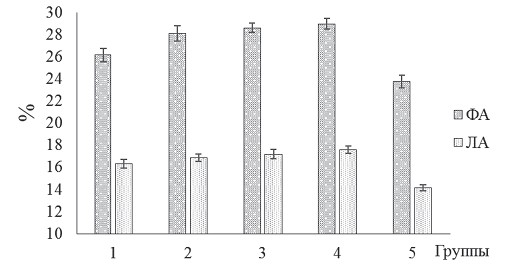
Рис. 6. Содержание Т- и В- лимфоцитов (%) в крови бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок Сравнительный анализ содержания Т-лимфоцитов в крови птиц показал следующее: в группах 1, 2, 3 и 4 отмечается достоверное повышение (р<0,05) количества данных клеток соответственно на 6,19, 9,82, 10,79 и 11,56% относительно контроля (рисунок 6). Аналогичную закономерность отмечали и при оценке содержания B-лимфоцитов в крови молодняка птиц. Количество B-лимфоцитов крови цыплят колебалась на уровне 18,79-21,87%. Тем не менее, бройлеры опытных групп имели большее содержание указанных популяций лейкоцитов на 10,53-16,39% по сравнению с птицами контрольной группы. Сравнительное исследование влияния экспериментальных образцов биодобавок на ФА нейтрофилов крови бройлеров кросса Кобб-500 показало следующее: в группах 1, 2, 3 и 4 отмечается достоверное повышение (р<0,05) указанного показателя соответственно на 9,08, 17,20, 19,33 и 20,87% по отношению к контролю (рисунок 7).
Рис. 7. Показатели ФА нейтрофилов и ЛА сыворотки (%) крови бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок Сходная тенденция установлена нами и при оценке лизоцим-ной активности в сыворотки крови птиц. Значения указанного показателя бройлеров экспериментальных групп были на уровне 16,32-17,58%, что достоверно выше контроля на 8,73-17,12%. Полученные нами данные свидетельствуют о том, что использование экспериментальных образцов биодобавок оказывает стимулирующее воздействие на гуморальные и клеточные факторы иммунитета молодняка мясной птицы при кишечных инфекциях и его микотоксикозах. Известно, что пробиотики, метапробиотики и метабиотики способны к коррекции состава микробиоценоза желудочно-кишечного тракта, усилению иммунной системы, повышению усвояемости различных компонентов рациона, деструкции токсичных веществ и нормализации функционального состояния организма животных, включая птиц [11, 13, 15, 17, 19]. В таблице 4 представлены показатели продуктивности и сохранности бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения пробиотика, метабиотика, метапробиотика и полиферментного препарата. Таблица 4 Показатели продуктивности и сохранности бройлеров кросса Кобб-500 с клиническими признаками кишечной инфекции и микотоксикоза на фоне применения исследуемых биодобавок
Сравнительное исследование изучаемых биодобавок показало повышение абсолютного прироста живой массы птиц в эксперимен- тальных группах по отношению к контролю: для 1-й опытной группы он составил 1 210±10 г, для 2-й опытной - 1 232±11 г, для 3-й опытной - 1 241±18 г, для 4-й опытной - 1 254±27 г, а для контрольной -2 194±52 г. Наибольший среднесуточный привес отмечали у цыплят 4-й группы. В данной опытной группе наблюдали достоверное увеличение (р<0,05) среднесуточного прироста живой массы бройлеров на 3,64 и 6,36%, по сравнению со значениями данного показателя 1-й опытной и контрольной групп соответственно. Сохранность сельскохозяйственной птицы опытных групп составила 100%, что выше на 25% относительно контроля. Проведенный анализ полученных в настоящей работе данных свидетельствует о более низкой эффективности пробиотика по отношению к метапробиотику и метабиотику как средствам коррекции вызванных действием патогенных факторов микроэкологиче-ских нарушений кишечника молодняка мясной птицы. Заключение. На основании проведенных исследований показана способность разработанных нами экспериментальных образцов биодобавок к нормализации микроэкологических нарушений кишечника, морфо-биохимических и иммунологических показателей крови молодняка сельскохозяйственной птицы с клиническими признаками кишечной инфекции и микотоксикоза. В этом плане комбинация метапробиотика и полиферментного препарата характеризовалась наиболее высокой эффективностью. Работа выполнена при финансовой поддержке гранта Президента Российской Федерации № МК-2439.2022.5 «Новые подходы с использованием пробиотиков, метабиотиков и бактериальных ферментов для коррекции вызванных действием патогенных факторов микроэкологических нарушений кишечника молодняка сельскохозяйственной птицы» (соглашение № 075-15-2022-414/1 от «30» марта 2023 г.). Список литературы: 1. Бактериальное сообщество слепых отростков кишечника цыплят-бройлеров на фоне питательных рационов различной структуры/ В. И. Фисинин, Л. А. Ильина, Е. А. Йылдырым [и др.] // Микробиология. 2016. Т. 85. № 4. С. 472-480. 2. Бактерии - антагонисты возбудителей кишечных инфекций и продуценты комплекса целлюлаз как основа для создания добавок, объединяющих функции пробиотика и кормового фермента/ Л. Р. Валиуллин, Риш. С. Мухаммадиев, Рин. С. Мухаммадиев [и др.] // Достижения науки и техники АПК. 2021. Т. 35. № 9. С. 60-66. 3. Биопрепараты микробного происхождения в птицеводстве/ Н. В. Феоктистова, А. М. Марданова, М. Т. Лутфуллин [и др.] // Ученые записки Казанского университета. Серия Естественные науки. 2018. Т. 160. № 3. С. 395-418. 4. Влияние антибиотиков, использующихся в животноводстве, на распространение лекарственной устойчивости бактерий (обзор) / И. С. Сазы-кин, Л. Е. Хмелевцова, Е. Ю. Селиверстова [и др.] // Прикладная биохимия и микробиология. 2021. Т. 57. № 1. С. 24-35. 5. Влияние пробиотиков Bacillus subtilis GM2 и GM5 на рост и усвояемость кормов у цыплят-бройлеров/ Г. Ф. Хадиева, М. Т. Лутфуллин, А. А. Николаева [и др.] // Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2019. Т. 161, кн. 3. С. 472-489. 6. Гиндуллин, А. И. Пробиотики «Спас» И «Биоспорин» при Т-2 микотоксикозе кур-бройлеров / А. И. Гиндуллин, М. Я. Тремасов // Успехи медицинской микологии. 2013. Т. 11. С. 284-286. 7. Гласкович, А. А., Капитонова Е.А., Аль Акаби А.Р.А. Сравнительная эффективность влияния пробиотических препаратов «Ветлактофлор-М» и «Диалакт» на биоценоз кишечника цыплят-бройлеров / А. А. Гласкович, Е. А. Капитонова, А. Р. А. Аль Акаби // Ветеринарный журнал Беларуси. 2016. № 2. С. 31-34. 8. Консорциум бактерий как перспективная добавка с пробиотическими свойствами для птицеводства/ Р.С. Мухаммадиев, Р.С. Мухаммадиев, А.С. Мухаммадиева [и др.] // Инновационные решения стратегических задач агропромышленного комплекса: мат. Междунар. науч.-практ. конф., посвящ. 80-летию Удмуртского ГАУ. 2023. С. 208-215. 9. Костиков, А. Л. Кроссы мясных цыплят отечественной и зарубежной селекции / А. Л. Костиков, Н. В. Самбуров // Вестник Курской государственной сельскохозяйственной академии. 2014. № 5. С. 62-65. 10. Лютых, О. Микотоксины в птицеводстве - угроза здоровью человека / О. Лютых // Эффективное животноводство. 2020. № 2. С. 32-38. 11. Метапробиотики вместо антибиотиков/ Е. А. Йылдырым, Л. А. Ильина, Д. Г. Тюрина [и др.] // Птицеводство. 2020. № 11. С. 33-39. 12. Микотоксины и микотоксикозы животных - актуальная проблема сельского хозяйства/ Р.С. Овчинников, А.В. Капустин, А.И. Лаишевцев, В.А. Савинов// Российский журнал Проблемы ветеринарной санитарии, гигиены и экологии. 2018. № 1. С. 114-123. 13. Нейтрализация метаболитов Fusarium в растительном сырье/ Л. Р. Валиуллин, Риш. С. Мухаммадиев, Рин. С. Мухаммадиев [и др.] // Достижения науки и техники АПК. 2020. Т. 34. № 12. С. 73-77. 14. Новые штаммы Lactobacillus acidophilus как перспективные пробиотики для птицеводства/ Л. Р. Валиуллин, Р. С. Мухаммадиев, Р. С. Мухам-мадиев [и др.] // Ветеринария Кубани. 2022. № 6. С. 16-21. 15. Новые штаммы микроорганизмов как перспективные добавки с функциональными свойствами для птицеводства/ Р. С. Мухаммадиев, Р. С. Мухаммадиев, А. И. Яруллин [и др.] // Актуальные проблемы аграрной науки: прикладные и исследовательские аспекты: мат. III Всеросс. (нац.) на-уч.-практ. конф. 2023. С. 98-101. 16. Оптимизация параметров совместного культивирования Bacillus subtilis GA27 и Bacillus subtilis RF-45 для возможности создания пробиотиков, метапробиотиков и метабиотиков для птицеводства / Р. С. Мухам-мадиев, Р. С. Мухаммадиев, Л. Р. Валиуллин [и др.] // Ветеринария Кубани. 2023. № 3. С. 32-38. 17. Оптимизация состава питательной среды пробиотического штамма B. subtilis GA24 - продуцента кормовых ферментов / Р. С. Мухаммадиев, Л. Р. Валиуллин, Р. С. Мухаммадиев [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2022. Т. 250. № 2. С. 155-159. 18. Орлова Т. Н. Влияние пробиотического препарата «Пропионовый» на продуктивные качества и гематологические показатели цыплят-бройлеров / Т. Н. Орлова // Вестник НГАУ (Новосибирский государственный аграрный университет). 2019. № 3. С. 98-104. 19. Параметры острой токсичности и кожно-раздражающего потенциала кормовой композиции с метапробиотическими свойствами / Г. Л. Латыпов, А. С. Мухаммадиева, Л. Р. Валиуллин [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2023. Т. 253. № 1. С. 174-179. 20. Пробиотик в качестве профилактического средства при афлаток-сикозе поросят/ Т. А. Шамилова, Л. Е. Матросова, Э. И. Семенов [и др.] // Достижения науки и техники АПК. 2012. № 3. С. 67-69. 21. Пробиотики на основе бактерий рода Bacillus в птицеводстве / Н. В. Феоктистова, А. М. Марданова, Г. Ф. Хадиева [и др.] // Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2017. Т. 159. № 1. С. 85-107. 22. Продовольственная безопасность как элемент национальной безопасности страны / А. Н. Столярова, Л. В. Шамрай-Курбанова, О. В. Даре-лина [и др.] // Продовольственная политика и безопасность. 2023. Т. 10. № 2. С. 219-236. 23. Роль лактобактерий используемых в качестве основы пробиотика «Спас» в профилактике микотоксикоза / Т. А. Шамилова, Л. Е. Матросова, М. Г. Нуртдинов, В. П. Коростылева // Ветеринарный врач. 2013. № 3. С. 10-13. 24. Сарунова, М. П. Роль сельскохозяйственного региона в обеспечении продовольственной безопасности России / М. П. Сарунова, Л. Ц. Бад-махалгаев // Экономическая политика и финансовые ресурсы. 2022. Т. 1. № 1. С. 10-19. 25. Сравнительная оценка in vitro эффективности метабиотической и метапробиотической композиций, перспективных для применения в птицеводстве / Р. С. Мухаммадиев, Р. С. Мухаммадиев, Л. Р. Валиуллин [и др.] // 2023. С. 813-816. 26. Сравнительная оценка влияния вирджиниамицина и пробиотика на состав кишечного микробиома и зоотехнические показатели цыплят-бройлеров (Gallus gallus L.) / Д. Г. Тюрина, Г. Ю. Лапев, Е. А. Йылдырым [и др.] // Сельскохозяйственная биология. 2020. Т. 55. № 6. С. 1220-1232. 27. Сравнительная оценка эффективности пробиотической и мета-биотической добавок при коррекции нарушений кишечной микробиоты животных с антибиотик-индуцированным дисбиозом / Р. С. Мухаммадиев, Р. С. Мухаммадиев, Р. Р. Тимербаева [и др.] // 2023. С. 67-73. 28. Сравнительная экспериментальная оценка эффективности современных пробиотиков, пребиотиков, синбиотиков и метабиотиков при коррекции нарушений микробиоценоза кишечника у животных с антибиотико-ассоциированным дисбиозом / И. Ю. Чичерин, И. П. Погорельский, И. Г. Лундовских [и др.] // Экспериментальная и клиническая гастроэнтерология. 2016. № 7. С. 106-120. 29. Технология содержания и кормления родительского стада мясных кур и цыплят-бройлеров / В. С. Буяров, А. В. Буяров, М. А. Талалаева [и др.] // Биология в сельском хозяйстве. 2023. № 2. С. 5-11. 30. Bacillus subtilis M6 improves intestinal barrier, antioxidant capacity and gut microbial composition in AA broiler/ L. Ji, L. Zhang, H. Liu, J. Shen, Y. Zhang, L. Lu, X. Zhang, X. Ma// Front. Nutr. 2022. 9. 965310. DOI: 10.3389/ fnut.2022.965310. 31. Biernasiak J, Piotrowska M, Libudzisz Z. Detoxification of mycotoxins by probiotic preparation for broiler chickens// Mycotoxin. Res. 2006. 22(4). 230-235. DOI: 10.1007/BF02946747. 32. Comparative efficacy of postbiotic, probiotic, and antibiotic against necrotic enteritis in broiler chickens/ W.A. Abd El-Ghany, M.A. Abdel-Latif, F. Hosny, N.M. Alatfeehy, A.E. Noreldin, R.R. Quesnell, R. Chapman, L. Sakai, A.R. Elbestawy// Poult. Sci. 2022. 101(8). 101988. DOI: 10.1016/j. psj.2022.101988. 33. Guerre P. Mycotoxin and gut microbiota interactions// Toxins (Basel). 2020. 12(12). 769. DOI: 10.3390/toxins12120769. 34. Liew W.P., Mohd-Redzwan S. Mycotoxin: its impact on gut health and microbiota// Front. Cell. Infect. Microbiol. 2018. 8. 60-77. DOI: 10.3389/ fcimb.2018.00060. 35. Mycotoxins in poultry feed and feed ingredients from sub-Saharan Africa and their impact on the production of broiler and layer chickens: a review/ P.E. Ochieng, M.L. Scippo, D.C. Kemboi, S. Croubels, S. Okoth, E.K. Kang’ethe, B. Doupovec, J.K. Gathumbi, J.F. Lindahl, G. Antonissen// Toxins (Basel). 2021. 13(9). 633-661. DOI: 10.3390/toxins13090633. 36. Park Y.H., Hamidon F., Rajangan Ch. Application of probiotics for the production of safe and high-quality poultry meat// Korean J. Food Sci. Anim. Resour. 2016. 36(5). 567-576. DOI: 10.5851/kosfa.2016.36.5.567. 37. Pretreatment with probiotics ameliorate gut health and necrotic enteritis in broiler chickens, a substitute to antibiotics/ D.S. Rajput, D. Zeng, A. Khalique, S.S. Rajput, H. Wang, Y. Zhao, N. Sun, X. Ni// AMB Express. 2020. 10(1):220-231. DOI: 10.1186/s13568-020-01153-w. Резюме. В работе представлены результаты сравнительной оценки эффективности пробиотика, метабиотика и бактериальных ферментов при коррекции нарушений микробиоты кишечника, морфо-биохимических и иммунологических показателей крови у молодняка мясной птицы с клиническими признаками кишечной инфекции и микотоксикоза. Установлено, что исследуемые биодобавки характеризовались способностью к нормализации указанных параметров. В этом плане наиболее высокую эффективность показал подход с использованием метапробиотика и по-лиферментного препарата. По скорости восстановления Lactobacillus sp. и Bifidobacterium sp. комбинация метапробиотика и полиферментного препарата превосходила в 11600 и 4541 раза аналогичные показатели контрольной группы животных. Применение цыплятам-бройлерам данного подхода способствовало нормализации гематологических (повышение количества эритроцитов, лейкоцитов и гемоглобина соответственно на 17,24, 21,18 и 24,91 %) и биохимических (повышение концентрации общего белка и глюкозы соответственно на 19,29 и 21,93 %; снижение содержания мочевины, билирубина и холестерина соответственно на 21,95, 19,97 и 17,45 %; уменьшение активность ферментов АЛТ, АСТ и ЩФ на 32,83, 24,91 и 35,03 %) показателей крови, а также оказывало стимулирующее воздействие на гуморальные и клеточные факторы их иммунитета (повышение количества В- и Т-лимфоцитов на 11,56 и 16,39 %, фагоцитарной и лизоцимной активностей на 20,87 и 17,58 % соответственно). Ключевые слова: пробиотик, метабиотик, метапробиотик, бактериальные ферменты, коррекция нарушений кишечника, морфо-биохимические и иммунологические показатели крови, эффективность, птицеводство. Сведения об авторах: Мухаммадиев Ринат Салаватович, кандидат биологических наук, научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии», 143050, Московская обл., Одинцовский р-н, р. п. Большие Вяземы, ул. Институт, вл. 5; сектора пробиотических препаратов и ферментов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-987-4214127; е-mail: tanirtashir@mail.ru. Валиуллин Ленар Рашитович, кандидат биологических наук, старший научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; 143050, Московская обл., Одинцовский р-н, р. п. Большие Вяземы, ул. Институт, вл. 5; заведующий лабораторией кормов и кормовых добавок ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-950-9698469; е-mail: valiullin27@mail.ru. Барышев Михаил Геннадьевич, доктор биологических наук, профессор, профессор РАН, и.о. директора ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; 143050, Московская обл., Одинцовский р-н, р. п. Большие Вяземы, ул. Институт, вл. 5; тел.: 8-495-5974228; е-mail: vniif@vniif.ru. Каримуллина Ильсияр Габделгазизовна, кандидат биологических наук, старший научный сотрудник отдела вирусных и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-904-7699225; е-mail: 8-904-7699225@mail.ru. Яковлев Сергей Игоревич, кандидат ветеринарных наук, научный сотрудник лаборатории вирусных антропозоонозов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-987-1850752; е-mail: arena176@rambler.ru Яруллин Айнур Ильнурович, кандидат биологических наук, ведущий научный сотрудник, заведующий отделения вирусологических и ультра-структурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-905-3174170; е-mail: abii@mail.ru. Ответственный за переписку с редакцией: Мухаммадиев Ришат Салаватович, кандидат биологических наук, старший научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии», 143050, Московская обл., Одинцовский р-н, р. п. Большие Вяземы, ул. Институт, вл. 5; лаборатории кормов и кормовых добавок ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-939-3728789; e-mail: tashir9891@mail.ru.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|