УДК 578.823:619
DOI 10.33861/2071-8020-2024-6-28-31
Веретенников В. В., Тарлавин Н. В., Красков Д. А., Джавадов Э. Д. Федеральное государственное бюджетное образовательное
учреждение высшего образования «Санкт-Петербургский государственный университет ветеринарной медицины»,
г. Санкт-Петербург
Румянцев А. М., Иштуганова В. В. Федеральное государственное бюджетное образовательное учреждение высшего
образования «Санкт-Петербургский государственный университет», г. Санкт-Петербург
Вирус инфекционной бурсальной болезни (ИББ), представитель рода Avibirnavirus семейства Birnaviridae [1], является возбудителем высококонтагиозного заболевания, поражающего цыплят. У птиц, инфицированных вирусом ИББ, развивается иммунодефицит вследствие поражения В-лимфоцитов, что повышает их восприимчивость к вторичным бактериальным болезням и снижает продуктивность. Геном вируса состоит из двух сегментов А и В, которые кодируют пять вирусных белков, VP1, VP2, VP3, VP4 и VP5. Белок VP2 является основным защитным антигеном, содержащим эпитопы, отвечающие за выработку нейтрализующих антител против вируса ИББ [11].
В настоящее время белок VP2 был синтезирован в различных системах экспрессии, таких как кишечная палочка [5], бакулови-рус [7] и дрожжи [1]. Хотя бакуловирусная система наиболее часто используется для получения данного белка, она относительно малопродуктивна и дорогостояща. По сравнению с этим, система экспрессии на основе бактерий E. coli является более удобной и экономичной для производства рекомбинантных белков в промышленных масштабах.
Ранее была продемонстрирована возможность эффективного применения рекомбинантного белка VP2 в качестве антигена в реакции диффузионной преципитации (далее, РДП) [4]. Метод РДП позволяет выявлять наличие специфических антител, например, к вирусу ИББ, в сыворотке крови птиц после вакцинации или при возникновении заболевания. Для этих целей активно используются и другие подходы, в частности метод иммуноферментного анализа (далее, ИФА) [9].
Чтобы обеспечить высокую специфичность проводимых анализов необходимо использовать очищенный рекомбинантный белок. Одним из первых и важнейших этапов его очистки является концентрация белков после лизиса клеток организма продуцента, в частности бактерий E. coli. Для этой цели могут быть использованы различные подходы [3], среди которых одним из наиболее простых и эффективных является метод осаждения с помощью сульфата аммония [10].
Целью работы являлась оптимизация условий концентрации рекомбинантного белка VP2 вируса ИББ с использованием метода осаждения белка сульфатом аммония.
Материалы и методы исследований. Плазмида, штаммы бактерий и условия культивирования. В работе использована полученная ранее плазмида pET23a-VP2, которая содержит последовательность гена оболочечного гликопротеина VP2 от эпизоотического штамма инфекционной бурсальной болезни «Синявинский» [5]. Для синтеза белков использовали штамм бактерий Escherichia coli BL21(DE3) pLysS (генотип: F-ompT gal dcm lon hsdSB(rB-mB-) A(DE3 [lacI lacUV5-T7p07 indl sam7 nin5]) [malB+]K-12(AS) pLysS(CamR), Евроген, Россия).
Для культивирования бактерий использовали среду LB: l% триптон, 0.5% дрожжевой экстракт, l70 мМ NaCl, 2.4% агар (если среда твердая). Культуры бактерий E. coli рутинно выращивали в термостате при температуре 37°С. При синтезе белка температуру понижали. Для индукции синтеза белка в среду добавляли изопро-пил-р^-1-тиогалакгопиранозид (ИПТГ) в концентрации 0,1 мМ.
Лизис клеток бактерий и анализ синтезируемых белков. После культивирования клетки бактерий собирали центрифугированием (5 минут при 5000 об/мин). Среду удаляли и осадок клеток разводили в фосфатно-солевом буфере (PBS, 0,01 M, pH 7,4) в объёме, соответствующем 1/5 объёма исходной культуры. Клетки разрушали с использованием ультразвука, после чего остатки клеток собирали центрифугированием (15 минут при 10000 об/мин). Далее отбирали надосадочную жидкость, содержащую растворимые белки, которую использовали в экспериментах с переосаж-дением сульфатом аммония. Для определения концентрации белков использовали набор ProteoOrange (Люмипроб РУС, Россия).
Электрофорез белков в полиакриламидном геле в денатурирующих условиях проводили согласно общеизвестной методике [3]. Для проведения вестерн-блот гибридизации гель после проведения электрофореза инкубировали 10 минут в буфере для переноса (на 1 л: трис - 3 г, глицин -14,4 г и 20% метанола). Перенос проводили в течении 45 минут при 70 В. Далее нитроцеллюлозную мембрану инкубировали в TBST-буфере с BSA (10 мМ трис (pH 8.0), 150 мМ NaCl, 1% BSA (бычий сывороточный альбумин)) в течение 2 часов при 25°C. Затем переносили мембрану в буфер TBST-BSA с антителами против гистидиновой метки, конъюгированными с пероксидазой (разведение 1:5000, ARG41953, Arigo, Тайвань) и инкубировали 1 час при 37°С. Трижды промывали мембрану буфером TBST-BSA в течении 5 минут.
Реакция диффузионной преципитации. В качестве антигена использовали лизаты бактериальных клеток, синтезирующих рекомбинантный белок VP2 ИББ, и пробы фракций белков после переосаждения. В качестве диагностической сыворотки использовали сыворотку крови кур кросса Lohmann Brown, полученную после вакцинации на базе ФГБОУ ВО СПбГУВМ с титром антител на вирус ИББ в ИФА (1:10 000) [1].
РДП проводили по стандартной методике [6]. Готовили агаровую среду, состоящую из 1 % агара «Дифко» (Becton Dickinson, США) и 8% раствора NaCl. Пробы с рекомбинантным белком VP2 вируса ИББ исследовали методом последовательных двукратных разведений, начиная с цельного разведения и до 1:32. Диагностическую сыворотку разводили физиологическим раствором 1:2 и последовательным двукратным шагом доводили до разведения 1:8. После заполнения лунок чашки Петри помещали в термостат и инкубировали при температуре + 37°С. Учет результатов проводили через 48-72 ч. после постановки реакции.
Результаты исследований и их обсуждение. Белок VP2 вируса ИББ синтезировали в клетках штамма бактерий E. coli BL21 (DE3) pLysS, содержащих плазмиду pET23a-VP2 [5]. Получали клеточные лизаты, содержащие растворимый рекомбинантный белок. Использовали схему осаждения белка, выбранную на основе предварительных экспериментов. Для расчёта концентраций сульфата аммония использовали стандартные таблицы [8].
На первом этапе 10 мл клеточного лизата растворяли 1,14 г сульфата аммония (до концентрации 20%). Пробы инкубировали в течении 1 часа при + 4°C и центрифугировали при 10000 g. Отбирали надосадочную жидкость и разводили осажденные белки в 10 мл фосфатно-солевого буфера (PBS, 0,01 M, pH 7,4).
На втором этапе в 10 мл надосадочной жидкости растворяли 1,23 г сульфата аммония, доводя его концентрацию до 40%. Повторяли осаждение аналогично первому этапу. Отбирали надосадочную жидкость и разводили осажденные белки в 10 мл буфера PBS.
На третьем этапе в 10 мл надосадочной жидкости растворяли 1,32 г сульфата аммония, доводя его концентрацию до 60%. Повторяли осаждение аналогично предыдущим этапам. Также отбирали надосадочную жидкость и разводили осажденные белки в 10 мл буфера PBS.
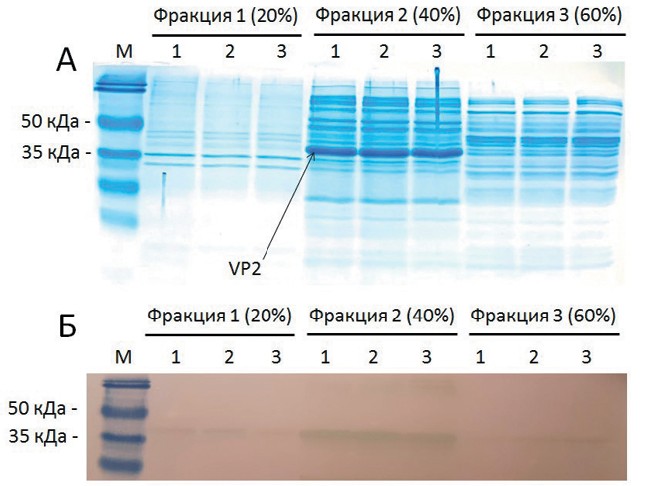
Полученные фракции белков анализировали с помощью методов электрофореза и вестерн-блот гибридизации (рисунок 1).

Рис. 1: а - электрофореграмма фракций белков из лизата клеток штамма-продуцента, синтезирующего рекомбинантный белок VP2 (фракция 1 - белки, осаждающиеся при концентрации сульфата аммония 20%; фракция 2 - белки, которые остались в растворе при концентрации сульфата аммония 20%, осажденные при концентрации 40%; фракция 3 -белки, которые остались в растворе при концентрации сульфата аммония 40%, осажденные при концентрации 60%; эксперимент проводили в трёх повторностях (1, 2, 3); М - маркер размеров белков (Pierse Prestained Protein MW Marker, ThermoFisherScientific, США); б - результаты ве-стерн-блот гибридизации осажденных белков из разных фракций.
Было показано, что рекомбинантный белок VP2 эффективно осаждается из клеточного лизата при концентрации сульфата аммония 40%. Результаты вестерн-блот гибридизации (рисунок 1 б) продемонстрировали, что фракции 1 и 3 содержат лишь малые количества рекомбинантного белка. Основная его часть осаждается в составе фракции 2 (40% сульфата аммония). Это позволяет концентрировать получаемые лизаты и проводить частичную очистку белка. Для того, чтобы оценить эффективность такого этапа очистки были измерены концентрации белков в соответствующих фракциях (табл. 1).
Таблица 1 Концентрации белков в различных фракциях, полученных в ходе переосаждения сульфатом аммония
|
| Фракция 1 (20%) | Фракция 2 (40%) | Фракция 3 (60%) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Повторность | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 |
| Концентрация белков, мкг/мл | 287 | 281 | 295 | 654 | 653 | 655 | 333 | 304 | 327 |
| Среднее значение концентрации белков, мкг/мл | 288 | 651 | 321 | ||||||
| Стандартная ошибка среднего | ±4 | ±3 | ±9 | ||||||
| Доля фракции от общего количества белка | 23% | 52% | 25% | ||||||
Исходя из концентраций белков, было рассчитано, что фракция 1 содержит 23% осажденных белков, фракция 2 - 52%, а фракция 3 - 25%. Подавляющее количество белка VP2 наблюдается именно во второй фракции (рисунок 1 б). Таким образом, предлагаемый подход позволяет избавиться от примерно половины примесных белков, сохраняя нужный рекомбинантный белок.
Для того, чтобы проверить сохраняет ли переосажденный белок антигенную активность с образцами фракций были проведены реакции диффузионной преципитации (рисунок 2).

Рис. 2. Реакция диффузионной преципитации с использованием образцов фракций и контроля
За положительный результат РДП принимали образование линии преципитации между лункой с диагностической сывороткой в разведении 1:8 (в центре) и антигеном (фракции белка) в разведении (по периферии). Наибольшее разведение антигена, дающее линию преципитации с диагностической сывороткой, являлось показателем титра антигена. Было показано, что титр антигена VP2 в РДП до переосаждения (контроль) был равен 1:16, как и в фракции 2, что говорит о том, что при концентрации и частичной очистке рекомбинантного белка потеря белка была незначительной. В фракции 1 и 3 полос преципитации не было обнаружено.
Заключение. Белок VP2 вируса ИББ является основным структурным и защитным белком и используется в качестве модели для разработки субъединичных вакцин. По сравнению с другими системами экспрессии, система экспрессии E. coli является более удобной, экономичной и быстрой для производства благодаря простоте выращивания и генетических манипуляций. Для получения белков VP2 более высокой чистоты часто используются методы аффинной хроматографии, градиентного центрифугирования сахарозы и градиентного центрифугирования хлорида цезия, однако эти процессы очистки не подходят для крупномасштабного производства. В данном исследовании белок VP2 был успешно экспрессирован в клетках E. coli и очищен с помощью осаждения насыщенным сульфатом аммония в различных концентрациях. Сульфат аммония обладает рядом свойств, которые делают его полезным. Он стабилизирует структуру белков, хорошо растворим, относительно недорогой и легко доступный материал.
В данном исследовании было показано, что использование сульфата аммония в концентрации 40% для очистки клеточного лизата способствовало тому, что титр рекомбинантного белка в РДП не снизился по сравнению с исходным, а количество примесных белков в растворе снизилось примерно на 50%. Полученные нами результаты подтверждают, что система экспрессии E. coli и метод очистки позволяют получать высокие концентрации рекомбинантного белка VP2 вируса ИББ.
Исследование выполнено за счет гранта Российского научного фонда № 24-26-20116 «Разработка отечественных серологических тест-систем для диагностики иммунодепрессивных болезней птиц» и Санкт-Петербургского научного фонда.
Список литературы:
1. Веретенников, В. В. Разработка рекомбинантной вакцины против инфекционной бурсальной болезни / В. В. Веретенников // 2022. 114 с.
2. Джавадов, Э. Вирусные болезни: диагностика и профилактика / Э. Джавадов // Животноводство России. 2015. № S1. С. 7-10.
3. Остерман, Л. А. Методы исследования белков и нуклеиновых кислот: / Л. А. Остерман // 2002. 247 с.
4. Реакция диффузионной преципитации с использованием рекомбинантного белка VP2 вируса инфекционной бурсальной болезни / В. В. Веретенников, Н. В. Тарлавин, Э. Д. Джавадов [и др.] // Международный вестник ветеринарии. 2024. № 3. С. 77-83.
5. Синтез рекомбинантных белков вируса инфекционной бурсальной болезни в бактериальной системе / В. В. Веретенников, Н. В. Тарлавин, Э. Д. Джавадов, А. М. Румянцев // Ветеринарный фармакологический вестник. 2022. № 4 (21). С. 22-29.
6. Сравнение чувствительности РДП и ИФА при обнаружении антигена вируса инфекционного энцефаломиелита птиц и специфических антител к нему / А. Э. Меньщикова, В. Н. Ирза, Н. В. Беляева [и др.] // Труды Федерального центра охраны здоровья животных. 2007. Т. 5. С. 361-366.
7. Liu Y. et al. Preparation of ChIL-2 and IBDV VP2 fusion protein by baculovirus expression system. Cell Mol Immunol. 2005. 231-235.
8. Scopes Robert K. Protein purification: principles and practice. 1994.
9. Wang M. et al. Development of an enzyme-linked immunosorbent assay for detecting infectious bursal disease virus (IBDV) infection based on the VP3 structural protein // Vet Microbiol. 2008. P. 229-236.
10. Wingfield P. Protein precipitation using ammonium sulfate. Curr Protoc Protein Sci. 2001.
11. Zhang W. et al. Over-40-Years-Epidemic of Infectious Bursal Disease Virus in China // Viruses. 2022. No. 14. P. 2253.
Резюме. Система экспрессии на основе бактерий E. coli является удобной и экономичной для производства рекомбинантных белков в промышленных масштабах. В данной работе был получен растворимый белок VP2 вируса инфекционной бурсальной болезни. Данный белок может быть использован в производстве диагностических тес-систем, но для обеспечения высокой специфичности проводимых анализов необходимо использовать очищенный рекомбинантный белок, поэтому в данном исследовании мы описали методику очистки и концентрации белка методом его осаждения насыщенным сульфатом аммония в различных концентрациях (20%, 40%, 60%). Было показано, что рекомбинантный белок VP2 эффективно осаждается из клеточного лизата при концентрации сульфата аммония 40%. Это способствовало тому, что титр рекомбинантного белка в РДП не снизился по сравнению с исходным, а количество примесных белков в растворе снизилось примерно на 50%.
Ключевые слова: птицеводство, инфекционная бурсальная болезнь, рекомбинантный белок VP2, сульфат аммония, реакция диффузионной преципитации.
Сведения об авторах:
Тарлавин Николай Владимирович, кандидат ветеринарных наук, ассистент кафедры эпизоотологии им. В. П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8430353; e-mail: tarlav1995@bk.ru.
Красков Дмитрий Андреевич, аспирант кафедры эпизоотологии им. В. П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-4152266; e-mail: kraskov-00@bk.ru.
Джавадов Эдуард Джавадович, доктор ветеринарных наук, профессор кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-9666774; e-mail: vnivip1@mail.ru.
Румянцев Андрей Михайлович, кандидат биологических наук, научный сотрудник кафедры генетики и биотехнологии ФГБОУ ВО «Санкт-Петербургский государственный университет»; 199034, г. Санкт-Петербург, Университетская наб., 7-9; тел.: 8-911-2654652; e-mail: rumyantsev-am@mail.ru.
Иштуганова Валерия Владимировна, студент кафедры генетики и биотехнологии ФГБОУ ВО «Санкт-Петербургский государственный университет»; 199034, г. Санкт-Петербург, Университетская наб., 7-9; тел.: 8-981-7473464; e-mail: st086860@student.spbu.ru.
Ответственный за переписку с редакцией: Веретенников Владислав Валерьевич, кандидат ветеринарных наук, ассистент кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8778769; e-mail: vlad.veretennikov.96@mail.ru.
http://vetkuban.com/num6_202408.html