УДК 619:616.98.578:636.4:575.113:616-085.37
DOI 10.33861/2071-8020-2024-6-21-23
Ахунова А. Р., Насыров Ш. М., Алеева З. З., Арутюнян Г. С. Федеральное государственное бюджетное научное учреждение
«Федеральный центр токсикологической, радиационной и биологической безопасности», Республика Татарстан, г. Казань
Галеева А. Г., Ефимова М. А. Федеральное государственное бюджетное научное учреждение «Федеральный центр токсикологической,
радиационной и биологической безопасности», Республика Татарстан, г. Казань / Федеральное государственное
бюджетное образовательное учреждение высшего образования «Казанская государственная академия ветеринарной
медицины им. Н.Э. Баумана», Республика Татарстан, г. Казань
В настоящее время международная политика искоренения классической чумы свиней (далее, КЧС) с отказом от вакцинации и масштабной выбраковкой популяций домашних свиней может преследоваться экономическими, социальными и этическими последствиями, в связи с этим разработка маркерных вакцин с сопутствующими диагностическими тестами, соответствующих стратегии DIVA (Differentiating Infected from Vaccinated Animals), становится наиболее эффективным вариантом для контроля и искоренения КЧС в эндемичных странах [1, 2, 3, 4]. Выявление антител к гликопротеину Erns является надежным диагностическим подходом для дифференциации инфицированных животных от вакцинированных (DIVA) с использованием маркированных вакцин, которые индуцируют защитный иммунный ответ на мажорный гликопротеин E2 и при этом показывают отсутствие специфических антител к гликопротеину Erns [5, 6, 7].
Гомодимер Erns имеет массу 44-48 кДа, опосредуют прикрепление и взаимодействие с клеточными рецепторами, так белок может связываться с несколькими типами клеток и ингибировать заражение вирусами КЧС и вирусной диареи крупного рогатого скота в культуре клеток [6]. Гликопротеин является как вирион-ас-социированным, так и секретируемым, поскольку он обнаруживается на поверхности инфицированных пестивирусом клеток и в культуральной среде. Erns не содержит потенциального домена, охватывающего мембрану, однако его С-концевой домен может транслоцировать полноразмерный белок через мембраны эукариотических клеток [8]. Erns обладает рибонуклеазной и вирус-нейтрализующей активностью, является одной из главных мишеней гуморального иммунного ответа, в его структуре обнаружено 5 основных линейных КЧС-специфических эпитопов [6, 8, 9].
Ранее были предприняты попытки экспрессии в E. coli как полноразмерного Erns, так и его фрагментов, что приводило к образованию сложных белковых агрегатов, низкому уровню экспрессии, низкому уровню связывания с металл-хелатными аффинными сорбентами и необходимости последующей очистки в денатурирующих условиях. При этом наблюдалась потеря нативной конформации белка и в дальнейшем - невозможность детекции такого белка серологическими методами [10]. Таким образом, получение рекомбинантного белка Erns в растворимой форме является необходимым условием для разработки чувствительных и специфичных дифференциально-диагностических тестов.
Целью настоящего исследования явилась разработка протокола получения растворимой формы фрагмента рекомбинантного гликопротеина Erns вируса КЧС и оценка его пригодности для дифференциальной диагностики КЧС.
Материалы и методы исследований. В качестве штамма-донора гена Erns вируса КЧС использовали высокопатогенный штамм «Ши-Мынь» (Genbank ID AF092448.2), принадлежащий к историческому субгенотипу 1.1. Для клонирования целевого гена использовали экспрессионный вектор pET-28a («Novagen», Германия), для экспрессии - штамм E. coli BL-21(DE3)pLysS («Novagen», Германия).
Дизайн антигенной конструкции. Анализ аминокислотной последовательности вируса КЧС осуществлялся при помощи классических методов биоинформационного анализа. Основным критерием выбора фрагмента для экспрессии служила плотность расположения B-клеточных эпитопов (по данным ресурса «The Immune Epitope Database» (IEDB, США). Поиск гомологичных аминокислотных последовательностей эпизоотически значимых штаммов и изолятов вируса КЧС осуществляли при помощи BLAST-анализа. Прогнозирование основных физико-химических свойств укороченного гена проводили c использованием ресурса «Peptide Property calculator» («Innovagen AB», Швеция), гомологическое моделирование трехмерной белковой структуры -веб-сервера «SWISS-MODEL» («SIB», Швейцария). Фрагмент гена, кодирующего белок Erns (1175-1502 п.н.), был оптимизирован по кодонам для экспрессии в E. coli без изменения аминокислотного состава и синтезирован на аутсорсе (ЗАО «Евроген»), после чего клонирован в вектор pET-28a по сайтам рестрикции XhoI и NcoI. Трансформацию клеток штамма-реципиента осуществляли методом теплового шока с дальнейшей селекцией на агаризованной среде с добавлением антибиотиков (50 мкг/мл канамицина, 34 мкг/мл хлорамфеникола, ООО «Панэко», Россия).
Экспрессия rErns. Для индукции экспрессии целевого гена клетки штамма E. coli BL-21(DE3)pLysS/pET28a-Erns культивировали в питательной среде LB, содержащей канамицин и хлорамфеникол, на термошейкере «ES-20» («Biosan», Латвия) при плюс 37°С при 180 rpm до достижения оптической плотности (ОП) 0,7. Экспрессию гена индуцировали добавлением изопропил-р^-1-ти-огалактопиранозида (ИПТГ, «Promega», США) в концентрациях 0,1-1 мМ, после чего культивировали клетки в течение 6 ч. Наличие зрелого рекомбинантного белка Erns устанавливали в аналитическом disc-электрофорезе в 15% полиакриламидном геле.
Очистка rErns. Осадки клеток E. coli, подвергнутые трехкратному криолизу, ресуспендировали в охлажденном лизирующем буфере (50 мМ трис-HCl, 200 mM NaCl, 10 мМ имидазола, 5 % глицерина, 2 мМ бета-меркаптоэтанола, 1 мМ PMSF), из расчета 1 мл буфера на 1 г биомассы, после чего разрушали клетки на приборе «FastPrep» («MP Biomedicals», США) в пробирках «Blue Lysing matrix» с керамическими, кремниевыми и стеклянными шариками в течение 3 циклов по 40 с. Супернатант дезинтегрированного лизата, содержащий растворимую фракцию белка, подвергали аффинной хроматографии на колонке с сефарозой, содержащей никель-нитрилтриуксусную кислоту (Ni-NTA) («Qiagen», США) по стандартному протоколу. После связывания и промывки колонки буфером (50 мМ трис-HCl, 100 мМ NaCl, 50 мМ имидазола, рН 6,0) rErns извлекали при помощи элюирующего буфера (50 мМ трис-HCl, 100 мМ NaCl, 300 мМ имидазола, рН 7,8). Элюированные фракции объединяли и диализовали против аналогичного буфера без добавления имидазола, после чего осаждали в центрифужном концентраторе «Sartorius Vivaspin» («Vivaspin», Германия) с номинальным отсечением по молекулярной массе 30 кДа. Очищенные образцы закладывали на хранение при минус 20°С для дальнейшего качественного анализа.
Иммуноферментный анализ. Для оценки антигенной активности полученного rErns проводили непрямой иммуноферментный анализ с сыворотками свиней, иммунизированных традиционными вакцинами, применяемыми на территории России, а также рекомбинантным гликопротеином E2, по ранее описанной методике [11].
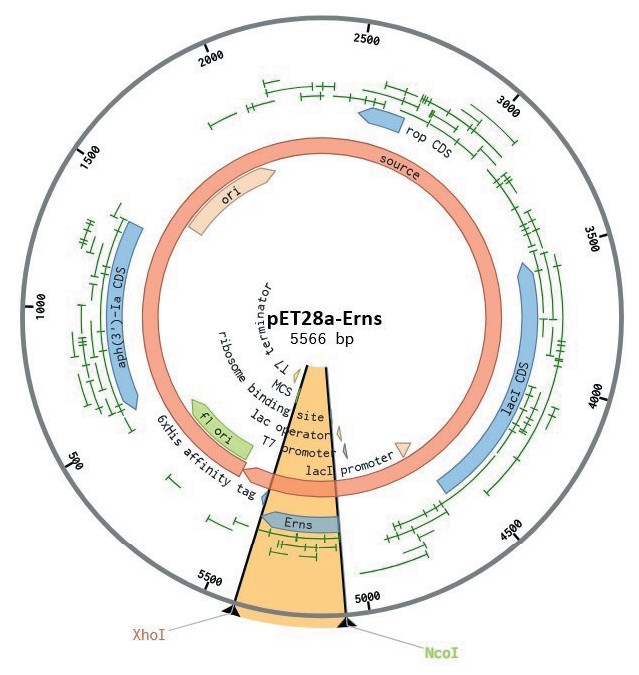
Результаты исследований и их обсуждение. На первом этапе исследования в результате биоинформационного анализа было выявлено, что наибольший интерес относительно плотности расположения иммуногенных эпитопов представляет N-концевой фрагмент гликопротеина Erns [12]. На основании этих данных был выполнен дизайн целевого полипептида с расчетной молекулярной массой 13,7 кДа и хорошей прогнозируемой растворимостью. Схема экспрессионного вектора pET28a/Erns, полученного в результате клонирования кодон-оптимизированной последовательности, представлена на рисунке 1.

Рис. 1. Схема экспрессионного вектора pET28a/Erns; целевой фрагмент фланкирован сайтами рестрикции XhoI и NcoI
Полученной рекомбинантной плазмидой трансформировали клетки E. coli BL21(DE3)pLysS, после чего была проведена тестовая экспрессия при стандартных условиях культивирования штамма-продуцента (ОП600 культуры до индукции - 0,7 ОЕ, концентрация ИПТГ - 0,5 мМ, продолжительность культивирования - 5 ч при 37°С и 180 rpm). В качестве контроля использовали лизат клеток штамма BL21(DE3)pLysS, содержащих плазмиду pET28a без вставки. При соблюдении вышеуказанных условий в клеточных лизатах штамма-продуцента регистрировалось наличие дополнительной фракции белка, по молекулярной массе соответствующей рекомбинантному гликопротеину Erns (рисунок 2). При этом в клеточных лизатах неиндуцированного штамма-продуцента признаки базальной экспрессии отсутствовали.
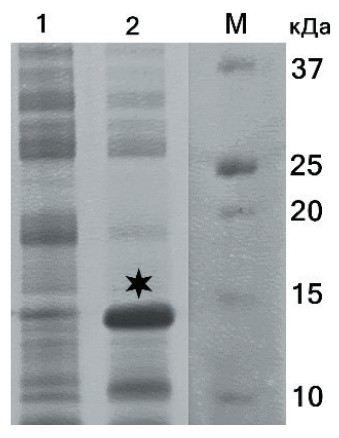
Рис. 2. Электрофореграмма клеточных лизатов в процессе экспрессии rErns (15 % ПААГ, окрашивание Кумасси): 1 - лизат клеток штамма E. coli BL21(DE3) pLysS, содержащего плазмиду pET28a без вставки; 2 - лизат клеток штамма-продуцента после индукции (целевая фракция обозначена знаком *); М - маркер молекулярных масс Bio-Rad Precision Plus Dual Xtra, 2-250 кДа («Bio-Rad», США)
После центрифугирования озвученного клеточного лизата было установлено, что более 90% целевого белка экспрессируется преимущественно в нерастворимой форме (в виде телец включения). При применении общепринятых методических подходов к повышению выхода растворимого белка (например, индукция синтеза при субоптимальных температурах [13]) доля растворимой белковой фракции не превышала 20%, а также ввиду замедления роста бактериальной культуры значительно снижался и общий выход рекомбинантного белка. Для решения этой проблемы были оптимизированы условия выделения белка из солюбилизированных телец включения. Было установлено, что при добавлении в лизирующий буфер мочевины в концентрации 6 М, увеличении времени лизиса до 2 ч и последующем озвучивании большая часть белка переходит в растворимую форму, при этом эффективно связываясь с сорбентом, предварительно уравновешенным аналогичным буфером. Связавшиеся белки также элюировали возрастающими (до 300 мМ) концентрациями имидазола, после чего проводили последовательный диализ объединенных белковых фракций против буферов с убывающими (до 0,1 М) концентрациями мочевины. При соблюдении вышеперечисленных условий общий выход растворимого белка составлял 20-22 мг на 1 л бактериальной культуры.
Следующим этапом исследования явилась оценка пригодности очищенного rErns к дифференциальной диагностике классической чумы свиней (табл. 1).
Таблица 1 Результаты исследования сывороток свиней на наличие антител к Erns в непрямом ИФА
| Наименование образца | Диапазон ОП, ОЕ | Интерпретация результата |
|---|---|---|
| Сыворотки интактных свиней (n = 3) | 0,15-0,25 | Отрицательный |
| Позитивно-негативный порог | 0,4 | <0,4 - отрицательный; |
| Сыворотки свиней, иммунизированных вакциной «КС» (ООО «Ветбио- хим») (n = 24) | 0,65-1,2 | Положительный |
| Сыворотки свиней, иммунизированных вакциной «ЛК-ВНИИВВиМ» (n = 6) | 0,7-1,1 | Положительный |
| Сыворотки свиней-реконвалесцентов после экспериментального заражения вирусом КЧС (n = 3) | 0,8-1,5 | Положительный |
| Сыворотки свиней, иммунизированных рекомбинантным гликопротеином Е2 (n = 6) | 0,19-0,35 | Отрицательный |
Из данных таблицы видно, что рекомбинантный гликопротеин Erns позволяет выявлять специфические антитела в сыворотках свиней, иммунизированных традиционными (живыми аттенуированными) вакцинами, а также в сыворотках реконвалесцентов, однако результаты исследования сывороток свиней, иммунизированных гликопротеином Е2, интерпретированы как отрицательные. Данный факт позволяет дифференцировать переболевших и иммунизированных цельновирионными вакцинами животных от животных, иммунизированных только гликопротеином Е2, являющимся основой кандидатной рекомбинантной вакцины против КЧС.
Заключение. Нами была сконструирована прокариотическая система экспрессии фрагмента гликопротеина Erns, предназначенного для соблюдения стратегии DIVA при серодиагностике КЧС. Несмотря на то, что более 80 % белка экспрессировалось в виде телец включения, описываемый оптимизированный методический подход позволил добиться выхода растворимой формы Erns в количестве 20-22 мг на 1 л бактериальной культуры. Было установлено, что очищенный Erns достоверно связывается со специфическими антителами и позволяет дифференцировать инфицированных от вакцинированных животных. Данный факт демонстрирует возможность использования предлагаемого рекомбинантного гликопротеина в качестве основы для комплектующего средства дифференциальной диагностики к маркированной генно-инженерной вакцине против классической чумы свиней.
Список литературы:
1. A Critical Review about Different Vaccines against Classical Swine Fever Virus and Their Repercussions in Endemic Regions / Coronado L., Perera C., Rios L. et al. // Vaccines. 2021. Vol. 9. No. 2. P. 154.
2. Marker vaccine strategies and candidate CSFV marker vaccines / Xiao-Nan Dong, Ying-Hua Chen // Vaccines. 2007. Vol. 25. No. 2. P. 205-230.
3. Novel marker vaccines against classical swine fever / Beer M., Reimann I., Hoffmann B. et al. // Vaccines. 2007. Vol.25. №30. P. 5665-5670. DOI: 10.1016/j. vaccine.2006.12.036.
4. Классическая чума свиней: современные перспективы вакцинопрофилак-тики / А. Р. Ахунова, А. Г. Галеева, М. А. Ефимова, Д. Н. Мингалеев // Ветеринария Кубани. 2024. № 1. С. 9-14.
5. Enzyme-linked immunosorbent assay using a virus type-specific peptide based on a subdomain of envelope protein Erns for serologic diagnosis of pestivirus infections in swine / Langedijk J. P., Middel W. G., Meloen R. H. et al. // J Clin Microbiol. 2001. No. 39. Р. 906-912.
6. Antibody responses of pigs to defined Erns fragments after infection with classical swine fever virus / Lin M., Trottier E., Pasick J. // Clin Diagn Lab Immunol. No. 12. Р. 180-186.
7. Development of a dual immunochromatographic test strip to detect E2 and Erns antibodies against classical swine fever / Huynh L., Sohn E., Park Y. et al. // Front Microbiol. 2024. No. 15. Р. 1383976.
8. Classical Swine Fever-An Updated Review / Blome S., Staubach C., Henke J. et al. // Viruses. 2017. No. 9 (4). Р. 86.
9. Safety and DIVA Capability of Novel Live Attenuated Classical Swine Fever Marker Vaccine Candidates in Pregnant Sows / Tong C., Mundt A., Meindl-Boehmer A. et al. // Viruses. 2024. No. 16 (7). Р. 1043.
10. Procaryotic expression and purification of highly soluble partial glycoprotein erns of Indian strain of classical Swine Fever virus / Ahuja A., Sen A., Yogisharadhya R. et al. // Indian J. Virol. 2012. No. 23 (3). Р. 397-401.
11. Экспрессия в E. coli маркированного рекомбинантного гликопротеина Е2 вируса классической чумы свиней / А. Г. Галеева, М. А. Ефимова, К. В. Усольцев [и др.] // Международный вестник ветеринарии. 2024. № 2. С. 49-58.
12. High-resolution epitope mapping for monoclonal antibodies to the structural protein Erns of classical swine fever virus using peptide array and random peptide phage display approaches / Lin M., McRae H., Dan H. et al. // J Gen Virol. 2010. No. 91. Р. 2928-2940.
13. Получение растворимого интерферона гамма человека в системе экспрессии Escherichia coli при снижении температуры культивирования / Е. А. Волосникова, Т. И. Есина, Д. Н. Щербаков [и др.] // Прикладная биохимия и микробиология. 2023. T. 59. № 2. С. 167-173.
Резюме. Классическая чума свиней - это высококонтагиозное заболевание свиней и диких кабанов, приводящее к значительным экономическим потерям. Согласно классификации Всемирной организации здравоохранения животных, классическая чума свиней входит в перечень карантинных болезней, подлежащих обязательной регистрации и оповещению. В настоящее время наиболее эффективным вариантом для контроля и искоренения классической чумы свиней в эндемичных странах является разработка маркированных вакцин с сопутствующими диагностическими тестами, соответствующих стратегии DIVA (Differentiating Infected from Vaccinated Animals). Выявление антител к гликопротеину Erns является надежным диагностическим подходом для реализации стратегии DIVA с использованием маркированных вакцин, которые индуцируют защитный иммунный ответ на мажорный гликопротеин E2 и не вызывают образования специфических антител к гликопротеину Erns. В ходе настоящего исследования нами была сконструирована прокариотическая система экспрессии фрагмента гликопротеина Erns. Несмотря на то, что более 80 % белка экспрессировалось в виде телец включения, описываемый оптимизированный методический подход позволил добиться выхода растворимой формы Erns в количестве 20-22 мг на 1 л бактериальной культуры. Было установлено, что очищенный Erns достоверно связывается со специфическими антителами и позволяет дифференцировать инфицированных от вакцинированных животных. Данный факт демонстрирует возможность использования предлагаемого рекомбинантного гликопротеина в качестве основы для комплектующего средства дифференциальной диагностики к маркированной генно-инженерной вакцине против классической чумы свиней.
Ключевые слова: классическая чума свиней, стратегия DIVA, маркированные вакцины, гликопротеин Erns, прокариотическая система экспрессии.
Сведения об авторах:
Насыров Шамиль Минесалихович, кандидат ветеринарных наук, ведущий научный сотрудник лаборатории вирусных антропозоонозов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, Республика Татарстан, г. Казань, Научный городок-2; e-mail: shamyl777@mail.ru.
Алеева Замиля Загитовна, младший научный сотрудник лаборатории вирусных антропозоонозов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, Республика Татарстан, г. Казань, Научный городок-2.
Арутюнян Гузалия Салиджановна, младший научный сотрудник лаборатории вирусных антропозоонозов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, Республика Татарстан, г. Казань, Научный городок-2.
Галеева Антонина Глебовна, кандидат ветеринарных наук, ведущий научный сотрудник, заведующий лабораторией вирусных антропозоонозов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», старший научный сотрудник межкафедральной лаборатории биотехнологии и иммунологии ФГБОУ ВО «Казанская государственная академия ветеринарной медицины им. Н. Э. Баумана»; 420075, Республика Татарстан, г. Казань, Научный городок-2; тел.: 8-987-2338616; e-mail: antonina-95@yandex.ru.
Ефимова Марина Анатольевна, доктор биологических наук, ведущий научный сотрудник лаборатории вирусных антропозоонозов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», профессор кафедры эпизоотологии и паразитологии ФГБОУ ВО «Казанская государственная академия ветеринарной медицины им. Н.Э. Баумана»; 420075, Республика Татарстан, г. Казань, Научный городок-2; тел.: 8-905-3770771; e-mail: marina-2004r@mail.ru.
Ответственный за переписку с редакцией: Ахунова Алсу Рузалевна, соискатель, младший научный сотрудник лаборатории вирусных антропозоонозов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, Республика Татарстан, г. Казань, Научный городок-2; тел.: 8-927-4681865, e-mail: aahunova@inbox.ru.
http://vetkuban.com/num6_202406.html