УДК 636.5.034:615.371
DOI 10.33861/2071-8020-2023-6-17-20
Тарлавин Н. В., Сидоренко К. В., Веретенников В. В., Джавадов Э. Д., Красков Д. А. Федеральное государственное
бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный
университет ветеринарной медицины», г. Санкт-Петербург
На сегодняшний день трудно представить птицефабрику родительского и промышленного яичного поголовья, которая бы не проводила вакцинацию против болезни Марека [1]. Связано это с большими экономическими потерями при вспышке данной болезни, которые складываются из-за повышения конверсии корма; снижения качества мясной и яичной продукции и появлений секундарной инфекции из-за иммунодепрессивного влияния вируса. Несмотря на это, многие бройлерные птицефабрики не проводят специфическую профилактику против болезни Марека, считая, что если клиническая картина развивается на 100-150 день жизни птицы, то за его период жизни, это никак не отразится на его здоровье и продуктивности [8]. При проведении данного исследования мы получили подтверждения тому, что при попадании вируса в организм птицы, в кратчайшие сроки происходит его репликация и начинается поражение иммунокомпетентных клеток.
Причиной возникновения болезни является двухцепочечный, покрытый оболочкой, икосаэдрический ДНК-содержащий вирус из рода Alphaherpesviridae Herpesvirus [12], семейства Herpesvirus,
размером 150-250 нм [11]. Инфекционные частицы вируса герпеса содержат более 30 различных белков, собранных в сложную структуру, включающую в себя: центральный капсид содержащий вирусный геном; белковый слой, называемый тегументом, содержащий более 15 белков; липидный бислой, в котором находится около 10 оболочечных гликопротеинов [2]. Геном болезни Марека содержит около 100 открытых рамок считывания и кодирует более 70 генов [10], большинство из которых имеют родственные эквиваленты в других альфа-герпесвирусах, однако есть гены, которые присутствуют только у вируса болезни Марека: кодирующий онкопротеин «Meq» или фосфопротеин «pp38» [9]. Штаммы болезни Марека традиционно подразделяются на 3 серотипа (3 группы/3 типа): в первую группу (Gallid alphaherpesvirus 2, Marek’s disease virus type 1) входят онкогенные (средние и высоковирулентные штаммы), а также искусственно аттенуированные штаммы [13]; во вторую группу (Gallid alphaherpesvirus 3, Marek’s disease virus type 2) входят все неонкогенные штаммы вируса; к третьей группе относится антигенно-родственный вирус герпеса индеек (Meleagrid alphaherpesvirus 1).
Цель данной работы - изучить характер экспрессии гена IRF7, возникающей в ответ на введение в организм цыплят кросса Доминант вируса болезни Марека I (Gallid alphaherpesvirus 2) и III (Meleagrid alphaherpesvirus 1) серотипов, а также влияние данных вирусов на клеточную структуру слепых отростков кишечника цыплят.
Материалы и методы исследований. Участки тонкой кишки для гистологического исследования отбирали остро заточенными глазными ножницами, подписывали, помещали в гистологические кассеты и погружали в стандартизированный фабричный за-буференный 10,0% формалин. Перед проводкой в батарее спиртов промывали образцы органов в проточной водопроводной воде в течение 1-2 часов. После этого осуществлялась проводка и заливка материала по стандартному протоколу, адаптированному к исследуемому материалу и условиям лаборатории, с использованием изопрепа и парафиновой среды HISTOMIX. Срезы толщиной 3,5 - 4,0 мкм изготавливали на микротоме, ротационном моторизованном РОТМИК-2М. Окраска гистологических срезов осуществлялась гематоксилином Майера и 1,0% спиртовым эозином. Микроскопировали гистологические препараты при помощи светооптического микроскопа Микмед-5 при 40-, 100-, 400- и 1000-кратном увеличении. Микрофотографирование проводили при помощи цифровой камеры Lomo MC-3 № XC 1272.
Анализ уровня относительной экспрессии генов иммунитета проводили методом ПЦР в реальном времени (qPCR) на базе Научно-консультационного диагностического центра по птицеводству ФГБОУ ВО СПбГУВМ. Материалом для исследования служили цыплята породы Доминант 14-дневного возраста. Содержание и вакцинация птиц проводились на базе вивариев ФГБОУ ВО СПбГУВМ. Заражение было осуществлено путем внутримышечного введения вирусов Gallid alphaherpesvirus 2 и Meleagrid alphaherpesvirus 1 в первые сутки жизни цыплят. В качестве образца 1-го серотипа вируса болезни Марека был взят вирус штамма «3004», полученный от ФГБУ «ВНИИЗЖ», а в качестве образца 3-его серотипа вируса болезни Марека был взят вирус штамма «FC-126» в вакцине «МАРЕК-3», также производства ФГБУ «ВНИИЗЖ». Образцы тканей илеоцекальных миндалин кишечника были получены на 14 сутки жизни несушек.
Общая РНК из образцов была выделена с использованием набора ExtractRNA (Евроген) в соответствии с инструкциями производителя. Ткань разрезали на мелкие кусочки (<5 мм длиной) и измельчали до тонкого порошка с помощью пестика и ступки. Ткани измельчались и гомогенизировались с добавлением раствора монофазного водного раствора фенола и гуанидин-изотиоцианата.
С использованием набора «MMLV RT kit для синтеза кДНК» (Евроген) проводили реакцию обратной транскрипции для получения кДНК с использованием матрицы РНК. Программа ампли-фикатора: подготовка в течение 3 мин при 60°С, обратная транскрипция в течение 30 мин при 37°C, инактивация в течение 2 мин при 70°С [7].
Реакцию амплификации с генными праймерами проводили с использованием набора Готовая смесь для ПЦР 5X qPCRmix-HS (Евроген) в соответствии с протоколом производителя.
Расчет относительной экспрессии был произведен при помощи метода 2 -ДДСГ В качестве референсного гена был выбран ген белка b-Actin. Список праймеров приведен в таблице 1.
Таблица 1 Список праймеров для исследования генов
| Ген | Наименование белка | Нуклеотидная последовательность праймера |
|---|---|---|
| IRF7 | Регуляторный фактор интерферона 7 | F: GAGACTGGCTATTGGGGGAG R: GACCGAAATGCTTCCAGGG |
| b- Actin | Бета-актин | F: ATTGTCCACCGCAAATGCTTC R: AAATAAAGCCATGCCAATCTCGTC |
Результаты исследований и их обсуждение. Убой и вскрытие, предусмотренные экспериментом, в том числе с целью отбора органов для гистологического исследования, показал отсутствие каких-либо патологических изменения в слизистой или серозной оболочках тонкой кишки контрольной и опытных групп, что, частично, было подтверждено, после изготовления препаратов. Таким образом, при проведении гистологических исследований каких-либо изменений, непосредственно, в архитектонике органов не было обнаружено.
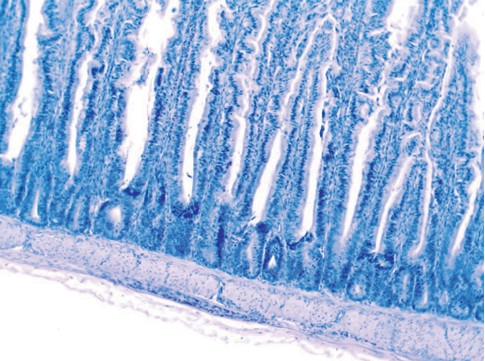
Токая кишка - трубкообразный орган, стенка которого представлена слизистой оболочкой, состоящей из эпителиальной, собственной и мышечной пластинок; подслизистой основой; мышечной и серозной оболочками [3, 5, 6], которые хорошо сохранились и чётко визуализируются в исследуемых органах (рисунок 1, 2, 3).

Рис. 1. Гистологический препарат фрагмента стенки тонкой кишки интактных цыплят (окраска гематоксилином Майера и 1,0% спиртовым эозином, увеличение *40)
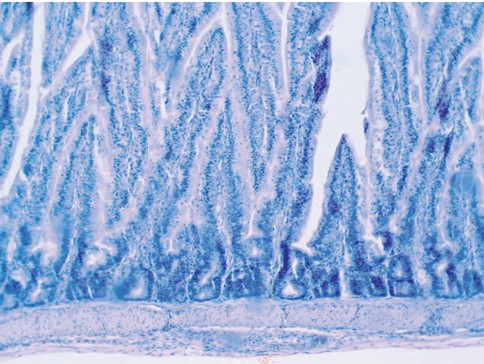
Рис. 2. Гистологический препарат фрагмента стенки тонкой кишки цыплят с введенным штаммом болезни Марека 1 серотипа (окраска гематоксилином Майера и 1,0% спиртовым эозином, увеличение *40)

Рис. 3. Гистологический препарат фрагмента стенки тонкой кишки цыплят с введенным штаммом болезни Марека 3 серотипа (окраска гематоксилином Майера и 1,0% спиртовым эозином, увеличение *40)
Однако, при рассмотрении слизистой оболочки тонкой кишки контрольной группы можно выявить нарушение целостности апикального отдела ворсинок, что сопровождается значительным числом тканевых эозинофилов в собственной пластинке слизистой оболочки (рисунок 4).
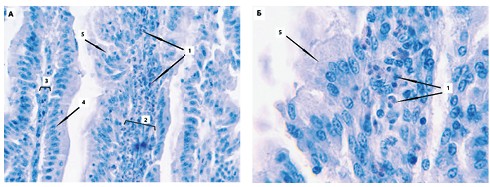
Рис. 4. Гистологический препарат тонкой кишки интактных цыплят (окраска гематоксилином Майера и 1,0% спиртовым эозином, увеличение х400 (а) и 1000 (б): 1 — эозинофилы, 2 - гипертрофированная собственная пластинка, 3 - собственная пластинка в норме, 4 - сохранившаяся эпителиальная пластинка с выраженной щёточной каймой, 5 - разрушенная эпителиальная пластинка
Следует заметить, что, как правило, повреждённые ворсинки, с отслоившейся эпителиальной пластинкой и гипертрофированной собственной пластинкой, содержат наибольшее, визуально интерпретируемое, количество эозинофилов.
Данное явление, по нашему мнению, может быть связано с проявлением каких-либо аллергических реакций неустановленного генеза.
Схожие изменения можно также увидеть в гистологических препаратах тонкой кишки цыплят, инфицированных штаммом болезни Марека I серотипа.
Так, при рассмотрении слизистой оболочки органа можно заметить, что элементы эпителиальной пластинки утрачивают видимые клеточные границы, в связи с этим становится сложно различить каёмчатые энтероциты и клетки фибробластического ряда рыхлой волокнистой соединительной ткани собственной пластинки кишечной ворсинки. Однако, количество тканевых эозинофилов, визуально, значительно меньше, чем в контрольной группе, при большей степени сохранности клеток эпителия у последней (рисунок 5).
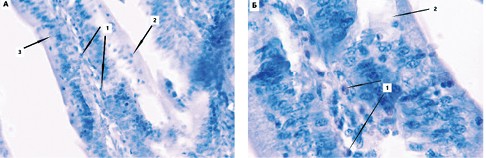
Рис. 5. Гистологический препарат тонкой кишки цыплят с введенным штаммом болезни Марека I серотипа (окраска гематоксилином Майера и 1,0% спиртовым эозином, увеличение х100 (а) и 400 (б): 1 - эозинофилы, 2 - разрушенные эпителиоциты, с размытыми клеточными границами, 3 - относительно целые эпителиоциты, с сохранившейся щёточной каймой и клеточными границами
Также важно отметить, что в ворсинках слизистой оболочки, в которых не наблюдается эозинофилия, сохраняется целостность всех пластинок, включая эпителиальную, где каёмчатые энтероци-ты без труда дифференцируются друг от друга, не утрачивают связь с собственной пластинкой слизистой оболочки, а щёточная кайма сохранена, ярко выражена и хорошо просматривается (рисунок 6)
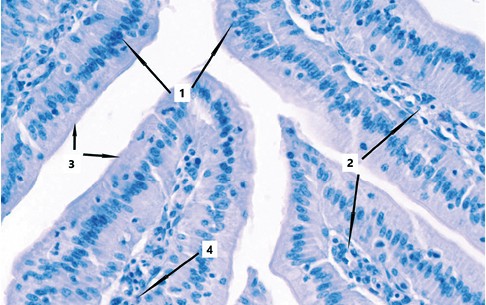
Рис. 6. Гистологический препарат тонкой кишки цыплят с введенным штаммом болезни Марека I серотипа (окраска гематоксилином Майера и 1,0% спиртовым эозином, увеличение х400: 1 - эпителиальная пластинка, 2 - собственная пластинка, 3 - щёточная кайма, 4 - одиночный эозинофил в собственной пластинке
В тонкой кишке цыплят с введенным штаммом болезни Марека III серотипа каких-либо патологий не было выявлено. Эпителиальная, собственная и мышечная пластинки слизистой оболочки полностью сохранены. Каёмчатые энтероциты имеют чёткие клеточные границы, ядра хорошо просматриваются, щёточная кайма легко дифференцируется. Собственная пластинка, представленная рыхлой волокнистой соединительной тканью, не имеет признаков гипертрофии и эозинофилии, обнаруженной в двух предыдущих группах (рисунок 7).
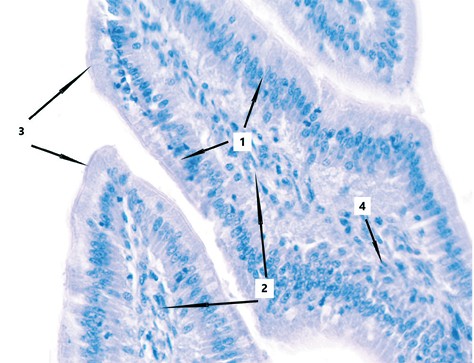
Рис. 7. Гистологический препарат тонкой кишки цыплят с введенным штаммом болезни Марека III серотипа (окраска гематоксилином Майера и 1,0% спиртовым эозином, увеличение х400: 1 - эпителиальная пластинка, 2 - собственная пластинка, 3 - щёточная кайма, 4 - одиночный эритроцит в собственной пластинке
При анализе гена IRF7 (рисунок 8) видно колоссальное превышение уровня экспрессии в обеих группах над уровнем контроля. Также, экспрессия в лимфоидных клетках илеоцекальных миндалин птиц, инфицированных 1-м серотипом вируса, в 4 раза превышает данный показатель в группе, птицам которой вводился III серотип вируса болезни Марека. Ген IRF7 кодирует регуляторный фактор интерферона 7, играющего важную роль в активации транскрипции вирус-индуцированных клеточных генов [4, 14]. Таким образом можно сделать вывод, что данные гены играют существенную роль как в противовирусном и инфекционном ответе, и тем активнее экспрессируются, чем сильнее инфекционная нагрузка на клетки организма [7].
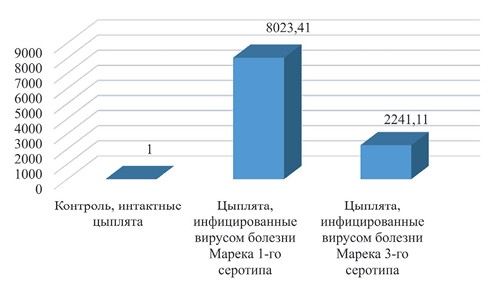
Рис. 8. Экспрессия гена IRF7 в тканях илеоцекальных миндалин цыплят породы Доминант на 14 сутки после инфицирования
Исследователи также отмечают, что вирус болезни Марека нацеливается на противодействие функционированию данного гена. Об этом сообщают Du с соавторами [12]. Ими сообщается, что уникальная короткая киназа 3 (Us3), обнаруживаемая в геноме всех трех серотипов вируса БМ важна для репликации MDV, она способна активно взаимодействовать с геном IRF7 клеток, что приводит к блокировке синтеза IFN-в, и лучшей репликации вируса болезни Марека.
Заключение. Таким образом, в группе цыплят, инфицированных серотипом I вируса болезни Марека, наблюдалось частичное разрушение апикальных отделов кишечных ворсин, с утратой целостности эпителиальной пластинки, гипертрофией собственной пластинки слизистой с заметной эозинофилией неизвестного генеза. Кишечник цыплят, инфицированных серотипом III вируса болезни Марека, демонстрирует отсутствие каких-либо признаков патологических изменений в тонкой кишке цыплят. Все элементы слизистой оболочки целостны и показывают правильную гистоархитектонику органа. При исследовании экспрессии гена IRF7 было обнаружено сильное воздействие вирусов обоих серотипов на данный ген. Был сделан вывод, что воздействие серотипа I вируса болезни Марека на активацию данного гена существенно сильнее (в 4 раза) по сравнению с эффектом на организм герпесвируса индеек (серотипа III вируса болезни Марека). Данный эффект может являться следствием точечного воздействия данного вируса на ключевой ген синтеза интерферона.
Исследование выполнено за счет гранта РНФ № 22-26-20084, https://rscf.ru/project/22-26-20084/
Список литературы:
1. Болезнь Марека - современное представление о болезни и её профилактике / Э. Д. Джавадов, В. В. Веретенников, Н. В. Тарлавин, Д. А. Красков // Эффективное животноводство. 2023. № 3 (185). С. 35-37.
2. Громов, И. Н. Патоморфологическая и дифференциальная диагностика болезней птиц, протекающих с преимущественным поражением кишечника / И. Н. Громов // Животноводство и ветеринарная медицина. 2020. № 2 (37). С. 27-31.
3. Дмитриев, Н. О. Влияние кормовой добавки на микроморфометрию и микробиом кишечника бройлеров / Н. О. Дмитриев, В. В. Салаутин, С. Е. Салаутина // Аграрный вестник Урала. 2023. № 2 (231). С. 62-70.
4. Изучение экспресии ключевых генов неспецифического иммунного ответа в организме Gallus gallus domesticus под влиянием инфицирования иммунодепрессивными вакцинными вирусами / Н. В. Тарлавин, В. В. Веретенников, Э. Д. Джавадов [и др.] // Международный вестник ветеринарии. 2022. № 4. С. 34-41.
5. Кулешов, К. А. Постнатальный морфогенез органов желудочно-кишечного тракта кур при применении селенсодержащих препаратов / К. А. Кулешов // Ветеринарная патология. 2010. № 1 (32). С. 57-66.
6. Русакова, Е. А. Оценка морфофункционального состояния тонкого отдела кишечника цыплят-бройлеров при введении фитазы в рацион / Е. А. Русакова // Известия Оренбургского государственного аграрного университета. 2017. № 6 (68). С. 138-141.
7. Тарлавин, Н. В. Иммуногенные свойства иммунокомплексной вакцины против инфекционной бурсальной болезни : дисс. на соиск. учен. степ. канд. ветерин. наук // 2022. 142 с.
8. Immune Responses in Cecal Tonsils of Marek’s Disease Virus-Infected Chickens / M. Heidari, F. Heidari, S. Huanmin et al. // Avian Diseases. 2015.
9. IRF7: role and regulation in immunity and autoimmunity / W. Ma, G. Huang, Z. Wang et al. // Front Immunol. 2023.
10. Kaiser P., Underwood G., Davison F. Differential cytokine responses following Marek’s disease virus infection of chickens differing in resistance to Marek’s disease // J Virol. 2003. No. 77 (1). Pp. 762-768.
11. Marek’s Disease Virus Modulates T Cell Proliferation via Activation of Cyclooxygenase 2-Dependent Prostaglandin E2 [N. Kamble, A. Gurung, B. Kaufer et al. // Front Immunol. 2021.
12. Marek’s disease virus serine/threonine kinase Us3 facilitates viral replication by targeting IRF7 to block IFN-P production / X. Du, D. Zhou, J. Zhou et al. // Vet Microbiol. 2022.
13. Perumbakkam S., Hunt H., Cheng H. Marek’s disease virus influences the core gut microbiome of the chicken during the early and late phases of viral replication // FEMS Microbiol Ecol. 2014.
14. Tanaka T., Narazaki M., Kishimoto T. IL-6 in inflammation, immunity, and disease // Cold Spring Harbor perspectives in biology. 2014.
Резюме. Болезнь Марека - опасная иммунодепрессивная вирусная болезнь сельскохозяйственной птицы. Каждая промышленная яичная птицефабрика в Российской Федерации проводит вакцинацию в первые сутки жизни против болезни Марека. Благодаря данной тактике вакци-нопрофилактики, птицеводческие хозяйства оберегают себя от вспышки данной болезни и экономических ущербов. При инфицировании птицы данный вирус вызывает существенное изменение экспрессии гена иммунитета IRF7. При исследовании экспрессии данного гена было обнаружено сильное воздействие вирусов обоих серотипов на данный ген, причем Gallid alphaherpesvirus 2 превышал уровень данного воздействия по сравнению с эффектом от Meleagrid alphaherpesvirus 1 в 4 раза. Влияние вируса Gallid alphaherpesvirus 2 также отмечалось при помощи гистологических исследований: наблюдалось частичное разрушение апикальных отделов кишечных ворсин, с утратой целостности эпителиальной пластинки, гипертрофией собственной пластинки слизистой с заметной эозинофилией неизвестного генеза.
Ключевые слова: птицеводство, эпизоотология, гистология, кишечник птицы, экспрессия генов, заражение, болезнь Марека, вирус, серотип.
Сведения об авторах:
Сидоренко Карина Владимировна, кандидат ветеринарных наук, ассистент кафедры биологии, экологии и гистологии ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-931-5346540; e-mail: capricorn26.12.94@yandex.ru.
Веретенников Владислав Валерьевич, кандидат ветеринарных наук, ассистент кафедры эпизоотологии им. В. П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8778769; e-mail: vlad.veretennikov.96@mail.ru.
Джавадов Эдуард Джавадович, доктор ветеринарных наук, профессор кафедры эпизоотологии им. В. П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-9666774; e-mail: vnivip1@mail.ru.
Красков Дмитрий Андреевич, аспирант кафедры эпизоотологии им. В. П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-4152266; e-mail: kraskov-00@bk.ru.
Ответственный за переписку с редакцией: Тарлавин Николай Владимирович, кандидат ветеринарных наук, ассистент кафедры эпизоотологии им. В. П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8430353; e-mail: tarlav1995@bk.ru.
http://vetkuban.com/num6_202306.html