УДК 619:616.98-076[:578.833.31
Мазлум Али, Власова Н.Н., Аронова Е.В., Иголкин А.С. ФГБУ"ВНИИЗЖ", г. Владимир
Кривонос Р.А. департамент ветеринарии Краснодарского края, г. Краснодар
Черных О.Ю. ГБУКК"Кропоткинская краевая ветеринарная лаборатория", г. Кропоткин
Введение. Метод, позволяющий определять количество инфекционных единиц вируса в различных образцах, является необходимым инструментом в вирусологии. В исследовательских лабораториях титр вируса, вызывающего цитопатический эффект в культуре клеток, обычно рассчитывают, исходя из количества пораженных единиц культуры клеток (лунки, флаконы), после внесения в них серийных разведений исходного вируссодержащего материала и выражают в тканевых цитопатических дозах - ТЦД50, если эффект наблюдается у половины инфицированных проб [13].
Использование данного метода требует продолжительного периода времени: от 3 до 10 дней в зависимости от свойств исходного вируса. С появлением новых технологий для определения титра вируса в пробе все чаще применяют метод ПЦР в реальном времени (ПЦР-РВ). По данным Van Guilder HD, Vrana KE, Freeman WM (2008) ПЦР-РВ (или количественная ПЦР) лабораторный метод, основанный на циклической амплификации определенных фрагментов генома, который используется для одновременной индикации возбудителя и измерения количества молекул ДНК. В свою очередь, после проведения соответствующих расчетов его результаты позволяют определить титр вируса в испытуемой пробе [22].
Возбудителем африканской чумы свиней (далее, АЧС) является ДНК-содержащий вирус семейства Asfarviridae, рода Asfivirus [2, 3, 8, 12]. Поскольку геном вируса АЧС представлен ДНК, в отличие от детекции геномов РНК-содержащих вирусов, для его обнаружения методом ПЦР-РВ не требуются получения кДНК, что, как минимум, на 1 час сокращает время исследований и составляет с этапом выделения ДНК 2 часа 30 минут.
Для титрования вируса АЧС используют первичные культуры клеток (культура клеток костного мозга свиней, культура лейкоцитов свиней, альвеолярных макрофагов свиней, почек свиней и селезенки свиньи), обладающие высокой чувствительностью [3, 4].
При культивировании в первичных культурах клеток свиньи вирус АЧС вызывает специфическую гемадсорбцию и оказывает цитопатогенное воздействие. Постановка реакции гемадсорбции (РГАд) является наиболее специфичным и чувствительным методом идентификации вируса АЧС, поскольку ни один из вирусов, поражающих свиней, не вызывает проявления гемадсорбции. Согласно рекомендации МЭБ, РГАд используется в качестве референтной методики выявления вируса АЧС, несмотря на трудоемкость постановки и продолжительность реакции (5-7 дней) [3, 4, 16, 20].
Исходя из вышеизложенного, при выполнении ряда лабораторных исследований и определении количества вируса в пробе в определенных случаях целесообразно заменить традиционные методы и использовать такие технологии, как ПЦР-РВ для проведения быстрого и эффективного анализа уровня накопления вируса.
Порогового значение цикла (Ct), фиксируемое в результате ПЦР-РВ, дает точные и воспроизводимые результаты с низкими стандартными отклонениями [21, 22].
Кроме того, ПЦР-РВ позволяет проводить абсолютную количественную оценку содержания нуклеиновых кислот в пробе при наличии референтной матрицы ДНК с известной концентрацией и количеством копий [24].
К другим преимуществам ПЦР-РВ относится быстрая и эффективная возможность сравнения и качественной оценки исследуемых образцов.
Так, в зарубежной литературе представлен ряд работ, в которых 4 демонстрируется определение вирулентности вируса по его содержанию в крови, отмечая, что скорость изменения С (соответственно, скорость увеличения титра в крови) у аттенуированного вируса ниже, чем у вирулентного [14, 18].
В своей работе Lacasta Anna et al. показали, что у животных, инфицированных аттенуированным штаммом вируса АЧС, наблюдалась более поздняя регистрация вирусной ДНК. Они выявляли вирус в назальных экскретах и крови только на 7-й день после инфицирования, причем, титр накопления вируса был в среднем ниже на 4-5 lg, чем у свиней, инфицированных вирулентным штаммом E75, и не превышал значений 104-5 ГАдЕ50/мл [18].
В другой работе Lewis T. et. al. показали, что делеция гена 9GL у вируса АЧС изолята Malawi Lil-20/1 (MAL) влияет на созревание ви-риона и репродукцию вируса в макрофагах и ослабляет вирусную инфекцию у свиней. Животные, инфицированные этим аттенуированным изолятом, оставались клинически здоровыми и демонстрировали увеличение значения Ot, выявляемое в ПЦР-РВ, что соответствовало снижению титра вируса в крови в 100-10 000 раз по сравнению с неделетированным изолятом Malawi Lil-20/1 [14].
Использование ПЦР-РВ в диагностике АЧС имеет еще одно преимущество перед РГАд, так как при постановке последнего невозможно выявление негемадсорбирующих вариантов вируса, как правило, у свиней с хронической или бессимптомной формой течения болезни. Следует также учитывать, что специфическая ГАд, хотя и является характерным признаком вирулентных вариантов вируса АЧС, отдельные негемадсорбирующие изоляты также могут быть высоковирулентными [15].
Таким образом, целью наших исследований являлось определение корреляции показателя Ct в ПЦР в режиме реальном времени и значений титра вируса, устанавливаемого в реакции гемадсорбции, а также расчета количества копий генома вируса АЧС в пробе.
Материалы и методы исследований. В представляемых экспериментах для титрования и накопления вируса АЧС использовали культуры клеток селезенки свиньи (СС) и костного мозга свиней (КМС), приготовленных в соответствии с методическими рекомендациями, разработанными в референтной лаборатории по АЧС ФГБУ «ВНИИЗЖ» [9, 10].
Расчет титра вируса проводили по методу Рида и Менча, или по методу Кербера в модификации Ашмарина через 7 дней после начала эксперимента [9, 10].
В качестве источника геномной ДНК и для заражения культуры клеток или титрования исходного вируса в работе использовали вирус АЧС изолят Krasnodar 07/17, выделенный в июле 2017 года из пробы селезенки павшей домашней свиньи (Краснодарский край). Накопление вируса осуществляли путем его пассирования в первичной культуре клеток СС в течение 2-3 пассажей.
Выделение вирусной ДНК из вируссодержащих образцов проводили с помощью набора «ДНК-сорб-Б» (ООО «НекстБио», Россия) в соответствии с инструкцией производителя [5].
Для детекции генома вируса АЧС использовали тест-систему «АЧС» для выявления вируса африканской чумы свиней методом полимеразной цепной реакции (ФБУН «ЦНИИ») [6], а также методику по выявлению генома вируса африканской чумы свиней методом полимеразной цепной реакции в режиме реального времени (ФГБУ «ВНИИЗЖ») [11].
Для получения и накопления ПЦР-продукта использовали: матричную ДНК вируса АЧС изолят Krasnodar 07/17 в объеме 5 мкл на реакцию, Taq-ДНК-полимеразу - 0,5 мкл, 10*буфер с (NH4)2SO4 - 2 мкл, смесь дезоксинуклеотидтрифосфатов 10 мМ - 0,5 мкл (Fermentas), праймеры, фланкирующие ген B646L (табл. 1) (по 10 пМ каждого), и 2 мкл 25мМ MgCl2. Объем деионизированной воды рассчитывали, исходя из общего объема реакционной смеси, равного 20 мкл. Режим амплификации использован согласно работе Neilan J.G. и др., 2004 [19].
Таблица 1. Праймеры, использованные для амплификации гена B646L вируса АЧС
| Название гена | Название праймера | Последовательность 5' 3' | Длина праймера | Размер фрагмента |
|---|---|---|---|---|
| B646L | Fp72/27 | TATCAGGATCCTTCGCATAAACCGCCA | 27 | 1981 |
| Rp72/27 | GGAAGCCCACAGATCTAACCCATTGTG | 27 |
Результаты амплификации гена B646L оценивали с помощью электрофореза в 1,0% агарозном геле.
Для элюции ПЦР-продукта из геля агарозы использовали «набор реагентов для элюции ДНК из агарозных гелей» (Qiagen) в соответствии с инструкцией производителя [7].
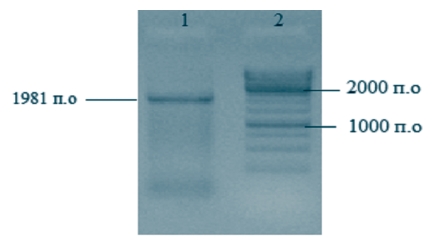
Результаты и их обсуждение. Поскольку в диагностике АЧС ПЦР-РВ используется как количественный метод (когда в реакции с использованием известной концентрации ДНК и количества копий гена по значению Ct определяется соотношение значения Ct к количеству копий), первым этапом работы являлось определение с помощью набора ФБУН «ЦНИИ» минимального количества копий генома вируса АЧС в образцах. Для этого с помощью ПЦР был амплифицирован полноразмерный ген B646L вируса АЧС. После проведения электрофореза на 1,0% агарозном геле (рисунок 1) продукт был элюирован из геля и его концентрация определена на спектрофотометре.

Рис. 1. Результаты электрофоретического разделения в 1% геле агарозы ПЦР-продукта (вирус АЧС изолят Krasnodar 07/17): трек 1 - электрофорез ПЦР-продукта полноразмерного гена B646L; трек 2 - маркер 1к (производитель ThermoFisher) с линейкой фрагментов от 10000 п.о. до 250 п.о.
Количество копий гена B646L в данном образце рассчитано по формуле для «абсолютной оценки количества копий»: количество копий гена = (концентрация ПЦР продукта (нг) х 6,022*10-23)/ (длина ПЦР продукта (п.о.)х109 х 650)
Поскольку размер амплифицированного фрагмента 1981 п.о. и его концентрация после очистки из агарозного геля составляла 25,1 нг/мкл, рассчитанное количество копий гена составляло 1,17x1с11 копий/мкл.
На втором этапе исследований приготовили 10 десятикратных разведений образца ПЦР-продукта и провели их анализ в ПЦР-РВ с трехкратной повторностью. Результаты представлены в таблице 2.
Таблица 2. Значение Ct в ПЦР-РВ при разных концентрациях амплификата гена B646L вируса АЧС (n=3)
| Разведение пробы | Концентрация ДНК амплификата гена B646L (нг/мкл) | Значение Ct | Количество копий гена в 1мкл | Результат |
|---|---|---|---|---|
| 1 | 25,1Ч10-1 | -* | 1,17Ч19 | Ложн.отр |
| 2 | 25,1Ч10-2 | -* | 1,17Ч18 | Ложн.отр |
| 3 | 25,1Ч10-3 | -* | 1,17Ч17 | Ложн.отр |
| 4 | 25,1Ч10-4 | 5.8 | 1,17Ч16 | Пол. |
| 5 | 25,1Ч10-5 | 8.2 | 1,17Ч105 | Пол. |
| 6 | 25,1Ч10-6 | 11.34 | 1,17Ч104 | Пол. |
| 7 | 25,1Ч10-7 | 15.15 | 1,17Ч103 | Пол. |
| 8 | 25,1Ч10-8 | 18.09 | 1,17Ч102 | Пол. |
| 9 | 25,1Ч10-9 | 21.11 | 1,17Ч101 | Сомн. |
| 10 | 25,1Ч10-10 | 25.00 | 1,17 | Сомн |
Полученные результаты ПЦР-РВ продемонстрировали обратно пропорциональную линейную зависимость показателя Ct от количества копий гена B646L вируса АЧС, когда снижение концентрации в 10 раз приводит к увеличению Ct на 3 цикла (рисунок 2).
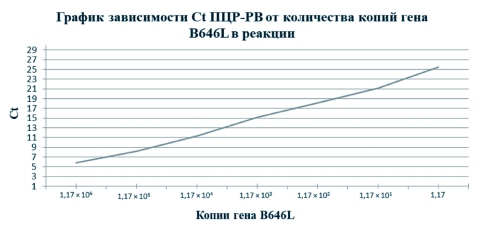
Рис. 2. Корреляция значений Ct ПЦР-РВ с количеством копий гена B646L
Таким образом, в результате экспериментов было установлено, что при высокой концентрации ДНК в образцах (>1,17x10 копий генома) реакция ПЦР-РВ может приводить к ложно отрицательному результату, поскольку чрезмерное количество исходной матрицы препятствует отжигу праймеров на амплифицированных матрицах, а когда количество копий снижается ПЦР-РВ позволяет обнаруживать геном вируса АЧС вплоть до минимального количества копий - 11,7 копии/мкл. Так как для постановки реакции используется 10 мкл матричной ДНК, чувствительность ПЦР-РВ в данных опытах составляет 117 копий.
На следующем этапе для наиболее точного определения титра вируса АЧС в пробе с помощью реакции гемадсорбции, провели сравнительный анализ чувствительности первичных культур клеток.
С этой целью параллельно заразили культуры клеток СС и КМС вирусом АЧС изолят Krasnodar 07/17 в дозе 103 ГАдЕ50 на матрас (объем 50 мл), и наблюдали за репродукцией вируса в культуре клеток. Из каждого матраса на седьмые сутки отобрали по 300 мкл культуральной жидкости, исследовали данные образцы методом ПЦР-РВ и определяли титр вируса АЧС в обеих культурах клеток в РГАд. Р результате титр вируса АЧС в культуре клеток СС составил 106 ГАдЕ50, а титр вируса АЧС в культуре клеток КМС составил 105 ГАдЕ50, то есть на 1lg ниже. Полученные данные также были подтверждены методом ПЦР-РВ, где значение Ct на седьмой день в культуре клеток СС составило 12,2, а в культуре клеток КМС 15,9.
Поскольку обе культуры клеток были использованы для заражения одной и той же дозой вируса, а репродукция вируса АЧС в культуре клеток СС показала более высокую чувствительность данной культуры к вирусу, для выполнения дальнейших этапов работы была выбрана культура клеток СС, как наиболее соответствующая целям исследований.
На следующем этапе работы устанавливали наличие корреляции значений Ct ПЦР-РВ с титром вируса в культуре клеток СС в РГАд. Для этого определили титр вируса АЧС изолята Krasnodar 07/17 в культуре клеток СС в соответствии с методическими рекомендациями, разработанными в референтной лаборатории по АЧС ФГБУ «ВНИИЗЖ» [9, 10].
В ходе исследований титр исходного вируса составил 7,0 ГАдЕ/ см3, материал которого использовали для приготовления семи десятикратных разведений. Для достоверности анализа все десятикратные разведения проб использовали для выделения ДНК вируса АЧС и постановки ПЦР-РВ с набором ФБУН «ЦНИИ» в трех повторностях. Для объективной оценки результатов реакции вычисляли среднее значение Ct, стандартное отклонение и пределы 95%-го доверительного интервала (табл. 3).
Таблица 3. Значение Ct ПЦР в реальном времени при разных разведениях вируса АЧС (n = 3)
| Титр | Разведение | Ct/ВКВ* | Среднее** | Стандартное отклонение*** | 95% доверительный интервал**** |
|---|---|---|---|---|---|
| 107 ГАдЕ 50 | исходный | 20,54 | 8,03 | ±0,12 | 7,67 – 8,39 |
| 106 ГАдЕ50 | 1 | 22,71 | 11,95 | ±0,136 | 11.54 – 12,36 |
| 105 ГАдЕ50 | 2 | 23,38 | 16,23 | ±0,542 | 14,6 – 17,86 |
| 104 ГАдЕ50 | 3 | 23,61 | 19,84 | ±0,138 | 19,43 – 20,25 |
| 103 ГАдЕ50 | 4 | 23,83 | 23,86 | ±0,565 | 22,17 – 25,56 |
| 102 ГАдЕ50 | 5 | 23,48 | 27,37 | ±0,574 | 25.65 – 29.07 |
| 10 ГАдЕ50 | 6 | 25,26 | Н.З | Н.З | Н.З |
| 0,1 ГАдЕ50 | 7 | 24,38 | Н.З | Н.З | Н.З |
Примечание: Н.З - нет значения Ct; * - внутренний контроль выделения ДНК; ** - среднее значение рассчитано по формуле:

Для определения формулы расчета титра вируса построили линию регрессии и рассчитали коэффициент корреляции между логарифмом титра вируса и логарифмом Ct с помощью программы Statistica (рисунок 3)
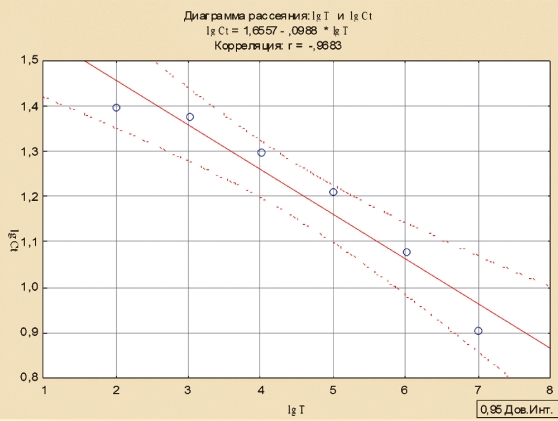
Рис. 3. График зависимости между логарифмом титра вируса АЧС и логарифмом значения Ct ПЦР-РВ
В наших исследованиях, коэффициент корреляции составил 0,9683, что свидетельствует о высокой достоверности (точности) исследований и позволяет производить вычисление титра вируса в пробе.
Таким образом, при анализе корреляции между показателями Ct ПЦР-РВ и результатами титрования проб в культуре клеток СС удалось установить близкую к линейной зависимость показателя Ct от титра вируса АЧС. Необходимо отметить, что в данном случае снижение концентрации на 1,0 lg, приводило к увеличению Ct на 4 цикла (рисунок 4).
Следующим этапом нашей работы являлось определение аналогичного соответствия показателей Ct ПЦР-РВ с титром вируса, полученного из крови инфицированного животного вирусом АЧС изолят Krasnodar 07/17, павшего на 7 сутки после заражения (титр вируса в крови составлял 7,0 lg ГАдЕ/см3). Аналогично опытам с изолятом Krasnodar 07/17 в культуре клеток СС, образцы крови также использовали для приготовления 7 десятикратных разведений для исследования методом ПЦР-РВ в 3 повторностях. Сравнение результатов экспериментов и определение соотношения значений Ct и титра вируса продемонстрировало практически полную идентичность полученных результатов (рисунок 4).
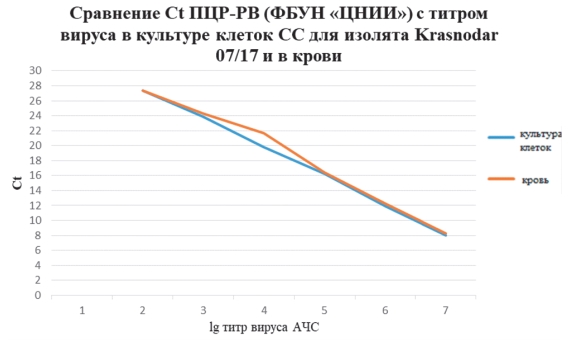
Рис. 4. Значение Ct ПЦР-РВ в соотношении с титром вируса АЧС в культуре клеток и в крови инфицированной свиньи
Результаты Ct обоих экспериментов в культуре клеток и в крови показали высокий уровень достоверности.
По результатам, представленным на рисунке 4, видно равномерное снижение значения Ct на 4 цикла при каждом последующем десятикратном разведении (то есть при увеличении титра на один логарифм). Следовательно, корреляция выражается в линейной зависимости соотношения Ct и титра вируса, подъем значения Ct каждые 4 цикла соответствовал снижению титра вируса на 1 lg.
Аналогичным образом проводили определение корреляции титра вируса и значений Ct для методики по выявлению генома вируса африканской чумы свиней методом полимеразной цепной реакции в режиме реального времени, разработанного в ФГБУ «ВНИИЗЖ» [11], которое дало аналогичные результаты (рисунок 5). Таким образом, полученные графики могут быть использованы для определения титра вируса АЧС в образцах крови и культуре клеток при исследовании методом ПЦР-РВ.
Рис. 5. Значение Ct ПЦР-РВ в соотношении с титром вируса АЧС в культуре клеток и в крови инфицированной свиньи
На основании проведенных исследований можно сделать вывод о том, что для предварительной оценки титра вируса АЧС в инфицированной культуре клеток или крови зараженного животного целесообразно использовать, как тест-систему «АЧС» для выявления вируса африканской чумы свиней методом полимеразной цепной реакции (производитель ФБУН «ЦНИИ»), так и разработанную в ФГБУ «ВНИИЗЖ». Различие в показателях Ct для проб, исследуемых по методике ФГБУ «ВНИИЗЖ», связано с отличающимися параметрами трактовки результатов.
Однако, считаем необходимым обратить внимание, что значение циклов Ct могут изменяться в зависимости от чувствительности набора, целевого детектируемого участка генома вируса АЧС, и чувствительности культуры клеток, на которой проводится определение титра вируса.
Заключение. Как правило, уровень репродукции вируса АЧС определяется титрованием в культуре клеток, поскольку чувствительность РГАд в 10 раз выше (1 ГАдЕ - 10-12 вирионов), чем чувствительность ПЦР-РВ (10 ГАдЕ или ~102вирионов, или ~117 копий), но постановка этой реакции более трудоемка и длительна (7-10 сутки) по сравнению с ПЦР-РВ (2 час 30 минут). Кроме того, несмотря на то, что титрование более чувствительный метод, в определенных случаях, точность результата зависит от чувствительности культуры клеток и квалификации исполнителя.
Выявленная корреляция между значением Ct и титром вируса в пробе позволяет в лабораторной практике использовать ПЦР-РВ для количественного определения содержания вируса в образце, а также, дает возможность детального изучения ряда биологических свойств возбудителя АЧС.
При необходимости использование ПЦР-РВ также дает возможность определить количество копий генома вируса в исследуемых образцах, с поправкой на то, что корреляция должна быть изучена и оптимизирована для определенного набора.
Список литературы:
Резюме. Статья посвящена определению корреляции показателя Ct в ПЦР в режиме реального времени и значений титра вируса, устанавливаемого в реакции гемадсорбции, а также расчету количества копий генома вируса АЧС в образцах. К другим преимуществам ПЦР-РВ относится быстрая и эффективная возможность сравнения и качественной оценки исследуемых образцов. В ряде работ, где показано определение вирулентности вируса по его содержанию в крови, отмечено, что скорость изменения Ct (соответственно, скорость увеличения титра в крови) у аттенуированного вируса ниже, чем у вирулентного. Результаты сравнительного анализа показали высокую стабильность соответствия значений определяемых значений Ct титру вируса и количеству копий генома. По результатам исследований с набором ФБУН «ЦНИИ» изменение концентрации ДНК-копий в 10 раз проводит к изменению значения Ct на 3 цикла. В то же время, снижение титра вируса на 1,0 lg ГАдЕ50/см3 приводит к увеличению показателя Ct в ПЦР в режиме реальном времени на 4 цикла. Для этого с помощью ПЦР был амплифицирован полноразмерный ген B646L вируса АЧС. Выявленная корреляция между значением Ct и титром вируса в пробе позволяет в лабораторной практике использовать ПЦР-РВ для количественного определения содержания вируса в образце, и позволяет детально изучить биологические свойства возбудителя АЧС. Проведено определение соответствия показателей Ct ПЦР-РВ с титром вируса, полученного из крови инфицированного животного вирусом АЧС изолят Krasnodar 07/17. Использование ПЦР-РВ позволяет определять количество копий генома вируса в исследуемых образцах, с поправкой на то, что корреляция должна быть изучена и оптимизирована для определенного набора.
Ключевые слова: вирус африканской чумы свиней, полимеразная цепная реакция в режиме реального времени, реакция гемадсорбции, значения Ct, культура клеток СС, культура клеток КМС, геном вируса АЧС, корреляция, количество копий, биологические свойства, количественный метод.
Сведения об авторах:
Мазлум Али, аспирант референтной лаборатории по АЧС ФГБУ «ВНИИЗЖ»; 600901, г. Владимир, мкр. Юрьевец; e-mail: ali.mazloum6@gmail.com.
Власова Наталья Никифоровна доктор биологических наук, главный научный сотрудник, референтной лаборатории по АЧС ФГБУ «ВНИИЗЖ»; ФГБУ «ВНИИЗЖ»; 600901, г. Владимир, мкр. Юрьевец; e-mail: vlasova_nn@arriah.ru.
Аронова Елена Владимировна, кандидат биологических наук, старший научный сотрудник референтной лаборатории по АЧС ФГБУ «ВНИИЗЖ»; ФГБУ «ВНИИЗЖ»; 600901, г. Владимир, мкр. Юрьевец; e-mail: aronova@arriah.ru.
Иголкин Алексей Сергеевич, кандидат ветеринарных наук, заведующий референтной лабораторией по АЧС ФГБУ «ВНИИЗЖ»; ФГБУ «ВНИИЗЖ»; 600901, г. Владимир, мкр. Юрьевец; e-mail: igolkin_as@arriah.ru.
Кривонос Роман Анатольевич, кандидат ветеринарных наук, руководитель департамента ветеринарии Краснодарского края; 350000, г. Краснодар, ул. Рашпилевская, 36; e-mail: sinkubani@mail.ru.
Ответственный за переписку с редакцией: Черных Олег Юрьевич, доктор ветеринарных наук, директор ГБУ КК «Кропоткинская краевая ветеринарная лаборатория»; 352380, Краснодарский край, г. Кропоткин, ул. Красноармейская, д. 303; тел.: 8-86138-62314; e-mail: gukkvl50@kubanvet.ru.
http://vetkuban.com/num6_201801.html