УДК619:615.373.3
Верховский О.А. АНО "Научно-исследовательский институт диагностики и
профилактики болезней человека и животных", г. Москва
Алипер Т.И. ООО "НПО НАРВАК", г. Москва
Черных О.Ю. ГБУ КК "Кропоткинская краевая ветеринарная лаборатория", г. Кропоткин
Непоклонов Е.А. Федеральная служба по ветеринарному и фитосанитарному
надзору (Россельхознадзор), г. Москва
Под иммунотерапией понимают лечение заболеваний с помощью средств целенаправленной активации иммунитета или его подавления, в том числе с помощью лечебно-профилактических иммунных сывороток или выделенных из них иммуноглобулинов (или гамма-глобулинов), обладающих специфической активностью по отношению к конкретному патогену (бактерии, вирусу или токсину). Лечебный эффект от применения этих препаратов достигается за счет запуска иммунологических механизмов защиты в системе "специфические антитела - патоген", направленных на элиминацию последнего из организма. Исходя из этого, следует разделить два понятия: "иммуноглобулины" и "антитела", которые не являются синонимами. Иммуноглобулины (существует пять классов или изотипов иммуноглобулинов: IgG, IgM, IgA, IgE, IgD, а в зависимости от вида млекопитающих есть еще и их подклассы/субизотипы) - это класс белков соответствующего суперсемейства, находящихся либо в растворимой форме, либо функционирующих в качестве рецепторов на поверхности клеток иммунной системы. Антитела - это молекулы иммуноглобулинов определенного класса/подкласса, обладающие специфической активностью по отношению к определенному антигену и обеспечивающие его нейтрализацию, цитолиз, опсонизацию. Таким образом, любая гипериммунная сыворотка или препарат иммуноглобулинов могут содержать в своем составе как неспецифические иммуноглобулины, не обладающие протективным действием, так и специфические антитела к тем возбудителям инфекций, для лечения которых они и предназначены [1, 6, 12]. Таким образом, основной целью пассивного введения специфических антител является экстренное достижение быстрого лечебного эффекта, предупреждение дальнейшего развития болезни или облегчение ее течения, ускорение процесса выздоровления. Во многих случаях, например при отравлении человека или животного ядом змей, паукообразных, токсинами различной этиологии, наличии у них острых тяжелых генерализованных форм инфекционных заболеваний, немедленное введение иммунной сыворотки или иммуноглобулина может спасти жизнь пациенту, представляя собой, таким образом, единственное эффективное средство для этой цели.
В медицинской практике кроме иммунных сывороток и специфических иммуноглобулинов в качестве лечебных препаратов используются также и моноклональные антитела (например, для лечения онкологических и аутоиммунных заболеваний), однако эта тема настолько обширна, что требует индивидуального рассмотрения. В ветеринарии, несмотря на многообещающие экспериментальные работы [11], стратегии терапии моноклональными антителами на сегодняшний день по-прежнему нет, что оставляет возможность совершенствования и разработки новых поликлональных препаратов. По мнению многих исследователей, несмотря на определенные успехи в области клинического использования моноклональных антител, иммунотерапия с помощью современных поликлональных антител остается наиболее востребованным лечебно-профилактическим подходом не только при многих уже известных болезнях, но и является многообещающей стратегией в области лечения эмерджентных и малоизученных вирусных заболеваний, борьба с которыми крайне затруднительна [14, 16, 18, 28]. На сегодняшний день, согласно имеющимся электронным базам данных, опубликовано более полутора тысяч статей, посвященных иммунотерапии поликлональными антителами в медицине, в то время как данные, посвященные эффективности этого подхода для лечения животных, включая наиболее показательных в этом отношении видов - собак и кошек, немногочисленны и достаточно разрознены [13, 19].
Целью настоящего обзора является обобщение работ ряда отечественных и зарубежных исследователей, а также собственного многолетнего опыта авторов по разработке и внедрению средств терапии антителами в ветеринарную практику, для анализа текущей ситуации и оценки перспектив данного направления в будущем.
Показания к применению иммунных сывороток и специфических иммуноглобулинов. Основой для создания терапии препаратами, содержащими антитела, послужили пионерские работы выдающихся ученых Фридриха Лёффлера (Friedrich August Johannes Loeffler), Пьера Ру (Pierre Paul Ёmile Roux), Александра Йерсена (Alexandre Ёmile Jean Yersin), посвященные изучению этиологии многих инфекционных заболеваний (бешенства, дифтерии, столбняка), включая открытие в 1888 году дифтерийного токсина. Однако, приоритет первого успешного применения пассивной иммунизации для терапии и профилактики инфекционных заболеваний принадлежит немецкому ученому Эмилю Адольфу фон Берингу (Emil Adolf von Behring), которому в 1901 году была присуждена первая Нобелевская премия по физиологии и медицине "за работу по сывороточной терапии, главным образом за её применение при лечении дифтерии, что открыло новые пути в медицинской науке и дало в руки врачей победоносное оружие против болезни и смерти". В это же время на лошадях были получены первые лечебные сыворотки: противостолбнячная, против змеиного яда, против стрептококковой инфекции, противодизентерийная и противосибиреязвенная, нашедшие широкое применение для лечения указанных болезней во многих странах мира. В 40-х годах XX века после создания Э.Коном с соавторами способа фракционирования белков плазмы крови с помощью этилового спирта при низких температурах началось широкое внедрение в медицинскую практику терапии иммуноглобулинами.
В настоящее время существует несколько типов протективных препаратов иммунных сывороток и специфических иммуноглобулинов, каждый из которых может назначаться при различных болезнях и патологических состояниях организма. В медицине большинство из них производится из плазмы или сыворотки крови человека. В том случае, когда возможности получения гомологичных иммунотерапевтических препаратов крайне ограничены, например, в случае токсинов или ряда вирусных инфекций с высокой степенью летальности, используют гетерологичные сыворотки или иммуноглобулины. Считается, что препараты, полученные на лошадях, более эффективны по сравнению с препаратами, полученными на других видах животных, и имеют более длительный период полувыведения [23, 25, 27]. Так, в клинической практике находят широкое применение противодифтерийная, противостолбнячная, противогангренозная, противоботули-ническая антитоксические сыворотки, причем их применение при лечении соответствующих инфекций является обязательным. Разрешен к применению ряд препаратов иммуноглобулинов: противокоревой, противооспенный, антирабический, антистафилококковый, противостолбнячный, против гепатита В, против клещевого энцефалита. Для коррекции гипоиммуноглобулинемии, а также в случае инфекций, к которым отсутствуют препараты специфических иммуноглобулинов, используют препараты нормального человеческого иммуноглобулина. В последние годы одну из ведущих позиций среди всех иммунобиологических лекарственных средств, зарегистрированных и разрешенных к применению у человека и прежде всего у детей, занимают внутривенные иммуноглобулины (ВВИГ). Доказано, что внутривенная иммуноглобулиновая терапия намного полезней, чем ожидалось [5, 9, 10]. ВВИГ готовятся из объединенной плазмы тысяч здоровых доноров, обеспечивая тем самым многообразие антител, способных защитить пациента от широкого спектра патогенных микроорганизмов. Создание ВВИГ позволило обеспечить высокоэффективную и безопасную терапию при многих тяжелых заболеваниях - первичные иммунодефициты, вирусные инфекции, аутоиммунные болезни, сепсис - и значительно снизить риск возникновения жизнеугрожающих осложнений в трансплантологии, онкологии. Примером ВВИГ может служить антицитомегаловирусный имммуноглобулин человека (НеоЦитотект или NeoCytotect) и иммуноглобулин человека против гепатита B (Неогепатект или Neohepatect), которые готовят из плазмы специально отобранных доноров с исходно более высоким, чем общепопуляционный, титром специфических антител. На внутривенной терапии антидигоксином (Fab-фрагменты антител барана к дигоксину) основан современный принцип борьбы с гликозидной интоксикацией [10]. Количество курсов внутривенной иммуноглобулиновой терапии зависит от тяжести заболевания, при этом считается, что эффект от внутривенной иммуноглобулиновой терапии длится не более трех недель [9].
В ветеринарии ведущая роль гуморального иммунного ответа в защите от бактерий, токсинов и вирусов установлена при бешенстве, лептоспирозе, чуме собак, парвовирусной инфекции собак и свиней, сибирской язве, роже свиней, пастереллезе и ряде других болезней. Поэтому лечебно-профилактические мероприятия с использованием препаратов антител при этих болезнях наиболее эффективны, особенно если они проведены на ранней стадии инфицирования животного. Раннее применение иммунотерапии, обуславливающее эффективность лечения, связано, прежде всего, с иммунопатогенезом острых вирусных, характеризующихся виремией, и бактериальных, сопровождающихся септицемией, инфекций. При таких инфекциях, в первые 1-4 суток после заражения, свободные вирусные частицы (вири-оны), также как и токсины, вырабатываемые бактериями, проникают и свободно циркулируют в крови. В этот период защита организма происходит с помощью неспецифических факторов иммунной системы: натуральных клеток-киллеров (NK-клетки) и интерферонов I типа. Только спустя 5-6 суток в защиту включаются специфические клеточные и гуморальные компоненты иммунного ответа: цитотоксические Т-лимфоциты и нейтрализующие антитела, максимальный уровень которых обычно приходится, соответственно, на 8-е и 14-е сутки после заражения. Таким образом, применение гипериммунной сыворотки или специфического иммуноглобулина в ранний постинфекционный период позволяет включить в иммунную защиту организма отсутствующие в этот момент IgG-антитела, основными биологическими свойствами которых является распознавание и связывание чужеродного антигена и далее - его выведение из циркуляции посредством ряда механизмов. Нейтрализация свободного вируса, бактерии или токсина, сопровождающаяся потерей их инфекционности, является главным свойством антител. Важная составляющая стратегии применения иммунотерапии - быстрая и точная постановка диагноза.
Предполагаемый механизм действия поливалентных антител. Известные в настоящее время препараты специфических иммуноглобулинов, в отличие от моноклональных антител, представляют собой гетерогенный пул антител, относящихся к различным подклассам IgG донора-продуцента. IgG в организме животных существует в форме мономера, поэтому его Y-образная молекула двухвалентна, поскольку содержит два идентичных антиген-связывающих участка на Fab-фрагментах, которые могут взаимодействовать с двумя эпито-пами одинаковых или разных молекул антигена, при этом Fc-фрагмент обеспечивает прикрепление связавшего антиген IgG к клеточной мембране клетки, несущей соответствующий Fc-рецептор. Пассивно введенные в организм IgG-антитела выполняют те же биологические функции, что и собственные IgG-антитела реципиента.
При нейтрализации токсинов in vivo IgG-антитела связывают их, предохраняя, таким образом, организм от проникновения токсина в клетки-мишени. Далее иммунный комплекс IgG-токсин устраняется из циркулирующей крови при непосредственном участии Fc-рецепторов клеток-фагоцитов, таких как макрофаги и нейтрофилы. При связывании IgG-антител с бактериями или вирусами происходит каскадный запуск иммунного ответа, который включает в себя: (1) активацию системы комплемента или взаимодействие с Fc-рецепторами эффек-торных клеток, результатом этого является лизис микроорганизма или инфицированной клетки за счет антитело-зависимой клеточной цитотоксичности (АЗКЦ); (2) предотвращение связывания рецепторов микроорганизма с поверхностью восприимчивой клетки-мишени, и (3) содействие устранению иммунных комплексов IgG-микроорганизм с помощью фагоцитов, несущих Fc-рецепторы.
Связывание антител с антигеном микроорганизма носит комплиментарный характер, то есть осуществляется за счет пространственной гомологии взаимодействующих антиген-связывающих участка Fab-фрагмента антитела и соответствующего ему эпитопа антигена. Образовавшийся иммунный комплекс подвергается активному фагоцитозу за счет связывания Fc-фрагмента Y-образной молекулы IgG с Fc-рецептором макрофагов. При связывании антител с микроорганизмом, уже заразившим клетку-мишень, образовавшийся иммунный комплекс активирует систему комплемента, результатом которой является выделение в окружающую среду C3a- и С5а-компонентов способных привлекать фагоциты к месту связывания по градиенту концентрации, усиливая, таким образом, фагоцитоз. Результатом служит лизис инфицированных клеток или опсонизация частиц микроорганизма или инфицированной клетки для фагоцитоза (комплементзависимая цитотоксичность). Вторым вариантом цитотоксичности является АЗКЦ которая осуществляется после взаимодействия иммунного комплекса с Fc-рецепторами NK- клеток, макрофагов и нейтрофилов. Кроме того, существуют многочисленные свидетельства того, что благодаря наличию нейтрализующих и опсонирующих антител в иммунотерапевтических препаратах увеличивается бактерицидная активность сыворотки крови и другие показатели неспецифического иммунитета реципиента. В ряде случаев была установлена протективная защита, обусловленная АЗКЦ, однако, она менее эффективна, чем защита нейтрализующими антителами.
В медицинской практике, несмотря на широкое применение внутривенных иммуноглобулинов, исследователи так и не пришли к единому мнению о механизмах их действия, хотя отразили многие различные механизмы влияния препарата на различные звенья иммунной системы, способность иммуноглобулинов поддерживать аутотолерантность и снижать иммуноопосредованное воспаление [9]. Большинство из них, касающиеся механизмов взаимодействия в системе "антиген - антитело", аналогичны вышеописанным.
Технология получения иммунотерапевтических препаратов для ветеринарных целей. В отличие от медицины все иммунотерапевтические ветеринарные препараты производятся на животных-продуцентах, в качестве которых в большинстве случаев используются лошади, крупный и мелкий рогатый скот. Технология производства таких препаратов достаточно хорошо описана в отечественной литературе [2, 4, 7, 8] и вкратце состоит из нескольких последовательных этапов. На первом этапе получают необходимое количество искомого антигена, обладающего высокой степенью очистки от посторонней микрофлоры и балластных белков. Исходным сырьем для приготовления антигенов обычно служат штаммы микроорганизмов, обладающие хорошо выраженными антигенными и иммуногенными свойствами в условиях максимального накопления в соответствующих лабораторных условиях (например, для вирусов - в перевиваемых культурах клеток). После получения большого объема вирусной или бактериальной суспензии, ее концентрируют и проводят физико-химическую очистку. При этом важным условием дальнейшего получения нейтрализующих антител является сохранение антигена в нативной форме, сохраняющей его иммунобиологические свойства.
Вторым этапом получения специфических сывороток является проведение гипериммунизации животных-продуцентов концентрированным антигеном. В этом качестве используют клинически здоровых животных, завезённых из стационарно благополучных по инфекционным заболеваниям регионов, с хорошими физиологическими и иммунобиологическими показателями. Гипериммунизация проводится нарастающими дозами антигена, который вводится подкожно или внутримышечно в несколько точек вблизи лимфатических узлов верхней части шеи, области спины и крупа животного. Цикл гипериммунизации во многом зависит от иммунобиологических свойств антигена и обычно составляет более двух-трех месяцев. При этом после третьей, а затем после каждой последующей иммунизации проводят пробное кровопускание для определения титра специфических антител в крови животного-продуцента. Так, максимальный уровень вирус-нейтрализу-ющих антител в сыворотке крови лошади, обеспечивающий выраженный лечебный эффект препаратов, достигается 4 - 5 иммунизациями, проведенными с трехнедельным интервалом.
На заключительном этапе получения сывороточных препаратов проводят рабочее кровопускание у животных-продуцентов, сыворотку крови получают традиционным для каждого конкретного предприятия-производителя способом, консервируют, отстаивают и стерилизуют (табл. 1).
Таблица 1. Отечественные предприятия-производители иммунотерапевтических препаратов для животных (по электронной базе данных)
| № п/п | Организация | Ассортимент выпускаемой продукции |
|---|---|---|
| 1 | Федеральное казенное предприятие "Орловская биофабрика" |
|
| 2 | Федеральное казенное предприятие "Армавирская биофабрика" |
|
| 3. | ТД "Простор" (организация- производитель ООО "Ветбиохим") |
|
| 4. | НПВиЗЦ фирма "Ветзвероцентр" |
|
| 5. | ТД "БиАгро" (ГК "Бионит") |
|
Для получения иммуноглобулина сыворотку крови иммунных животных продуцентов не консервируют, а сразу же подвергают фракционированию. Известно несколько промышленных методов очистки и фракционирования белков из сыворотки крови и плазмы человека и животных, однако наиболее эффективным остается метод Кона. Принцип метода заключается в разделении белков на фракции с помощью различных концентраций этанола при низкой температуре (от -3 до -5°С). В этих условиях одновременно происходит экстракция и осаждение компонентов, при этом белки сохраняют свои биологические свойства, то есть не происходит денатурации IgG-антител и потери их нейтрализующей активности. Выделенную фракцию гамма-глобулина растворяют в меньшем объеме растворителя по сравнению с исходным объемом сыворотки, что позволяет сконцентрировать препарат, повысив содержание мономерных IgG-антител до 70-80%, и вводить его в меньших дозах. Полученные по данной технологии препараты можно применять подкожно или внутримышечно. В медицинской практике для получения внутривенного иммуноглобулина полученный препарат подвергают дополнительной очистке для удаления Fc-фрагмента IgG. Благодаря дополнительной очистке, проводимой методами пастеризации, ультрафильтрации и колоночной хроматографии удалось минимизировать проявление комплемент-опосредован-ных и анафилактоидных реакций за счет отделения фрагментов Fc, белковых и клеточных агрегатов, образовавшихся в процессе обработки пепсином, а также бактериальных пирогенов [20, 24]. Вместе с этим существует мнение ряда исследователей о том, что отщепление Fc-фрагмента IgG наряду с уменьшением риска побочных эффектов также снижает эффективность стимуляции иммунитета реципиента к вирусу или токсину, поскольку именно этот фрагмент антител взаимодействует с антиген-презентирующими клетками, стимулируя и ускоряя, таким образом, развитие активного иммунитета [16, 22].
Контроль гипериммунных сывороток и иммуноглобулинов проводят по общепринятым методикам, включающим в себя проверку на стерильность, безвредность и специфическую активность.
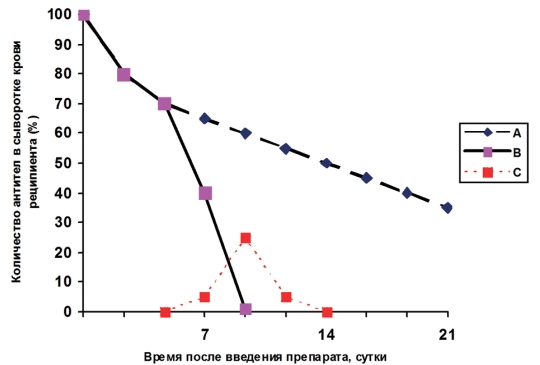
Продолжительность пассивного иммунитета и возможные осложнения после иммунотерапии. Количество инъекций гипериммунной сыворотки или специфического иммуноглобулина, также как и длительность курса иммунотерапии зависит от тяжести заболевания. После достижения положительного эффекта от лечения животное приобретает пассивный иммунитет, продолжительность которого не превышает трех недель и определяется скоростью катаболитического распада IgG. Считается что она выше у гетерологичных иммуноглобулинов (рисунок 1).

Рис. 1. Процесс катаболизма и элиминации гамма-глобулина лошади после его внутримышечного введения: (А) лошади, (В) собаке, (С) циркулирующие иммунные комплексы
Скорость катаболитического распада иммуноглобулина зависит от его принадлежности к определенному классу и подклассу, концентрации в крови, вида животного и его массы тела. По некоторым данным гетерологичный иммуноглобулин может усилить скорость распада собственного иммуноглобулина [6]. Основную роль в катаболизме иммуноглобулинов, как, впрочем, и других сывороточных белков, играет печень. В процессе элиминации иммуноглобулинов осуществляемой путем экскреции, главное значение имеют печень и почки.
Хотя иммунотерапевтические препараты обеспечивают немедленную защиту организма, существует несколько проблем, связанных с их использованием. Это, прежде всего, касается препаратов, введенных гетерологичным видам животных. Гетерологичные антитела могут быть причиной двух типов гиперчувствительных реакций. Во-первых, реакции гиперчувствительности немедленного типа (I тип), следствием которой является гиперпродукция IgE и последующий анафилактический шок. И во-вторых, реакции гиперчувствительности III типа, следствием которой является сывороточная болезнь, обусловленная формированием циркулирующих иммунных комплексов и их депонированием на стенках мелких сосудов в коже, суставах и почках - подобное может произойти в течение трех недель, в течение которых происходит удаление из организма инъецированных антител [15]. Поэтому для предупреждения подобных осложнений подобный препарат рекомендуется вводить дробно с интервалом не менее 0,5 ч, место проведения манипуляции должно быть оборудовано средствами противошоковой терапии или же у врача должна быть противошоковая аптечка. В медицинской практике наличие дополнительной очистки при производстве специфических иммуноглобулинов привело к тому, что побочные эффекты в настоящее время являются крайне редким явлением. Так, при использовании лошадиного антирабического иммуноглобулина (ERIG) анафилактический шок регистрируется менее чем в 1 случае из 45 000, сывороточная болезнь - менее чем в 0,5% случаев и другие побочные эффекты - менее чем в 5% случаев [15, 31].
Оценка потенциального эффекта от применения иммунотерапевтических препаратов. Известно, что существует положительная корреляция между уровнем антител in vitro и протективной защитой in vivo, то есть чем выше уровень нейтрализующих антител в вводимом препарате, тем выше его протективная эффективность [12]. Таким образом, потенциальный лечебный эффект гипериммунных сывороток и препаратов иммуноглобулинов оценивается в лабораторных условиях по специфической активности содержащихся в них IgG-антител в иммунологических реакциях. Если речь идет о противовирусном препарате, то в лабораторных условиях основными методами такой оценки являются реакция нейтрализации (РН) и реакция торможения гемагглютинации (РТГА). РН - реакция определения иммунологической специфичности антигенов и антител по феномену утраты их биологической активности после взаимодействия. Основана на способности антител нейтрализовать некоторые специфические функции макромолекулярных или растворимых антигенов, например активность ферментов, токсинов, бактерий, инфекционную активность вирусов. РТГА основана на феномене подавления (торможения) агглютинации эритроцитов вирусом в присутствии вирус-специфических антител. Титр специфических антител, установленный в этих реакциях, свидетельствует о высокой или низкой антигенной активности IgG-антител к соответствующему вирусу (например, у двух животных с практически одинаковой концентрацией IgG - 18 мг/мл, титр IgG-антител к вирусу чумы собак был в одном случае 1:4, а во втором - 1:128, что и будет критерием потенциального лечебного эффекта). Кроме того, существует методика определения протективной активности антител in vivo, при постановке которой восприимчивым животным вводят иммунотерапевтический препарат в рекомендованной для лечения дозе, затем проводят контрольное заражение вирулентным микроорганизмом и оценивают результат по наличию / отсутствию клинических признаков болезни, тяжести ее проявления, проценту выживших / выздоровевших животных. Проводить подобные исследования может специализированная лаборатория, обладающая коллекцией вирусов и культур клеток.
Кроме вышеперечисленных основных существуют косвенные (опосредованные) лабораторные методы оценки ветеринарных иммунопрепаратов. Так, например, на автоматическом анализаторе можно определить содержание общего белка, общее количество альбумина и глобулина. Методом электрофореза на ацетат-целлюлозных пластинах с последующей денситометрией определяют количественное содержание белковых фракций (а1-глобулины; а2-глобулины; р-глобулины; у-глобулины). Концентрацию IgG можно определить методом радиальной иммунодиффузии по Манчини и иммуноферментым анализом в "сэндвич" варианте [1]. Все вышеперечисленные подходы позволяют количественно (вес/объем) охарактеризовать концентрацию данных белков, но неинформативны в отношении специфической активности антител. Опосредованно можно предположить, что повышение содержания IgG или у-глобулиновой фракции должно приводить к увеличению концентрации специфических IgG-антител, однако это увеличение или снижение может быть обусловлено совсем другими причинами, не связанными с иммунным ответом на искомый антиген. В этом случае следует проводить сравнительные исследования животных-проду-центов с целью установления нормативных показателей у клинически здоровых и гипериммунных особей, но даже в этом случае полученная информация без определения специфической активности антител будет недостаточно информативна.
Заключение. В последнее десятилетие иммунотерапия с помощью иммунных сывороток и специфических иммуноглобулинов переживает своего рода ренессанс, обусловленный эффективностью применения этих препаратов при лечении широко распространенных и малоизученных вирусных инфекционных заболеваний, а также при использовании в качестве противоядий [14, 22, 23, 29]. В отличие от моноклональных антител, поликлональные антитела в процессе лечения связываются с несколькими эпитопами патогена, что позволяет им оставаться эффективными в случае мутаций в эпитопах [18]. В ходе клинических исследований была продемонстрирована безопасность и эффективность современных препаратов иммуноглобулинов, полученных на лошадях. Такое лечение подходит даже для беременных женщин, поскольку не происходит трансплацентарной передачи F(ab/)2-фрагмента IgG-антител, то есть препараты не обладают тератогенными свойствами [26]. По мнению специалистов, лечение поликлональными сыворотками становится многообещающей стратегией в области лечения вирусных заболеваний, для борьбы с которыми существует крайне мало средств, например, геморрагическими лихорадками Крым-Конго, Денге, Эбола и Марбург, а также заболеваниями, вызываемыми вирусом Ласса, вирусом лихорадки Западного Нила, парамиксовирусами и другими инфекциями [3, 16, 24, 28]. При этом стратегический запас поликлональных антител мог бы стать частью подготовки к эпидемии. В ветеринарии, несмотря на немногочисленность опубликованных работ, иммунотерапия также продолжает оставаться эффективным лечебным средством при ряде острых вирусных инфекций, например чума и парвовирусный энтерит собак, инфекционный ринотрахеит и панлейкопения кошек, а также ряд других инфекций. Другой перспективной стратегией иммунотерапии с использованием поликлональных антител является так называемая "IgY-технология", суть которой заключается в гипериммунизации кур и выделении специфических IgY-антител из желтка, которые могут использоваться в лечебных целях даже per os. Примером может служить питьевой йогурт, содержащий 1% IgY-антител к уреазе Helicobacter pylori, эффективно использовавшийся для лечения больных детей вместо антибиотикотерапии [21]. В настоящее время опубликовано достаточно большое количество статей в этом направлении [17, 30], однако в плане их практической реализации специалистам еще предстоит большая работа.
Список литературы:
Резюме. Под иммунотерапией понимают лечение заболеваний с помощью средств целенаправленной активации или подавления иммунитета, в том числе с помощью иммунных сывороток или выделенных из них специфических иммуноглобулинов, эффект от применения которых достигается за счет запуска иммунологических механизмов защиты в системе "специфические антитела патоген", направленных на элиминацию последнего из организма. Немедленное введение специфических антител обуславливает экстренное достижение быстрого лечебного эффекта при отравлениях человека или животного ядами, токсинами различной этиологии, наличии у них острых тяжелых генерализованных форм инфекционных заболеваний, представляя собой, таким образом, единственное эффективное средство для спасения жизни пациенту. В обзоре обобщена информация отечественных и зарубежных специалистов по применению препаратов терапии антителами в клинической практике и проведена оценка перспектив развития данного направления в будущем. В частности, рассмотрены вопросы, связанные с технологией производства гипериммунных сывороток и специфических иммуноглобулинов, предполагаемым механизмом действия антител in vivo и показаниями к применению иммунотерапии. Представлен ассортимент иммунотерапевтических препаратов для животных, выпускаемых отечественными биологическими предприятиями, и описаны основные этапы очистки и фракционирования специфических иммуноглобулинов и их фрагментов из сыворотки крови и плазмы человека и животных. Приведены данные об эффективности современных препаратов антител для лечения ряда болезней с высокой степенью летальности, вызываемых вирусами, токсигенны-ми штаммами бактерий, а также при использовании их в качестве антидотов. Продемонстрирована безопасность и эффективность современных препаратов иммуноглобулинов, полученных на лошадях, при этом наличие дополнительной очистки при их производстве привело к тому, что побочные эффекты в настоящее время являются крайне редким явлением. Изучен вопрос, касающийся оценки потенциального лечебного эффекта гипериммунных сывороток и специфических иммуноглобулинов по специфической активности содержащихся в них IgG-антител в иммунологических реакциях in vitro и протективной активности препаратов антител в условиях in vivo. Показано, что основными методами оценки специфической активности противовирусных антител в лабораторных условиях являются реакция нейтрализации и реакция торможения гемагглюти-нации, результат которых может служить критерием потенциального лечебного эффекта.
Ключевые слова: гипериммунные сыворотки, иммуноглобулины, антитела, терапия препаратами, содержащими антитела, иммунитет, иммунный ответ, лечебный эффект, инфекционные заболевания, отравления, специфическая активность, реакция нейтрализации, реакция торможения гемагглютинации.
Сведения об авторах:
Алипер Тарас Иванович, доктор биологических наук, профессор, генеральный директор ООО "НПО НАРВАК"; 123098, г. Москва, ул. Гамалеи, 16; тел.: 8(499)190-30-54; e-mail: aliper@narvac.com.
Черных Олег Юрьевич, доктор ветеринарных наук, директор ГУКК "Кропоткинская краевая ветеринарная лаборатория"; 352380, Краснодарский край, г. Кропоткин, ул. Красноармейская, д. 303; тел.: 8(86138)6-23-14; e-mail: gukkvl50@kubanvet.ru.
Непоклонов Евгений Анатольевич, доктор биологических наук, профессор, заместитель руководителя Федеральной службы по ветеринарному и фитосанитарному надзору (Россельхознадзор); 107139, г. Москва, Орликов пер., д.1/11; тел.: 8 (499) 975-16-29; e-mail: info@svfk.mcx.ru.
Ответственный за переписку с редакцией: Верховский Олег Анатольевич, доктор биологических наук, профессор, президент АНО "НИИ ДПБ"; 123098, г. Москва, ул. Гамалеи, 16; тел.: 8(499)190-75-61; e-mail: info@dpri.ru.
http://vetkuban.com/num6_201601.html