Генджиева О.Б., Моисейкина Л.Г., Киришов Э.А. ФГБОУ ВПО КалмГУ
Изначально метод генетической экспертизы основывался на исключении ложного родства, в результате чего повышалась эффективность селекции. Однако, сущность генетического контроля не сводится только к установлению достоверности происхождения.
Использование различных полиморфных систем позволяет контролировать генетическую структуру популяций, пород и стад и оценить степень их генетического сходства. Тем самым в руки селекционера дается инструмент, позволяющий оценить влияние систем разведения животных на генетическую структуру стад. Также в совокупности с анализом динамики продуктивных качеств оно служит критерием выбора селекционной стратегии.
В современных условиях этот прием приобретает еще большее значение [4].
Самым перспективным оказалось использование в качестве маркерных систем полиморфных нуклеотидных последовательностей ДНК, позволяющих тестировать генетический полиморфизм непосредственно на уровне генов, а не на уровне продуктов генов, как в случае использования метода белкового полиморфизма. ДНК-маркеры позволяют решить проблему насыщения генома маркерами и маркировать практически любые участки ДНК, в том числе некодирующиеся [3].
Основной метод при сохранении аборигенных пород - чистопородное разведение. Калмыцкая порода скота - одна из древнейших, единственная и лучшая в России отечественная порода скота мясного направления [1]. Скот калмыцкой породы формировался под влиянием суровых климатических условий при их круглогодичном пастбищном содержании. В результате жесткого отбора скот приобрел уникальные свойства и признаки, резко отличающие его от других пород. Животные без ущерба для здоровья относительно легко переносят продолжительные морозы (до минус 35 - минус 40°С и ниже) и холодные ветры, а летом жару до плюс 45°С и более и другие неблагоприятные природно-климатические условия. У скота этой породы как ни у какой другой, хорошо выражен физиологический гомеостаз, то есть способность организма сохранять внутреннюю среду при различных изменениях внешней среды. Это достигается наличием ряда приспособительных механизмов, позволяющих животным целесообразно реагировать на изменения внешней среды [1]. Обширные исследования биологических особенностей калмыцкого скота проводились еще в ХХ веке такими учеными, как П.Н.Кулешов, Е.Ф.Лискун, Н.П.Чирвинский, М.И.Придорогин. Дальнейшие исследования были продолжены М.Б.Нармаевым, Э.Н.Доротюхом, А.П.Басанговым.
Результаты исследований. Впервые была проведена работа по иммуногенетическому, цитогенетическому и молекулярному анализу скота калмыцкой породы с целью определения генетического разнообразия. Проведены исследования по сравнительному анализу генетического разнообразия калмыцкого скота с использованием молекулярной диагностики (ISSR-фингерпринтинга). Работа выполнена в лаборатории отделения генетики животных ГНИИ РАН общей генетики им. Н.И.Вавилова (г. Москва). В лаборатории генетики Всероссийского института животноводства проведены цитогенетические исследования с целью выявления хромосомных аномалий. Иммуногенетичес-кие исследования проводились в лаборатории иммуногенетики племобъединения "Калмыцкий" в 2 племзаводах и 4 племрепро-дукторах по калмыцкому скоту в Республике Калмыкия на поголовье 2500 гол по 33 антигенам.
Для выявления антигенных факторов использовали реакцию агглютинации с моноспецифическими сыворотками, полученными от собственного донорского стада и выделенными в лаборатории ОАО "Московское". Расчет частот встречаемости антигенных факторов показал неоднородность изучаемых стад (табл.1).
Таблица 1. Частота встречаемости антигенных факторов групп крови скота калмыцкой породы
| Система | Антигены | ОАО ПЗ "Сухотинский" | ФГУП ПЗ им. Чапчаева | СПК ПР "Степной" | СПК ПР "Первомайское" | ГУП ПР "Шатта" | "Агробизнес" |
|---|---|---|---|---|---|---|---|
| ЕАА | А1 | 0.362 | 0.339 | 0.033 | 0.297 | 0.170 | 0.021 |
|
| А2 | 0.091 | 0.309 | 0.420 | 0.054 | 0.050 | 0.310 |
| EAB | В2 | 0.060 | 0.132 | 0.028 | 0.142 | 0.123 | 0.010 |
|
| G2 | 0.269 | 0.265 | - | 0.284 | 0.283 | - |
|
| G3 | 0.205 | 0.254 | 0.140 | 0.189 | 0.177 | 0.047 |
|
| I1 | 0.074 | 0.049 | 0.008 | 0.014 | 0.057 | 0,015 |
|
| 01 | 0.131 | 0.067 | - | 0.074 | 0.143 | 0,026 |
|
| 02 | 0.322 | 0.249 | 0.068 | 0.122 | 0.263 | 0,140 |
|
| 04 | 0.064 | 0.099 | 0.248 | 0.034 | 0.460 | 0,456 |
|
| Y2 | 0.292 | 0.369 | 0.033 | 0.195 | 0.230 | 0,036 |
|
| B | 0.171 | 0.137 | 0.073 | 0.108 | 0.153 | 0,036 |
|
| D | 0.020 | 0.042 | - | 0.027 | 0.023 |
|
|
| E1 | 0.396 | 0.419 | 0.340 | 0.622 | 0.583 | 0,430 |
|
| E3 | 0.366 | 0.621 | 0.328 | 0.493 | 0.507 | 0,430 |
|
| J2 | 0.309 | 0.162 | 0.088 | 0.162 | 0.220 | 0,073 |
|
| 0 | 0.071 | 0.099 | - | 0.101 | 0.067 | 0,005 |
|
| Q | 0.211 | 0.334 | 0.008 | 0.169 | 0.217 | 0,010 |
|
| P2 | - | 0.125 | 0.033 | - | 0.138 | 0,016 |
|
| G | - | 0.250 | 0.040 | - | - | 0,098 |
|
| J1 | - | 0.021 | 0.008 | - | - | - |
| EAC | C1 | 0.057 | 0.133 | 0.008 | 0.115 | 0.187 | 0,005 |
|
| C2 | 0.158 | 0.182 | - | 0.128 | 0.127 | 0,036 |
|
| E | 0.050 | 0.082 | - | 0.014 | 0.013 | 0,005 |
|
| w | 0.245 | 0.289 | 0.113 | 0.243 | 0.300 | 0,073 |
|
| Х2 | 0.225 | 0.264 | 0.488 | 0.237 | 0.417 | 0,425 |
|
| L | 0.030 | 0.189 | 0.033 | 0.041 | 0.060 | 0,067 |
| EAF | F | 0.949 | 0.895 | 0.900 | 0.900 | 0.905 | 0,886 |
|
| V | 0.171 | 0.105 | 0.073 | 0.155 | 0.190 | 0,021 |
| EAJ | J | 0.151 | 0.172 | 0.133 | 0.115 | 0.130 | 0,041 |
| EAL | L | 0.077 | 0.097 | - | 0.041 | 0.033 | - |
| EAS | S1 | 0.248 | 0.272 | 0.120 | 0.324 | 0.240 | 0,093 |
|
| H | 0.121 | 0.117 | 0.200 | 0.176 | 0.130 | 0,135 |
|
| U | 0.158 | 0.092 | - | 0.169 | 0.067 | - |
В системе ЕАА антиген А1 наиболее часто встречался у животных из ФГУП ПЗ им. Чапчаева (0,399), а минимальная его частота отмечена в стаде ООО ПР "Агробизнес" (0,021). В ЕАВ система самая высокая частота антигена Е1 (0,622) отмечена в стаде СПК ПР "Первомайское", а наименьшая (0,396) в ОАО ПЗ "Сухотинский". При этом каждое из проанализированных хозяйств характеризовалось присущим только ему распределением частот встречаемости антигенов.
Полученные данные были использованы при расчете генетических расстояний между сравниваемыми стадами. Генетические дистанции рассчитывались по формуле М.Нея.
Наименьшее генетическое расстояние (0,0353) выявлено между стадами ОАО ПЗ "Сухотинский" и СПК ПР "Первомайский", а также СПК ПР "Степной" и ООО ПР "Агробизнес" - 0,2426, а также СПК ПР "Степной" и ФГУП ПЗ им. Чапчаева - 0,2206.
Таким образом, величина генетических расстояний между стадами племенных хозяйств Республики Калмыкия колеблется от 0,0353 до 0,2426, то есть поголовье скота разных предприятий обладает определенными различиями, которые дают возможность сохранять генетическое разнообразие скота калмыцкой породы. При обмене племенным материалом генетические дистанции могут быть использованы для определения целей селекции. Для сохранения разнообразия следует закупать племенной скот в хозяйствах с большей генетической дистанцией, а для накопления гомозиготности и более похожего генотипа с наименьшей.
В качестве тест-системы для изучения генетического разнообразия и дифференциации пород крупного рогатого скота нами также был использован анализ межмикросателлитного полиморфизма - ISSR-анализ или, как его еще иногда называют, - ISSR-фингерпринтинг. Этот метод относится к методам молекулярного мультилокусного анализа.
Препараты ДНК из образцов крови калмыцкой породы выделяли с помощью набора реагентов DIAtomTM DNA Prep (IsoGene, Москва). Для сравнительного анализа генетического разнообразия брали данные российских пород (бестужевская, российская черно-пестрая) и монгольского скота.
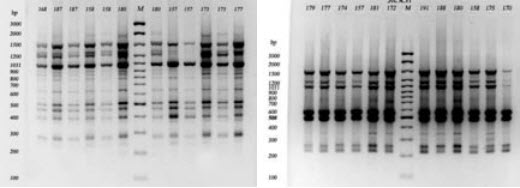
Для оценки генетического разнообразия калмыцкого скота применялся метод ISSR-анализа с использованием праймеров (GA)9C (GA-ISSR-маркер), и (AG)9C (AG-ISSR-маркер). Спектры ампликонов, полученных с разными праймерами, резко отличались друг от друга (рис.1). Использование праймера (AG)9C позволяло получать более широкий спектр ампли-конов по сравнению с праймером (GA)9C.

Рис. 1 Спектр ампликонов, полученный методом ISSR-PCR при использовании праймеров (AG)9C (а) и (GA)9C (б) у животных калмыцкой породы крупного рогатого скота в 1,5%-ном агарозном геле: 1-6,8-13 - продукты амплификации; 7 - маркер молекулярных масс (GeneRulerTM 100 bp DNA Ladder Plus).
Спектры ампликонов у разных пород, полученных с использованием одного и того же праймера, во многом имели сходный характер, что позволило провести сравнительный анализ разнообразия спектра полученных ампликонов и частот встречаемости отдельных фрагментов (локусов). При использовании (GA)9C и (AG)9C всего было тестировано 24 фрагмента (от 210 до 2430 п.н.) и 31 фрагмент (от 190 до 2450 п.н.), соответственно.
Сравниваемые породы различаются как по наличию/отсутствию отдельных фрагментов, так и по их частотам. По локу-сам, тестируемым AG-IББR-маркером, уровень гетерозиготности существенно выше, чем по GA-ISSR-маркеру (табл. 2). Значения коэффициентов группового сходства (среднее попарное сходство) по этому маркеру также существенно ниже, чем аналогичные коэффициенты по маркеру GA-ISSR.
Таблица 2. Характеристика исследованных пород крупного рогатого скота по GA-ISSR- и AG-ISSR-маркерам
| Породы | (AG)9C | (gA)9C |
|---|---|---|
| N СЧФ ДПФ СПС НБ | N СЧФ ДПФ СПС НБ | |
| Чёрно-пестрая | 43 12.05±0.39 0.58 0.82 0.25 | 42 8.29±0.30 0.66 0.84 0.24 |
| Бестужевская | 57 14.70±0.38 0.66 0.85 0.24 | 62 5.79±0.13 0.59 0.88 0.16 |
| Калмыцкая | 89 14.12±0.34 0.82 0.82 0.28 | 88 8.61±0.18 0.45 0.87 0.19 |
| Монгольская | 30 13.27±0.44 0.90 0.71 0.27 | 31 8.23±0.11 0.46 0.95 0.10 |
| Яки | 33 11.24±0.62 0.88 0.73 0.39 | 35 7.17±0.31 0.32 0.78 0.21 |
Примечания: N - размер выборки, СЧФ - среднее число фрагментов; ДПФ - доля полиморфных фрагментов, СПС - среднее попарное сходство, НБ - гетерозиготность по Stephens.
Для калмыцкого скота характерно высокое содержание полиморфных фрагментов, выявляемых с помощью (AG)9C-праймера, сопоставимое с таковым у монгольского скота и популяции яков, а также - более высокий уровень геторози-готности по сравнению с другими породами крупного рогатого скота, тестируемых с помощью AG-ISSR. При анализе данных, полученных на основе GA-ISSR-полиморфизма, картина несколько иная - доля полиморфных фрагментов у калмыцкого и родственного ему монгольского скота ниже, чем у двух других исследованных пород крупного рогатого скота. Следует отметить, что хотя по многим параметрам калмыцкий и монгольский скот мало отличаются друг от друга, тем не менее, уровень генетического разнообразия калмыцкого скота выше, чем у исследованной популяции монгольского скота. Об этом свидетельствует большее число тестируемых на особь фрагментов и более высокий уровень гетерозиготности по обоим типам маркеров.
Следует отметить, что метод ISSR-фингер-принтинга отличается высокой информативностью - в целом при исследовании пород и популяций крупного рогатого скота и родственных видов нами были выявлены 55 полиморфных локусов, что позволяет адекватно оценить уровень генетического разнообразия не только на уровне пород, но и на уровне отдельных стад и линий.
В приказе N° 402 МСХ РФ "О племенном животноводстве" регламентируется генетическая экспертиза, которая включает и цитогенетическую характеристику [2]. Это продиктовано тем, что племенные животные должны быть освобождены от генетического груза наследственных болезней.
В связи с этим нами были исследованы кариотипы бычков и телок калмыцкой породы в ОАО им. Чапчаева. Цитогенетические исследования проводили на потомках достоверно происходивших от иммуногенетически обследованных родителей. Материалом для цитоге-нетического анализа служили лимфоциты периферической крови, полученные стерильно из яремной вены. Консервантом служил гепарин в дозе 50 и.е. на мл. В качестве митогена использовали коноковалин А (КоА производства фирмы ПанЭко, Москва). Исследование хромосом проводили по общепринятой методике с рядом внесенных модификаций. При оценке использовали рутинную окраску по Романовскому-Гимза. Для уточнения кариотипического паспорта животного применяли дифференциальную окраску, что позволило идентифицировать все хромосомы набора.
Нами установлено, что у всех обследованных животных модальное число хромосом соответствовало видовой норме и равнялось 60; генетический пол, определенный по составу половых хромосом, соответствовал фенотипическому полу.
Числовых и структурных аномалий наследственных хромосомного набора, в частности конституциональных аномалий типа Робертсоновских транслокаций, ни у одного животного выявлено не было.
Анализ частоты структурных нарушений хромосом в клетках белой крови у обследованных животных находился в пределах физиологической нормы (табл.3).
Таблица 3. Уровень соматической анеуплоидии у молодняка калмыцкой породы в среднем по обследованной группе
| Кличка и N° быка | Исследовано | Анеуплоидия, % | |||
|---|---|---|---|---|---|
| голов | клеток | Гипо- | Гипер- | Всего | |
| Аксай 9675 | 9 | 450 | 9,1±0,14 | 0,4±0,07 | 9,5±0,16 |
| Очкарик 91735 | 6 | 300 | 7,0±0,15 | 1,0±0,06 | 8,0±0,16 |
| Граф 91634 | 8 | 400 | 11,0±0,17 | 0,3±0,03 | 11,3±0,17 |
| Момент 13827 | 8 | 400 | 8,5±0,15 | 0,8±0,04 | 9,3±0,15 |
| Сюрприз 12583 | 6 | 300 | 7,0±0,15 | 1,0±0,06 | 8,0±0,16 |
| Мадрит 23055 | 7 | 350 | 7,0±0,13 | 2,0±0,07 | 9,0±0,15 |
| Царь 23050 | 6 | 300 | 8,0±0,16 | 2,0±0,08 | 10,0±0,18 |
| Акробат 23734 | 6 | 300 | 7,0±0,15 | 2,0±0,08 | 9,0±0,17 |
| Всего | 56 | 2800 | 8,2±0,04 | 1,4±0,02 | 9,6±0,06 |
Количественные нарушения хромосомного набора в клетках представлены, главным образом, анеуплоидией, в среднем 9,6% клеток. Если рассмотреть структуру обследованной группы животных по частоте возникновения анеуплоидных клеток, заметна концентрация животных около среднего значения по породе. Животных с резкими отклонениями по этому показателю выявлено не было.
При анализе состава спонтанной анеуплоидии в соматических клетках не было выявлено какой-либо общей тенденции, характеризующей роль отдельных механизмов в формировании анеуплоидии. Это говорит о том, что формирование анеуплои-дии у исследованной популяции происходит преимущественно в равной степени, как за счет утери, так и за счет нерасхождения хромосом в процессе митоза. Совокупность этих нарушений, вероятно, отражает степень генетической детерминированности спонтанных нарушений кариотипа в организме животного, возникающих в соматических тканях на разных стадиях клеточного цикла, а высокая частота их встречаемости может оказывать влияние на продуктивные качества животных.
Причем, у бычков по сравнению с телками отмечалась тенденция к небольшому увеличению гиперплоидии. Гипоплоидия же и уровень анеуплоидии были у них несколько ниже, чем у телок. При этом были обнаружены достоверные различия по уровню анеуплоидии у потомков различных быков-производителей, которые наблюдались как у бычков, так и телок. Например, среди телок максимальный уровень анеуплоидии отмечен в группе потомков Графа 91634, а минимальный у потомков Сюрприза 12583 (Р< 0,01). У бычков максимальный уровень анеуплоидии снова отмечен в группе потомков Графа 91634, а минимальный - Очкарика 91735 (Р< 0,001). Достоверные различия по уровню анеуплоидии отмечены и между другими родственными группами, как бычков, так и телок.
Можно было бы предположить, что это указывает на генетическую детерминированность данного признака, но в этом случае следовало ожидать наличия связи между уровнем анеуп-лоидии у телок и бычков, происходящих из одних и тех же родственных групп. Однако, этого не было обнаружено. Корреляция между общим уровнем анеуплоидии у бычков и телок составила всего 0,34 (Р>0,05). Аналогичная картина отмечена и для корреляции между родственными самцами и самками по уровню гиперплоидии (r=0,21; Р>0,05), который некоторые авторы считают более точным, чем общая анеуплоидия, критерием для оценки изменчивости генома животных.
Результаты нашего исследования показывают, что калмыцкая порода скота свободна от Робертсоновских транслокаций, а частота спонтанных нарушений не вызывает беспокойства по поводу нестабильности хромосомного аппарата, что указывает на замечательные приспособительные качества, закрепленные на протяжении многих лет разведения.
Таким образом, генетическая экспертиза калмыцкого скота показала, что имеется широкий спектр изменчивости по полиморфизму групп крови и ДНК и вместе с тем стабильность хромосомного аппарата животных.
Список литературы
Реферат
В статье представлены материалы экспертизы генетических особенностей калмыцкого скота. Генетическая экспертиза показала, что у калмыцкого скота имеется широкий спектр полиморфизма по группам крови и ДНК, при этом сохраняется стабильный хромосомный аппарат.
Ключевые слова: группа крови, калмыцкий скот, молекулярный анализ, цитогенетический анализ, ДНК. Сведения об авторах
Моисейкина Людмила Гучаевна, доктор биологических наук, профессор кафедры зоотехнии Калмыцкого государственного университета.
Киришов Эрдни Анатольевич, аспирант кафедры зоотехнии КалмГУ.
Ответственный за переписку с редакцией: Генджиева Ольга Бекя-евна, кандидат ветеринарных наук, доцент кафедры зоотехнии аграрного факультета КалмГУ; 358000, Элиста, ул. Пушкина, 11; 8(927)6458774; gend_ olga@mail.ru.
UDC 636.2.06
GENETIC EXAMINATION OF LARGE HORNED CATTLE OF KALMYK BREED
Gendzhieva O.B., Moiseykina L.G., Kirishov E.A.
Summary
Kalmyk breed of cattle is one of the most ancient, unique and the best beef domestic breed of cattle of a meat direction in Russia. For the first time research work in the immunogenetic, cytogenetic and molecular analysis of Kalmyk breed for the purpose of definition of a genetic variety has been spent. Researches in the comparative analysis of a genetic variety of Kalmyk cattle with the use of molecular diagnostics (ISSR-fingerprinting) are conducted. The Kalmyk cattle is characterized by the high maintenance of the polymorphic fragments revealed with the help of (AG)9C-primer, is comparable to that of the Mongolian cattle and population of yaks, and also - higher level heterozygote in comparison with the other breeds of cattle, tested by means of AG-ISSR. Results of our research show that the Kalmyk breed of cattle is free from Robertsonian translocations, and frequency of spontaneous infringements doesn't cause anxiety concerning instability of the chromosomal device that specifies in the remarkable adaptive qualities fixed for many years of breeding.
Key words: blood type, Kalmyk cattle, molecular analysis, cytogenetic analysis, DNA.
References
Author affiliation
Moiseykina Lyudmila G., D.Sc. in Biology, professor of the department of zootechnology of the Kalmyk state university.
Kirishov Erdni A., post-graduate student of the department of zootechnology of the Kalmyk state university.
Responsible for correspondence with the editorial board:
Gendzhieva Olga B., Ph.D. in Veterinary Medicine, docent of the department of zootechnology of the agrarian faculty of the Kalmyk state university; 11, Pushkina st., Elista, 358000; phone: 8(927)6458774; gend_olga@mail.ru.
http://vetkuban.com/num6_201110.html