Тищенко А. С, Терехов В.И. ФЮУ ВПО "Кубанский
государственный аграрный университет"
В настоящее время в хозяйствах различных форм собственности заболеваемость и падеж молодняка регистрируется преимущественно от болезней, сопровождающихся поражением желудочно-кишечного тракта и особенно, от колибактериоза [1 10] Возбудителем данной болезни являются токсигенные варианты Escherichia coli [3. 8]
Использование инактивированныхтоксинов Е coli в качестве антигенного материала для создания вакцин является перспективным направлением в ветеринарной вакцинологии. Однако реализация полноценной защиты макроорганизма от болезнетворных микроорганизмов или факторов их патогенное невозможна без участия в этом процессе фагоцитарной системы иммунитета, яркими представителями которой являются нейтрофильные гранулоциты (НГ) Именно эти клетки первыми атакуют антигенный материал и активируют через образование медиаторов воспаления (прежде всегоTN F-аи IL-12) системулимфоцитарного иммунитета. Однако важным является не только то обстоятельство, что при антигенном раздражении может происходить количественное увеличение нейтрофильных гранулоцитов в пуле клеток белой крови. Еще более значимым является функциональное состояние фагоцитов - их поглотительная и переваривающая активность [2].
Между тем. исследованиями Караева Я.М [5] было установлено, что эшерихиозный анатоксин (ЭА) в течение первых 24 ч обеспечивает стимулирование фагоцитарного звена иммунитета, но эта стимуляция непродолжительна и по прошествии 24 ч происходит ее снижение, а через 72 ч прекращение, что не способствует обеспечению высокой напряженности поствакцинального иммунитета. Учитывая данное обстоятельство необходимо искать пути повышения иммуногенной активности (ЭА). Известно, что иммуногенность различных антигенов можно усилить с помощью адъювантов [7].
Целью работы являлось изучение влияния адъювантов на свойства, изменяющие функциональную активность нейтрофильных гранулоцитов у иммунизированных животных.
Материалы и методы исследований
В качестве адъювантов использовали пирогенал (липополиса-харид (ЛПС) грамотрицательных бактерий), гидроокись алюминия (ГОА). полиакриловую кислоту (ПАК) и масляный адъювант (МА).
Изучение влияния ЭА с адъювантами на фагоцитарное звено иммунитета осуществляли на белых крысах массой 180±10 г. Для этого было сформировано 6 групп по 10 животных в каждой: 1 группа - интактные животные (отрицательный контроль). 2 группа - животным внутримышечно инъецировали 0.15 мл ЭА (положительный контроль). 3 группа - животным инъецировали 0.15 мл ЭА с ЛПС, который ввели в анатоксин так чтобы его доза составляла 100 мг/мл: 4 группа - животным инъецировали 0.15 мл ЭА с добавлением 20% ГОА. 5 группа - животным инъецировали 0.15 мл ЭА с добавлением 3% ПАК. 6 группа - животным инъецировали 0.15 мл ЭА с добавлением 50% МА. Отбор крови проводили через 24. 48. 72 и 120 часов.
Доза ЭА была подобрана экспериментально с учетом иммун-ногенных свойств и переносимостью животными.
Фагоцитарное звено иммунитета оценивали по показателям фагоцитарной активности нейтрофилов (ФА), фагоцитарному числу (ФЧ). Оценку завершенности фагоцитарной реакции и процесса переваривания оценивали по проценту переваривания (% перевар.). Состояние мобилизационной способности и микробицидной активности нейтрофильных гранулоцитов определяли, используя НСТ-тест [6]. В качестве объекта фагоцитоза использовали S. aureus 209Р.
Результаты исследований
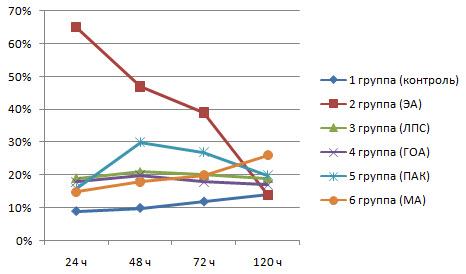
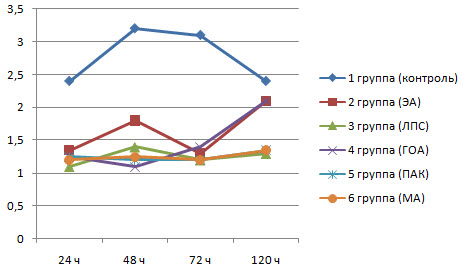
Данные опыта показали, что ЭА существенно стимулирует функциональную активность НГ (рис.1). Так. спустя 24 ч после его введения ФА нейтрофилов у животных из 2-й группы составляла 65.0%. в то время как у интактных животных она была только 8.8%. Активизация НГ произошла и у животных из 3-6 групп, которым ЭА вводили вместе с адъювантами. В этих группах показатель ФА был меньшим, чем у животных из 2-й группы, но все же увеличился в 2 раза по сравнению с интактными животными.
Рис 1. Динамика изменения фагоцитарной активности нейтрофилов у крыс опытных и контрольной групп

Через 48 ч установили снижение ФА НГ у животных из 2-й группы, а у животных 3-6 групп, напротив, наблюдали увеличение данного показателя. Наиболее выраженным данное увеличение было у крыс из 5-й группы.
Спустя 72 ч после инъекции, количество активных нейтрофилов у животных из 2-6 групп, уменьшилось по сравнению с предыдущими исследованиями, но все же оставалось достоверно большим, чем у интактных крыс.
Спустя 120 ч у животных из групп 2-5 количество активных нейтрофилов еще уменьшилось. При этом, у крыс из 2-й группы показатель ФА нейтрофилов к этому времени практически сравнялся с таковым у интактных животных, а у крыс из 3-5 групп он оставался выше, чем у животных из 1 и 2 групп. У животных из 6-й группы, которым вводился ЭА с масляным адъювантом. количество фагоцитирующих нейтрофилов. напротив, даже увеличилось до 25.6±1.9%. что может свидетельствовать о депонирующем действии масляного адъюванта.
У животных, которым вводили ЭА. увеличилось не только количество активных нейтрофилов. но и их захватывающая способность. Так. количество бактерий, захваченных одним нейтрофилом (рис. 2). через 24 ч после иммунизации у крыс из 2 группы было в 4.75 раза больше, чем у интактных животных.
Рис 2. Динамика изменения фагоцитарного числа (количество микробных клеток) нейтрофилов у крыс опытных и контрольной групп
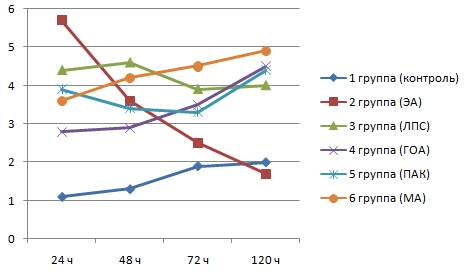
У тех крыс, которым ЭА вводили вместе с различными адъювантами. показатель ФЧ был в 2.3-3.7 раза выше, чем у животных из контрольной группы.
Через 48 ч у животных из 2-й группы установили снижение ФЧ нейтрофилов с 5 7±0.51 до 3.6±0.32 В группе N°5 также произошло незначительное снижение с 3.9±0.20 до 3.5±0.65 данного показателя. У животных из остальных опытных групп наблюдали увеличение показателя ФЧ. которое было достоверно большим, чем в 1-й группе.
Спустя 72 ч после инъекции количество захваченных фагоцитами бактерий у крыс групп N° 2-6 находилось в диапазоне от 2 5±0.22 до 4.45±1.17. и было достоверно выше, чем в 1-й группе (1 9±0 09) Между тем у животных из 2-й группы этот показатель уменьшился до 2 5±0 22 в то время как у крыс из 3-6 групп он находился в пределах от 3.51±0.18 (5 группа) до 4.45±117 (6 группа)
Спустя 120 ч у животных которым ввели ЭА вместе с адъювантами наблюдали увеличение количества захваченных одним нейтрофилом микробных клеток, что свидетельствует о явном влиянии адъювантов на захватывающую способность НГ Во 2-й группе, напротив данный показатель снизился до 1 6±0 16 и был ниже, даже чем в 1-й группе (19±0 05).
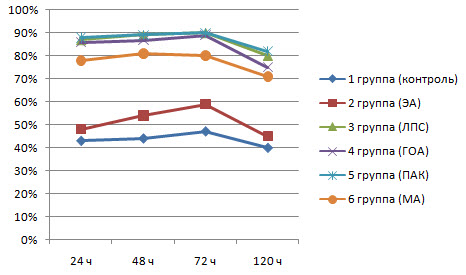
Переваривающая способность НГ (рис 3) у животных из 2-й группы была выше, чем у интактных животных, а у животных, которым ЭА ввели вместе с адъювантами. переваривающая активность НГ на протяжении всего времени исследования была значительно выше, чем у животных из 2-й группы Наиболее высоким процент переваривания поглощенных нейтрофилами стафилококков был у крыс из 3. 4 и 5 групп, которым ЭА вводили вместе с ЛПС. ГОА и ПАК.
Рис З. Динамика изменения переваривающей способности (%) нейтрофилов у крыс опытных и контрольной групп
Следует отметить что через 24 ч под действием как чистого ЭА. так и ЭА введенного с адъювантами у НГ в 10-20 раз активизировалась кислородзависимая микробицидная система (рис. 4).
Рис 4. Изменение СЦИсп под воздействием на организм анатоксина в сочетании с адъювантами
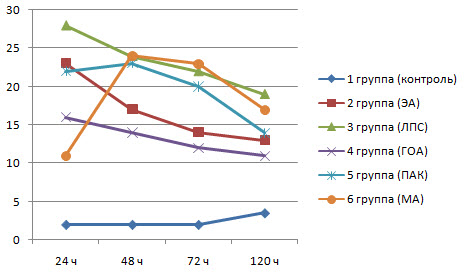
Через 48 ч во 2-й. 3-й и 4-й группах произошло незначительное снижение среднего цитохимического индекса, но всё же его значение было достоверно большим, чем у интактных животных. В 5-й и особенно в 6-й группах, напротив, произошло увеличение данного показателя.
Через 72 и 120 часов средний цитохимический индекс НГ был так же более высоким чему животных из контрольной группы, что свидетельствует о значительной интенсивности метаболических процессов связанных с деградацией захваченного антигенного материала
Ярко выраженная активизация кислородзависимой микро-бицидной системы не привела к истощению фагоцитов, поскольку у них сохранилась мобилизационная способность (рис.5), о чем свидетельствует коэффициент мобилизации, (во всех опытных группах больше единицы)
Puc 5. Изменение КМ под воздействием на организм анатоксина в сочетании с адъювантами
Следует отметить, что у крыс, которым ввели чистый ЭА практически все показатели фагоцитоза по истечении 120 часов сравнялись с таковыми у животных из контрольной группы, а это значит что антигенное действие ЭА на НГ к этому времени закончилось. У животных, которым ЭА вводили вместе с ЛПС ГОА. ПАК и МА. по-прежнему функциональная (особенно переваривающая) активность оставалась высокой.
Заключение
Таким образом результаты проведенного опыта показали что ЭА оказывает выраженное стимулирующее влияние на функциональную активность НГ однако это действие продолжается в течении первых 48 ч после чего оно снижается и через 120 ч практически прекращается. В тоже время стимулирующее влияние ЭА с адъювантами на поглотительную и микробицидную активность НГ продолжается на протяжении 120 ч Повышение ФА НГ под действием ЭА не сопровождается снижением их мобилизационных способностей, т.е. клетки могут адекватно и полноценно реагировать на дополнительное антигенное раздражение.
Следовательно полученные данные свидетельствуют о том. что ЭА введенный вместе с адъювантами в большей степени, чем сам ЭА. повышает функциональную активность НГ и поддерживает её на достаточно высоком уровне в течении 120 часов после введения растворимого антигена.
Наиболее выраженные адъювантные свойства при использовании с ЭА были отмечены у пирогенала. полиакриловой кислоты и масляного адъюванта.
Список литературы
Реферат
Исследования показали что эшерихиозный анатоксин оказывает выраженное стимулирующее влияние на функциональную активность нейтрофилов. однако это действие непродолжительно и спустя 120 ч прекращается Эшерихиозный анатоксин с адъювантами не только повышает функциональную активность нейтрофильных гранулоцитов но и поддерживает её на достаточно высоком уровне в течении 120 ч В качестве адъювантов для эшерихиозного анатоксина лучше себя показали пирогенал. полиакриловая кислота и масляный адъювант.
Ключевые слова: Эшерихиозный анатоксин лабораторные животные, нейтрофильные гранулоциты фагоцитарная активность адъюванты. липополисахарид. полиакриловая кислота, гидроокись алюминия
Summary
Researches have shown, that the anatoxin of E. coli makes the expressed stimulating impact on the functional activity of neutrophils however this action is shortly and it is stopped after 120 h. The anatoxin of E. coli with adjuvants not only raises the functional activity neutrophilic granulocytes, but also sustains it on high level in a 120 h. A pyrogenalum. polyacrylic acid and an oil adjuvant have shown itself as the best adjuvants for anatoxin of E. coli.
Keywords: Anatoxin of E. coli. laboratory animals, neutrophilic granulocytes phagocytic activity adjuvants a lipopolysaccharide. polyacrylic acid aluminium hydroxide
Сведения об авторах
Ответственный за переписку с редакцией: Тищенко Александр Сергеевич, аспирант кафедры микробиологии, эпизоотологии и вирусологии факультета ветеринарной медицины Кубанского государственного аграрного университета. 350044, г. Краснодар, ул. Калинина, 13/9, E-mail: mephIsto83@lnbox.ru тел. 89284692399
Терехов Владимир Иванович, доктор биологических наук, профессор кафедры микробиологии, эпизоотологии и вирусологии факультета ветеринарной медицины Кубанского государственного аграрного улниверситета. 350044 г Краснодар ул Калинина. 13 тел 89183194429
http://vetkuban.com/num6_20106.html