УДК 619:001.891.53:582.282.23:636.028
DOI 10.33861/2071-8020-2023-5-18-21
Малков С. В., Красноперов А. С., Опарина О. Ю., Белоусов А. И. Федеральное государственное бюджетное
научное учреждение «Уральский федеральный аграрный научно-исследовательский центр»
Уральского отделения Российской академии наук, г. Екатеринбург
В период усиления политических санкций увеличивается объём импортозамещения во всех отраслях и прослеживается тенденция существенного роста количества оригинальных и генерических лекарственных средств и кормовых добавок в Российской Федерации. Одним из способов интенсификации животноводства на современном этапе является стабилизация микрофлоры желудочно-кишечного тракта и повышение переваримости питательных веществ корма с применением кормовых добавок, созданных на основе высушенных живых дрожжей. Решая проблему продовольственной безопасности населения Российской Федерации, применение вновь создаваемых инновационных продуктов невозможно без всестороннего изучения специфической эффективности и функциональной биобезопасности в экспериментальных исследованиях. Поэтому каждый вновь созданный продукт для применения в сельском хозяйстве в обязательном порядке должен пройти токсикологическую оценку [3, 8, 14].
Цель исследования - оценить токсическое действие новой кормовой добавки, созданной на основе высушенных живых дрожжей Saccharomyces cerevisiae на лабораторных животных.
Материалы и методы исследований. Исследования проводили в период 2021-2022 годов на базе отдела экологии и незаразной патологии животных Уральского научно-исследовательского ветеринарного института - структурного подразделения ФГБНУ УрФАНИЦ УрО РАН в рамках Государственного задания в соответствии с Программой ФНИ государственных академий наук по направлению 4.2.1.5 «Разработка технологий прижизненного управления качеством животноводческого сырья для получения высококачественных и безопасных продуктов питания».
Кормовая добавка, созданная на основе высушенных живых дрожжей Saccharomyces cerevisiae var. boulardii (штамм CNCM I-1079) с активностью не менее 1010 КОЕ/г представляет собой сыпучий микрокапсулированный порошок светло-серого цвета, не растворимый в воде.
Доклинические испытания по определению острой токсичности (n=6), хронической токсичности (n=40) проводили на клинически здоровых самках нелинейных лабораторных крыс, половозрелых, небеременных и ранее нерожавших. Возраст крыс на начало эксперимента 8-9 недель, живая масса 180-195 г.
Экспериментальных животных содержали в одинаковых условиях с контролируемым микроклиматом согласно нормативным санитарно-гигиеническим требованиям [1, 2, 5, 7, 10, 11].
В течение 10 дней до начала исследования все грызуны проходили карантинирование с последующим взвешиванием на весах CAS SW-10 (Южная Корея), маркирование и формирование групп.
Перед определением острой токсичности лабораторных крыс выдерживали на голодной диете в течение 12 часов со свободным доступом к воде. Затем грызунов взвешивали и на основании массы тела рассчитывали количество испытуемой добавки. Исследуемый продукт измельчали до состояния порошка, смешивали с аналогичным количеством воды и вводили полученную суспензию при помощи зонда индивидуально внутрижелудочно каждому животному. Особям 1-ой группы в количестве 2000 мг/кг, а 2-ой группы - 5000 мг/кг массы тела. Наблюдения за крысами проводили в течение первых 30 минут и регистрировали признаки токсичности, затем с интервалом 60 минут последующие 4 часа. После задавали корм, согласно регламента опыта. Оценку состояния животных осуществляли индивидуально ежедневно с выявлением физиологических, поведенческих, болевых и пищевых реакций в течение 14 дней в соответствии с ГОСТ [6]. Контрольные взвешивания проводили на 7 и 14 дни эксперимента.
Хроническую токсичность определяли в трёхмесячный период при ежедневном включении в рацион растущих грызунов опытных групп кормовой добавки в количестве: 1-ой (n=10) - 500 мг/кг, 2-ой (n=10) - 750 мг/кг и 3-ей (n=10) - 1000 мг/кг. Контрольная группа животных (n=10) получала только стандартный рацион.
Наблюдение за животными проводили ежедневно по общепринятой схеме, с учетом потребления корма и воды, состояния слизистых оболочек и волосяного покрова. Еженедельно осуществляли взвешивание с целью изучения прироста живой массы тела. Перед опытом, в середине и по окончании отбирали пробы крови для изучения динамики гематологических и биохимических показателей. В завершение проведенных опытов осуществляли эвтаназию грызунов, вскрытие и макроскопическую оценку внутренних органов с последующим взвешиванием и проведением расчетов массовых коэффициентов [7].
Гематологические исследования включали определение количества эритроцитов, лейкоцитов, концентрации гемоглобина. Для подсчета клеток крови и измерения гемоглобина использовали автоматический ветеринарный гематологический анализатор Abacus Junior Vet фирмы «Diatron» (Австрия) с использованием стандартных реактивов фирмы «Diatron» (Австрия); лейкоцитарную формулу подсчитывали в мазках крови, окрашенных по Романовскому-Гимза. Учет результатов проводили визуально на микроскопе Olympus BX 43 (Olympus, Япония).
Исходя из полученных данных гемограммы крови рассчитывали интегральные лейкоцитарные индексы как более чувствительные маркеры возможной интоксикации, аллергизации и воспалительного процесса в организме: лейкоцитарный индекс (далее, ЛИ); лейкоцитарный индекс интоксикации по Я.Я. Кальф-Калифу (далее, ЛИИ в «упрощённой модификации 1950 г.»); общий индекс эндогенной интоксикации (далее, ОИИ); гематологический показатель интоксикации (далее, ГПИ); ядерный индекс по Г.Д. Даштаянцу (далее, ЯИ); индекс Кребса (далее, ИК); индекс сдвига лейкоцитов крови (далее, ИСЛК); индекс аллергизации (далее, ИА); индекс соотношения лимфоцитов и эозинофилов (далее, ИСЛЭ); индекс соотношения лейкоцитов и СОЭ (далее, ИЛСОЭ); лимфоцитарно-гранулоцитарный индекс (далее, ЛГИ) [4, 9, 12, 13].
Биохимические исследования сыворотки крови проводили с применением кинетических, колориметрических и турбиме-трических методов. Лабораторное оборудование: автоматический биохимический анализатор «Chem Well-2910 Combi» фирмы «Awaveness Technology», USA и стандартные наборы реактивов фирм «Vital Diagnostics Spb» (Россия), «DIALAB GmbH» (Австрия). Достоверность выполнения измерений подтверждена контрольными материалами, рекомендованными производителями реактивов.
В качестве объективных показателей токсического действия использовали специфические биохимические маркеры в сыворотке крови: активность аспартат-аминотрансферазы (далее, АСТ), что позволяло выявить органоспецифическое токсическое действие на печень, почки и сердце; содержание мочевины и креатинина - как показатели функции почек; уровень глюкозы -маркер состояния поджелудочной железы; активность щелочной фосфатазы - маркер для диагностики заболеваний костной системы, печени, желчевыводящих путей и почек; содержание общего белка - для определения состояния белкового обмена.
Статистический анализ данных обработан математически с помощью программы IBM SPSS Statistics.
Результаты исследований и обсуждение. При определении острой токсичности вводили испытуемую кормовую добавку лабораторным крысам с дальнейшей токсикометрической оценкой и выявлением симптомокомплекса отравления.
При проведении эксперимента как в первые 4 часа, так и в последующие 14 суток не было установлено видимых признаков интоксикации, независимо от дозы кормовой добавки (2000 мг/кг и 5000 мг/кг массы тела). Сохранность грызунов составляла 100%, отсутствовали изменения в потреблении корма и воды, цвете видимых слизистых оболочек, реакции на звуковые и болевые раздражители, периодичности актов дефекации и консистенции фекалий. Температура тела, частота пульса и количество дыхательных движений оставались в пределах референтных величин.
Живая масса лабораторнывх животных на 7 и 14 сутки увеличивалась в 1-ой группе на 3,20 и 7,28%, а во 2-ой группе на 3,55 и 7,80% по отношению к фоновым значениям, что соответствовало нормативным параметрам физиологического развития здоровых грызунов. При аутопсии исследуемых животных, независимо от дозы введения кормовой добавки, не было зарегистрировано патологических изменений в цвете, консистенции и размере внутренних органов.
Определение хронической токсичности не выявило существенных этологических, физиологических и метаболических изменений в организме, независимо от длительности потребления грызунами кормовой добавки.
В течение эксперимента отмечали некоторые изменения гематологических показателей крови. У животных контрольной группы установлено увеличение количества эритроцитов, гемоглобина и лейкоцитов на 9,1%, 8,7%, 31,2% соответственно и сокращение показателя СОЭ в 1,9 раза, а у грызунов опытных групп значения оставались в пределах фоновых. Кроме того, у интактных особей зарегистрировали повышение уровня тромбоцитов на 28,4%, а у животных, в рационе которых была кормовая добавка, отметили снижение на 14,0%, 6,6% и 3,8% соответственно.
В крови грызунов всех групп выявили несущественное повышение абсолютных значений уровня гематокрита, количества эритроцитов и лейкоцитов, что явилось признаком физиологической «подстройки» организма лабораторных крыс с включением компенсаторных механизмов регуляции и сохранения равновесия у здорового животного.
Анализом вариаций значений пулов лейкоцитов и лимфоцитов в крови экспериментальных и контрольных крыс не было выявлено статистически значимых отличий, что свидетельствовало об отсутствии в организме особей опытных групп воспалительных и аллергических реакций при потреблении ими исследуемой кормовой добавки.
Фоновые значения основных биохимических параметров крови лабораторных крыс находились в пределах референтных значений. Содержание общего белка составляло 75,24±1,77 г/л, глюкозы - 4,84±0,18 ммоль/л, креатинина - 67,96±4,99 мкмоль/л, мочевины - 4,64±0,39 ммоль/л, холестерина -2,13±0,21 ммоль/л.
Имела место несколько повышенная активность сывороточных ферментов: щелочная фосфатаза - 191,13±34,27 Ед/л, АСТ - 170,25±15,78 Ед/л, что является физиологической нормой для данного вида лабораторных животных.
При длительном скармливании кормовой добавки у грызунов наметилась тенденция изменения показателей белкового обмена -увеличение общего белка в сыворотке крови в среднем на 2,8-4,5% у особей опытных групп. Данные вариации могут быть следствием более качественного усвоения питательных веществ корма.
По завершении исследовательского периода животных подвергли эвтаназии с анализом картины патологоанатомического вскрытия. Видимых изменений во внутренних органах не выявили. Отсутствие негативного эффекта испытуемого продукта также подтверждает анализ динамики набора живой массы и рассчитанные массовые коэффициенты внутренних органов (таблица 1).
Таблица 1 Массовые коэффициенты внутренних органов белых крыс при изучении хронической токсичности кормовой добавки
| Группы животных | Вес животных, | Массовые коэффициенты внутренних органов | ||||
|---|---|---|---|---|---|---|
| Сердце | Легкое | Печень | Почки | Селезенка | ||
| Контрольная | 256,35±5,89 | 0,32±0,03 | 0,78±0,17 | 4,04±0,11 | 0,60±0,02 | 0,16±0,01 |
| Опытная 1 (100 мг/голову) | 264,41±7,84 | 0,36±0,07 | 0,65+0,11 | 3,23±0,21 | 0,53±0,02 | 0,19±0,01 |
| Опытная 2 (150 мг/голову) | 267,22±6,24 | 0,34±0,05 | 0,74±0,10 | 3,92±0,18 | 0,61±0,03 | 0,17±0,03 |
| Опытная 3 (200 мг/голову) | 279,24±6,86 | 0,36±0,03 | 0,79±0,12 | 4,02±0,23 | 0,63±0,02 | 0,15±0,02 |
К окончанию эксперимента у грызунов опытных групп значения этих показателей были несколько выше по отношению к интактным, но эта разница не имела статистически значимых различий.
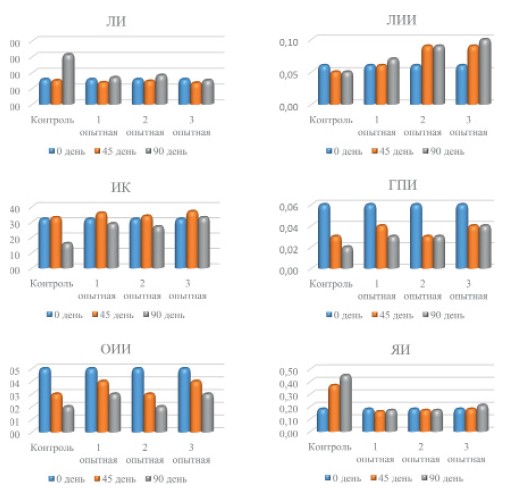
Подтверждением отсутствия токсичности исследуемой кормовой добавки послужило определение интегральных лейкоцитарных индексов (рисунок 1, 2).

Рис. 1. Интегральные лейкоцитарные индексы интоксикации и эндотоксикоза
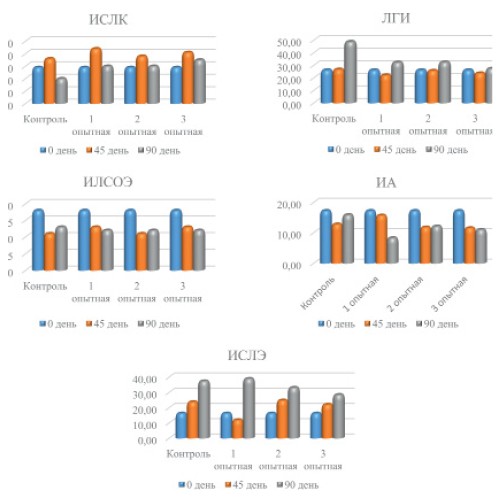
Рис. 2. Интегральные лейкоцитарные индексы воспаления и аллергизации
В ходе проведения трехмесячного исследования хронической токсичности кормовой добавки не отметили существенных изменений в лейкоцитарной формуле лабораторных животных всех групп.
Анализируя цифровые результаты вычислений индексов интоксикации (ЛИ, ЛИИ, ИК, ГПИ), индексов эндотоксикоза (ОИИ, ЯИ), индексов активности воспалительных процессов (ИСЛК, ЛГИ, ИЛСОЭ), индексов аллергизации (ИА, ИСЛЭ) зарегистрировали незначительные вариации значений у крыс опытных групп, которые не могут свидетельствовать о наличии в организме интоксикационных, воспалительных и аллергических процессов.
Заключение. По результатам изучения физиологического состояния лабораторных животных, их реакции на внешние раздражители, показателей гемограммы в динамике исследовательского периода, расчета интегральных лейкоцитарных индексов, морфометрической картины внутренних органов установлено, что кормовая добавка не вызывала негативных изменений общего состояния и поведенческих реакций опытных крыс по сравнению с контрольными особями. Консеквецией испытания экспериментального продукта явилась безопасность применения, которая позволила выработать алгоритм динамического мониторинга совокупности проводимых исследований. Это позволило сделать вывод о том, что испытуемая кормовая добавка не обладает ток-сигенными свойствами, относится к IV классу опасности «вещества малоопасные» по ГОСТ 12.1.007-76 и может быть рекомендована для клинических испытаний на сельскохозяйственных животных.
Список литературы:
1. ГОСТ Р 51232-98. Вода питьевая. Общие требования к организации и методам контроля качества.
2. ГОСТ 34566-2019. Комбикорма полнорационные для лабораторных животных. Технические условия.
3. Красноперов, А. С. Изучение хронической токсичности кормовой добавки В-сет на лабораторных животных / А. С. Красноперов, А. И. Белоусов, Н. А. Верещак // Мат. Междунар. науч.-практ. конф. мол. уч. и специалистов «Эколого-биологические проблемы использования природных ресурсов в сельском хозяйстве». 2017. С. 235-240.
4. Ломако, В. В. Влияние разных режимов охлаждения (краниоцеребральной и иммерсионной гипотермии, поверхностных ритмических и экстремальных холодовых воздействий) на лейкоцитарные показатели крови крыс // Проблемы криобиологии и криомедицины. 2018. № 28 (4). С. 293-310.
5. Методические рекомендации по содержанию лабораторных животных в вивариях научно-исследовательских институтов и учебных заведений. РД-АПК 3.10.07.02-09. 2009. 29 с.
6. ГОСТ 32644-2014. Методы испытания по воздействию химической продукции на организм человека. Острая пероральная токсичность - метод определения класса острой токсичности.
7. Миронов, А. Н. Руководство по проведению доклинических исследований лекарственных средств: часть первая // Гриф и К. 2012. 944 c.
8. Определение острой и хронической токсичности препарата «Коли-хинол» для ветеринарного применения / И. А. Шкуратова, Н. А. Верещак, А. И. Белоусов [и др.] // Актуальные вопросы ветеринарной фармакологии, токсикологии и фармации. 2013. С. 646-649.
9. Островский, В. К. Показатели крови и лейкоцитарного индекса интоксикации в оценке тяжести и определении прогноза при воспалительных, гнойных и гнойно-деструктивных заболеваниях / В. К. Островский, А. В. Мащенко, Д. В. Янголенко // Клиническая лабораторная диагностика. 2006. № 6. С. 128-132.
10. ГОСТ 33215-2014. Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур 11. ГОСТ 33216-2014. Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами.
12. Сидельникова, В. И. Эндогенная интоксикация и воспаление: последовательность реакций и информативность маркеров (обзор) / В. И. Сидельникова, А. Е. Черницкий, М. И. Рецкий // Сельскохозяйственная биология. 2015. Т. 50. № 2. С. 152-161.
13. Сипливый, В. А. Использование лейкоцитарных индексов для прогнозирования исхода перитонита / В. А. Сипливый, Е. В. Конь, Д. В. Евтушенко // Клиническая хирургия. 2009. № 9. С. 21-26.
14. Фармако-токсикологические исследования кормовой добавки Лакто-Драйв на лабораторных животных / Н. А. Верещак, Н. М. Стариков, И. Ю. Вершинина, О. Ю. Опарина // Вопросы нормативно-правового регулирования в ветеринарии. 2015. № 2. С. 117-119.
Резюме. При определении острой и хронической токсичности кормовой добавки, созданной на основе живых дрожжей Saccharomyces cerevisiae var. boulardii, не наблюдали симптомокомплекса отравления у лабораторных животных. У крыс отсутствовали изменения в потреблении корма и воды, цвете видимых слизистых оболочек, реакции на звуковые и болевые раздражители. Значения температуры тела, частота пульса и количество дыхательных движений оставались в пределах референтных величин. Гибели животных в период эксперимента не выявили. В течение трехмесячного периода определения хронической токсичности регистрировали незначительные вариации гематологических показателей в крови как опытных, так и интактных особей. Наблюдали повышение абсолютных значений уровня гематокрита, количества эритроцитов и лейкоцитов, что явилось признаком физиологической «подстройки» организма лабораторных крыс с включением компенсаторных механизмов сохранения равновесия внутренних процессов здорового организма. Данные локомоции не превышали физиологических границ. Начальные значения основных биохимических параметров сыворотки крови лабораторных крыс находились в пределах референтных значений. Содержание общего белка -75,24±1,77 г/л, глюкозы - 4,84±0,18 ммоль/л, креатинина - 67,96±4,99 мк-моль/л, мочевины - 4,64±0,39 ммоль/л, холестерина - 2,13±0,21 ммоль/л. Однако выявили повышение активности сывороточных ферментов: щелочная фосфатаза - 191,13±34,27 Ед/л, аспартат-аминотрансфераза (АСТ) -170,25±15,78 Ед/л, что не является критичным для физиологической нормы грызунов. Длительное применение кормовой добавки лабораторным животным активизировало белковый обмен - увеличилось количество общего белка в сыворотке крови особей опытных групп на 2,8-4,5%, что может указывать на более качественное усвоение питательных веществ кормов.
Ключевые слова: кормовая добавка, живые дрожжи, Saccharomyces cerevisiae var. boulardii, доклинические исследования, острая токсичность, хроническая токсичность, живая масса, гематологические исследования, биохимические исследования, лабораторные крысы.
Сведения об авторах:
Малков Сергей Витальевич, кандидат ветеринарных наук, старший научный сотрудник отдела экологии и незаразной патологии животных ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-912-2485082; e-mail: aibolit_2001@mail.ru.
Опарина Ольга Юрьевна, кандидат ветеринарных наук, старший научный сотрудник отдела экологии и незаразной патологии животных ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-912-6011634; e-mail: olia91oparina@yandex.ru.
Белоусов Александр Иванович, доктор ветеринарных наук, старший научный сотрудник отдела экологии и незаразной патологии животных ФГБ-НУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-908-6390771; e-mail: white-knight@mail.ru.
Ответственный за переписку с редакцией: Красноперов Александр Сергеевич, кандидат ветеринарных наук, старший научный сотрудник отдела экологии и незаразной патологии животных ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-903-0833132; e-mail: marafon.86@list.ru.
http://vetkuban.com/num5_202306.html