УДК 619:616.993.192
DOI 10.33861/2071-8020-2022-5-28-31
Зубенко А.А., Фетисов Л.Н., Святогорова А.Е., Кононенко К.Н. Северо-Кавказский зональный научно-исследовательский
ветеринарный институт - филиал Федерального государственного бюджетного научного учреждения «Федеральный
Ростовский аграрный научный центр», Ростовская область, г. Новочеркасск
Клименко А.И. Федеральное государственное бюджетное научное учреждение «Федеральный Ростовский
аграрный научный центр», Ростовская область, п. Рассвет
Галогенимидазолы - важная группа соединений, используемых в качестве синтонов в синтезе различных производных имидазола и построенных на его основе конденсированных гетероциклических систем, в том числе с узловым атомом азота. Некоторые производные галогенимидазолов обладают высокой биологической активностью и находят применение в качестве лекарственных препаратов для лечения гипертонии [2], а также химических средств защиты растений [7].
В обзорной статье [1] отражены работы по синтезу галогенимида-золов, опубликованные, в основном, до середины XX в. Однако важнейшие исследования по разработке более простых препаративных методов получения этих соединений были выполнены за последние 55-60 лет.
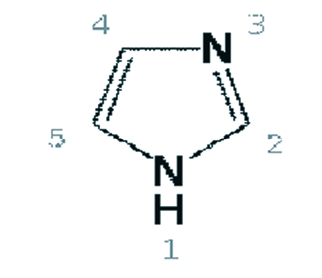
Имидазол - органическое соединение класса гетероциклов, пятичленный цикл с двумя атомами азота и тремя атомами углерода в цикле, изомерен пиразолу [10]. Структурная формула имидазола представлена на рисунке 1.

Рис. 1. Структура имидазола с условной нумерацией его атомов углерода
В мировой научной литературе можно найти много сообщений, касающихся разработки, синтеза и оценки биологической активности новых соединений в ряду имидазола.
Ju Liu et al. [8] разработали, синтезировали и оценили in vitro биологическую активность новых производных 4-феноксипиридина, содержащих имидазол-4-карбоксамид и 1,2,4-триазол-3-карбокса-мидные фрагменты в качестве противоопухолевых агентов. Выявили соединения со значительной антиферментативной активностью в отношении киназ опухолевых клеток; выявили также соединения, способные индуцировать апоптоз клеток.
Assia Belhassan, Fatima En-nahli [4] провели док-исследование восемнадцати производных имидазола на основе 7-хлор-4-ами-нохинолина против нового коронавируса (SARS-CoV-2). Среди изученных, производных имидазола обнаружены 3 соединения с потенциальными противовирусными свойствами, превышающими активность хлорохина и гидроксихлорохина. В данном исследовании этих молекул было установлено, что они связывают активный центр основной протеазы SARS-CoV-2. Результаты показали, что молекулы этих соединений имеют большую энергию связывания с протеазой SARS-CoV-2 (код pdb 6ЛУ7) по сравнению с другими производными имидазола и двумя препаратами хлорохина.
Ling Li et al. [9] представили в своей работе результаты исследований в ряду 2-арил-4-бис-амидных имидазолов. Эти соединения были синтезированы и оценены in vitro на противовоспалительную активность при заболеваниях кишечника. Несколько соединений продемонстрировали высокую противовоспалительную эффективность при экспериментальном колите мышей. Соединения были малотоксичны.
Emanuel Hernandez-Nunez с соавторами [6] синтезировали соединение [1М-бензил-2-(2-метил-4-нитро-1Н-имидазол-1-ил) ацетамид], которое проявило антипаразитарную активность в отношении трех одноклеточных паразитов (Giardia intestinalis, Trichomonas vaginalis и Entamoeba histolytica) в сравнении с бензнидазолом и метронидазолом. В результате исследования было установлено, что соединение [N-бензил-2-(2-метил-4-нитро-1H-имидазол-1-ил) ацетамид] было в 2 раза активнее, чем бензнидазол против Trichomonas vaginalis и Giardia intestinalis, и оно было так же активно, как и бенз-нидазол против Entamoeba histolytica. Метронидазол проявил селективную токсичность в отношении Entamoeba histolytica. Полученные результаты показали, что соединение [М-бензил-2-(2-метил-4-нитро-1Н-имидазол-1-ил)ацетамид] обладает противопаразитарным действием в микромолярных концентрациях в отношении исследуемых видов эймерий и может рассматриваться как биоизостер бензни-дазола.
Целью исследования стала разработка, синтез и определение уровня антипротозойной активности в ряду новых галогенпроизвод-ных имидазольных систем.
Материалы и методы исследований. Большая часть соединений (1-8, 13-17) были синтезированы нами реакцией галогеними-дазолов с соответствующими алкилгалогенидами в щелочной среде. В синтезе пиридинового производного 11 применяли 2-хлор-3-нит-ро-пиридин и 4,5-дихлоримидазол, которые кипятили в диметилфор-мамиде в присутствии одного эквивалента основания. Аналогичную методику использовали при синтезе структуры 9 с использованием 1-(2-гидроксиэтил)-4,5-дихлоримидазола и 2-хлор-3-нитропиридина. Продукт 17 получен алкилированием 4,5-дихлоримидазола n-нит-робензилхлоридом с последующим восстановлением нитрогруппы. Кетон 10 был синтезирован метилированием 2-бензоил-4,5-дихло-римидазола с помощью диметилсульфата в щелочной среде. Соединение 16 получено алкилированием 2,4,5-трибромимидазола с помощью хлорацетонитрила в щелочной среде. Соединение ХБ-1 2-имино-1-(в-фенокси)этил-3-(3,4-дихлорбензил) бензимидазолин в виде гидробромида представляет собой производное бензимидазола и описано нами в патенте РФ № 2477129.
Исследование антипротозойной активности проводили по методике [3] на простейших вида Colpoda steinii (полевой изолят, коллекция лаборатории паразитологии Северо-Кавказского зонального научноисследовательского ветеринарного института). Работу выполняли в микропланшетах для постановки ИФА. В качестве среды для переживания простейших использовали смесь кипяченой водопроводной воды и стерильной дистиллированной воды в равных объемах. Первоначальное разведение вещества готовили на дистиллированной воде в присутствии диметилсульфоксида. Препараты сравнения -толтразурил и хлорохин. Результат оценивали по величине минимальной ингибирующей концентрации в мкг/мл. Разработанная нами методика в переводе на английский язык опубликована в высокорейтинговом зарубежном журнале Polyhedron [5].
Результаты исследований и их обсуждение. Уровень антипро-тозойной активности изученных галогенированных имидазольных соединений представлен в таблице 1.
Таблица 1 Антипротозойная активность галогенированных производных имидазольных систем в отношении Colpoda steinii
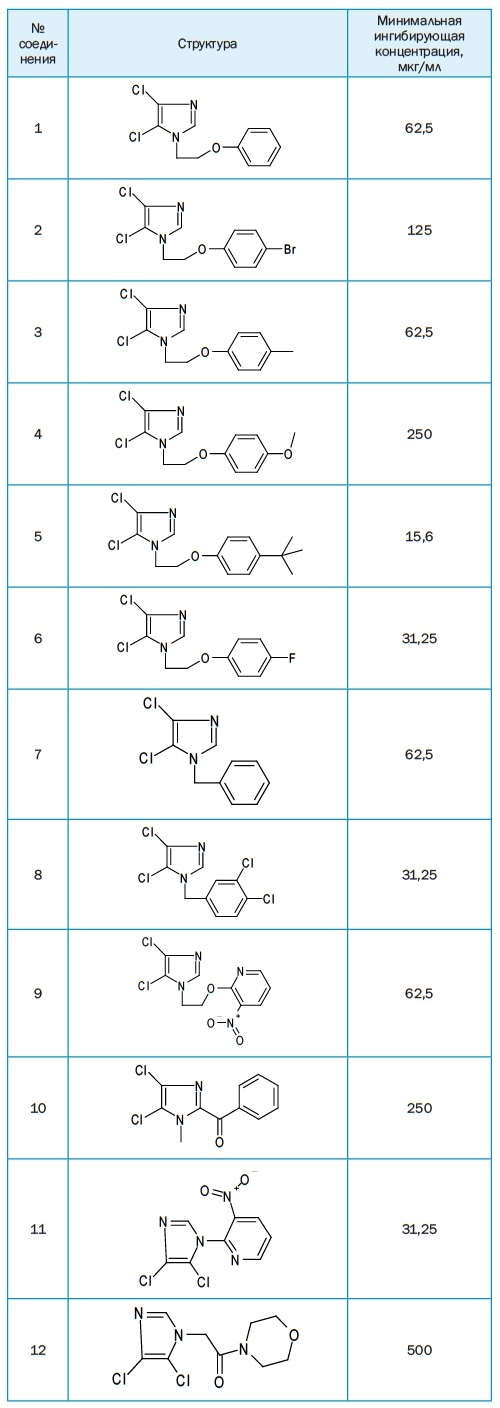
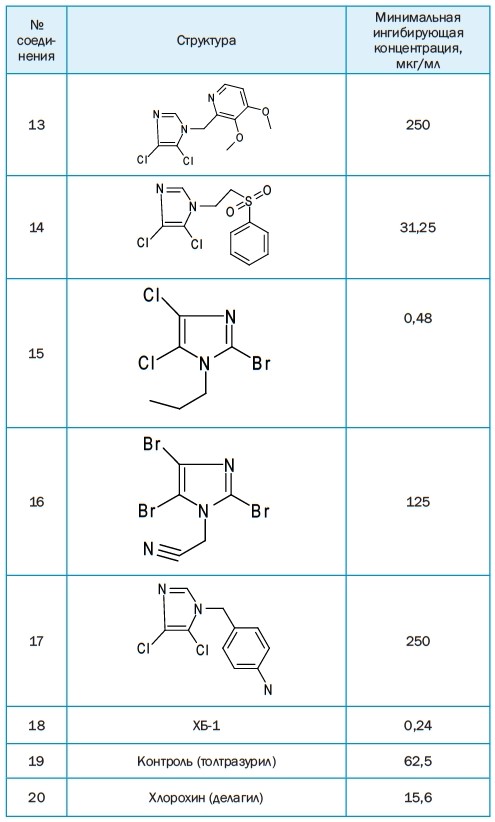
Высокий уровень протистоцидной активности (15,6 мкг/мл) установлен у соединения 5, что соответствует активности хлорохина и в четыре раза выше активности толтразурила, широко используемого в ветеринарии для лечения кокцидиозов. Ещё более значительной активностью (0,48 мкг/мл) обладает соединение 15, что превышает показатель активности толтразурила и хлорохина в десятки раз.
Средний уровень активности в отношении инфузорий (62,5-31,25 мкг/мл) выявлен у соединений 1, 3, 6, 7, 8, 9, 11 и 14, что составило 44,4 % от числа исследованных веществ.
Другие соединения проявили активность ниже среднего уровня и слабую (125-500 мкг/мл), что составило 44,4% от числа исследованных соединений.
Как показали исследования антипротозойной активности исходный 4,5-дихлоримидазол, который применяется в синтезе большинства представленных в данном исследовании соединений, обладает слабой активностью (500 мкг/мл). Алкилирование по атому азота приводит к усилению активности, которая для соединений 6, 8, 11 в 2 раза выше, чем у препарата сравнения толтразурила (62,5 мкг/ мл), а для соединения 5 такой показатель в 4 раза выше, чем для контрольного препарата. Наивысшей активностью из всех изученных обладает производное бензимидазола ХБ-1, которое мы исследовали далее в опыте на кроликах при кокцидиозе. Соединение ХБ-1 представляет собой производное бензимидазола и описано нами в патенте РФ № 2477129.
Заключение. Среди синтезированных нами новых галогенимидазольных систем выявлены 55,5% веществ, обладающих средним и высоким уровнем протистоцидной активности. Алкилирование по атому азота приводит к усилению активности. Очень высокой активностью (0,48 мкг/мл, что более, чем 100 раз выше, чем у контрольного препарата толтразурила) обладает соединение 15 (производное 2-бром-4,5-дихлоримидазол). Соединение 18 (2-имино-1-(в-фенокси)этил-3-(3,4-дихлорбензил) бензимидазолин) в виде гидробромида обладает наивысшей протистоцидной активностью - 0,24 мкг/мл.
Список литературы:
1. Александрова Е.В., Кравченко А.Н., Кочергин П.М. Методы синтеза гало-генимидазолов// Химия гетероциклических соединений. 2010. № 11. С. 16031629.
2. Машковский М.Д. Лекарственные средства// М.: Новая волна. 2005. С. 444.
3. Фетисов Л.Н., Зубенко А.А., Бодряков А.Н., Бодрякова М.А. Изыскание протистоцидных средств// Вопросы нормативно-правового регулирования в ветеринарии. 2012. № 4-1. С. 70-72.
4. Belhassan Assia, Fatima En-nahli, Hanane Zaki et al. Assessment of effective imidazole derivatives against SARS-CoV-2 main protease through computational approach// Life Sciences. 2020. Vol. 262. 118469 (https://doi.org/10.1016/ j.lfs.2020.118469).
5. Burlov A.S., Koshchienko Yu.V., Makarova N.I. et al. Complexes of zinc (II) with n-[2-(hydroxyalkyliminomethyl)phenyl]-4-methylbenzenesulfonamides: synthesis, structure, photoluminescence properties and biological activity// Polyhedron. 2018. Т. 144. Pp. 249-258 (DOI: 10.1016/j.poly.2018.01.020).
6. Hernandez-Nunez Emanuel, Hugo Tlahuext, Rosa Moo-Puc et al. Synthesis and in vitro trichomonicidal, giardicidal and amebicidal activity of N-acetamide(sulfonamide)-2-methyl-4-nitro-1H-imidazoles// European Journal of Medicinal Chemistry. 2009. Vol. 44. Issue 7. Pp. 2975-2984.
7. Ogawa M., Nishimura A. Application European Patent Office № 1417887// Abstract journal ‘Chemistry’. 2004. 04.18-190.271П.
8. Liu Ju, Fang Liu, Zhen Li et al. Novel 4-phenoxypyridine derivatives bearing imidazole-4-carboxamide and 1,2,4-triazole-3-carboxamide moieties: Design, synthesis and biological evaluation as potent antitumor agents// Bioorganic Chemistry. 2022. Vol. 120. 105629 (https://doi.org/10.1016/ j.bioorg.2022.105629).
9. Li Ling, Sijie Yuan, Lin Lin et al. Discovery of novel 2-aryl-4-bis-amide imidazoles (ABAI) as anti-inflammatory agents for the treatment of inflammatory bowel diseases (IBD)// Bioorganic Chemistry. 2022. Vol. 120. 105619 (https://doi. org/10.1016/j.bioorg.2022.105619).
10. https://commons.wikimedia.org/wiki/File:Imidazole_2D_numbered.svg?
Резюме. Настоящая работа включает методы модификации и получения новых галогенпроизводных имидазольных систем. Нашими исследованиями установлен уровень антипротозойной активности новых синтезированых галогенированных производных имидазольных систем. Соединения 1-8, 13-17, синтезированные реакцией 4,5 дихлоримидазолов с соответствующими алкилгало-генидами в щелочной среде, проявляют протистоцидную активность на уровне от 62,5 до 15,6 мкг/мл. Этот уровень равен или превышает уровень активности препаратов сравнения толтразурила и хлорохила. В синтезе пиридинового производного 11 применяли 2-хлор-3-нитро-пиридин и 4,5-дихлоримидазол, которые кипятили в диметилформамиде в присутствии одного эквивалента основания. Уровень протистоцидной активности этого соединения также оказался значительным и составлял 31,25 мкг/мл, что в два раза выше чем активность толтразурила. Аналогичную методику использовали при синтезе структуры 9 с использованием 1-(2-гидроксиэтил)-4,5-дихлоримидазола и 2-хлор-3-нитропириди-на. Активность этого соединения была равной активности толтразурила. Производное 2-бром-4,5-дихлоримидазола (15) обладает активностью на уровне 0,48 мкг/мл, превышающем активности препаратов сравнения. Продукт 17 получен алкилированием 4,5-дихлоримидазола n-нитробензилхлоридом с последующим восстановлением нитрогруппы. Кетон 10 был синтезирован метилированием 2-бензоил-4,5-дихлоримидазола с помощью диметилсульфата в щелочной среде. Соединение 16 получено алкилированием 2,4,5-трибромимидазола с помощью хлорацетонитрила в щелочной среде. Соединение ХБ-1 представляет собой производное бензимидазола. Данные группы соединений проявили высокую биологическую активность в отношении тест-культуры Colpoda steinii, (от 500 мкг/мл до 0,24 мкг/мл). Полученные галогенимидазолы могут быть использованы для расширенных токсикологических и фармакологических исследований с целью разработки способов лечения животных при протозойных заболеваниях.
Ключевые слова: галогенпроизводные имидазольных систем, методы синтеза, простейшие вида Colpoda steinii, уровень антипротозойной активности в зависимости от строения синтезированных соединений
Сведения об авторах:
Зубенко Александр Александрович, доктор биологических наук, главный научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-928-6049743; e-mail: alexsandrzubenko@yandex.ru.
Фетисов Леонид Николаевич, кандидат ветеринарных наук, ведущий научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-908-1978224; e-mail: fetisoff.leonid2018@yandex.ru.
Кононенко Кристина Николаевна, научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростов-ская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-918-5943886; e-mail: velikayakrista@mail.ru.
Клименко Александр Иванович, академик РАН, доктор сельскохозяйственных наук, профессор, директор ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346735, Ростовская область, Аксайский район., п. Рассвет, ул. Институтская, 1; e-mail: dzni@mail.ru.
Ответственный за переписку с редакцией: Святогорова Александра Евгеньевна, младший научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-988-9525755; e-mail: sviatogorova.a@yandex.ru.
http://vetkuban.com/num5_202209.html