УДК 636.03:579.8
Донник И.М., Исаева А.Г., Мусихина Н.Б., Моисеева К.В., Гордеев А.А.
ФГБОУ ВО «Уральский государственный аграрный университет», г. Екатеринбург
Кривоногова А.С. ФГБНУ «Уральский федеральный аграрный
научно-исследовательский центр УрО РАН», г. Екатеринбург
Введение. Промышленные технологии содержания продуктивных животных подразумевают наличие большого поголовья на ограниченной площади, ограничение подвижности животных, тесный контакт, скученность, что способствует распространению микроорганизмов среди поголовья [4, 5, 12]. Увеличение доли патогенных и условно-патогенных микроорганизмов в микробиоценозе животноводческого объекта является нежелательным, так как приводит к ряду негативных последствий - от роста заболеваемости, снижения продуктивности животных и ухудшения качества продукции до распространения антибиотикорезистентности и снижения эффективности терапевтических мероприятий [3, 8, 12, 15, 16]. В настоящее время многие предприятия располагаются в районах, загрязненных различными ксенобиотиками техногенного происхождения [1, 14]. На фермах, находящиеся в таких районах, у животных возникает дополнительная стрессовая нагрузка, развиваются хронические вторичные иммунодефициты, что приводит к росту заболеваемости, и, следовательно, к повышенной потребности в антибиотиках для лечения животных [1, 3, 7, 10]. При этом высокопродуктивные животные также находятся в группе риска в связи с хроническим физиологическим истощением [5, 7]. Одними из наиболее проблемных микроорганизмов на ветеринарных и животноводческих объектах являются P. aeruginosa и S. aureus, которые вызывают значительную часть гнойно-септических поражений и осложнений у ослабленных, больных, новорожденных животных, на фоне травм, технологических стрессов [3, 5, 8, 11, 13]. Циркуляция данных микроорганизмов на животноводческих и птицеводческих объектах неизбежно приводит к формированию резистентных к антибиотикам штаммов [2, 6, 11]. Изменение структуры микробиоценоза, увеличение доли агрессивных патогенных представителей, утрата эффективности многими антибактериальными препаратами значительно затрудняют ветеринарные мероприятия по оздоровлению поголовья, что, в свою очередь, ведет к росту заболеваемости, выбраковке животных и птицы, увеличению расходов и снижению экономической эффективности производства. В связи с этим, представляются актуальными исследование условнопатогенной и патогенной частей микробиоценозов животноводческих предприятий и анализ зависимостей структуры микрофлоры от отдельных внешних и внутренних факторов.
Целью исследования являлся анализ структуры условно-патогенной микрофлоры на животноводческих и птицеводческих предприятиях различного профиля.
Задачами исследования являлись скрининг патогенной и условнопатогенной микрофлоры на МТФ, свиноводческих и птицеводческих предприятиях, а также анализ структуры условно-патогенной микрофлоры во взаимосвязи с отдельными экологическими и технологическими факторами.
Материалы и методы исследования. Проводили анализ типовой патогенной и условно-патогенной микрофлоры на различных объектах промышленного животноводства и птицеводства, расположенных в разных регионах Российской Федерации. Для достижения поставленных целей работы исследовали родовой и видовой состав микробиоты на птицефабриках яичного и мясного направления, на молочно-товарных фермах, на свинокомплексах. Для исследования были выбраны предприятия с одинаковым технологическим, хозяйственно-производственным циклом, породно-видовым составом животных, однотипным рационом и ветеринарным сопровождением. На молочно-товарных фермах исследовали смывы со слизистых оболочек, шерстного покрова, с вымени у коров и телят, смывы с оборудования, кормушек, поилок, ограждений, поверхностей; смывы с инвентаря для ухода за скотом, образцы подстилки, навоза, воды для поения, кормов, воздуха. На каждой молочно-товарной ферме были обследованы следующие отделения: родильное отделение, телятник, отделение дойного поголовья. На свиноводческих комплексах отбирали пробы воздуха, кормов и премиксов, подстилки, воды для поения, делали смывы со слизистых оболочек и сосков у супоросных и опоросившихся свиноматок, смывы со слизистых и кожи у животных из групп отъема, доращивания, откорма; смывы с оборудования, ограждения, поверхностей и инвентаря в различных точках технологических помещений. На птицеводческих предприятиях были взяты пробы корма, воды, воздуха, подстилки, помёта кур, смывы с клеток, кормушек, поилок, навозной ленты; смывы со слизистых оболочек, перьевого и кожного покрова, из клоаки кур-несушек разных возрастов (на ПФ яичного направления) и цыплят-бройлеров предубой-ного возраста (ПФ мясного направления). Всего было обследовано 24 животноводческих предприятия. Отобранные пробы анализировали по стандартным микробиологическим методикам: проводили посевы на питательные среды, культивирование, выделение чистой линии, идентификацию микроорганизмов, определение их патогенности и чувствительности к антибиотикам диско-диффузионным методом (минимальная ингибирующая концентрация) и методом серийных разведений [9]. «Исследование выполнено за счет гранта Российского научного фонда (проект № 18-16-00040)».
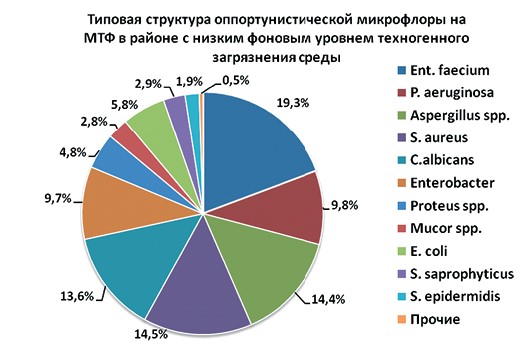
Результаты исследований и их обсуждение. Микробиологический анализ проб, отобранных на разных молочно-товарных фермах Свердловской области, показал, что родовой и видовой состав микрофлоры сравнительно одинаков, однако процентное соотношение микроорганизмов варьирует в зависимости от предприятия и конкретного отделения. Типовыми представителями патогенной и условно-патогенной микрофлоры, которых наиболее часто выявляли при скрининге, были: Enterococcus faecium, Enterococcus faecalis, Enterococcus durans, Pseudomonas aeruginosa, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Proteus vulgaris, Proteus mirabilis, Echerichia coli, Bacillius subtilis, Enterobacter spp., Citrobacter farmeri, Klebsiella spp., также в пробах обнаруживали значительное количество Candida albicans, Aspergillus spp., Mucor spp., Penicillium spp., Fusaium spp. Распределение данных микроорганизмов по частоте высевания в пробах, а также, доля в структуре условно-патогенной микрофлоры были схожими в предприятиях, находившихся в сходных экологических условиях - на фермах, имевших сходные показатели загрязнения агробиоценозов. При этом наличие технологических и хозяйственных связей между МТФ не оказывало статистически значимого влияния на структуру микрофлоры. Так, в Свердловской области было выявлено три типичных структуры условно-патогенной микрофлоры на МТФ, коррелировавших с интенсивностью техногенного загрязнения районов. В наименее техногенно нагруженных районах наиболее часто выявляли Enterococcus faecium (в 100% проб), а также Staphylococcus aureus (в 75% проб), из грибковой микрофлоры преобладали Aspergillus spp. и Candida albicans (более 75% и 70% соответственно). Citrobacter, Klebsiella, Enterococcus, Bacillius, наоборот, составляли менее 1% (рисунок 1).

Рис. 1. Типовая структура оппортунистической микрофлоры на МТФ в районе с низким фоновым уровнем техногенного загрязнения среды (Свердловская область, 2018 год)
На фермах, находящихся в районах с умеренным загрязнением агробиоценозов, выявили следующую микробиологическую картину: преобладающие штаммы - Ent. faecium (более 85% положительных проб), S. aureus (в 85% проб), P. aeruginosa (в 70% проб), Ent. faecalis (более 65% проб), Enterobacter spp. - около 70% проб. Все выявленные штаммы Enterobacter в тестах на патогенность дали отрицательный результат. Сводная структура патогенной микрофлоры на обследованных предприятиях на основе полученных данных была следующей: Ent. faecium (15,8%), S. aureus (13,4%), P.aeruginosa (12,7%), Ent. faecalis (11,8%), Enterobacter (10,6%), C. albicans (9,9%), Aspergillus spp. (8,6%), Mucor spp. (7,3%), S.epidermidis (6,1%), Proteus spp. (1,8%), B. subtilis (1,1%), прочие микроорганизмы - менее 0,9% в сумме. На МТФ в районах с наиболее высокой техногенной нагрузкой среды (выраженное загрязнение агробиоценозов тяжелыми металлами, радионуклидами и другими ксенобиотиками техногенного происхождения) отмечали наибольшую вариабельность структуры условно-патогенных микробиоценозов. В пробах присутствовало больше штаммов разных микроорганизмов, нежели в аналогичных пробах из других районов области. Так, в смывах и образцах материала наиболее часто обнаруживали Ent. faecium (в 79% от всего количества проб), P. aeruginosa (63%), S. aureus (15,4%), Proteus spp. (более 42% проб), Ent. faecalis (41% проб), Enterobacter (39%). Также часто встречались штаммы грибковой микрофлоры: в каждом обследованном отделении молочнотоварной фермы в среднем из 55-57 проб C. albicans высевали в 18 случаях, Aspergillus spp. - в 21, Mucor spp. - в 21, Penicillium spp. - в 9, Fusarium - в 8 случаях, что говорит о высокой обсемененности объектов спорами плесневых грибов и дрожжами. Структурное распределение в составе условно-патогенной микрофлоры представлено на рисунке 2.

Рис. 2. Типовая структура оппортунистической микрофлоры на МТФ в районе с высоким фоновым уровнем техногенного загрязнения среды (Свердловская область, 2018 год)
Более половины штаммов Pseudomonas aeruginosa, выявленных при скрининге МТФ Свердловской области, были выделены из проб, взятых в родильных отделениях ферм. Данный микроорганизм наиболее часто обнаруживали в подстилке, на инвентаре (соски, воронки для телят), ограждениях, в навозе животных. Инвентарь для ухода за скотом (лопаты, скребки, ветоши, трубки, вёдра) был обсеменен преимущественно протеем, синегнойной палочкой и энтерококками. В целом, в родильных отделениях обследованных ферм преобладали штаммы P. aeruginosa, S. aureus и Ent. faecium, а случаи обнаружения кишечной палочки, эпидермального стафилококка и фекального энтерококка были единичными. В отделениях дойных коров отмечали противоположную тенденцию - в основном из смывов и проб высевали E.coli, Ent. faecalis, S. epidermidis, S. saprophyticus и Proteus (в 86-90% случаев представлен P. vulgaris, P. mirabilis - 10-14% от выделенных штаммов протея). Обращает на себя внимание тот факт, что на обследованных МТФ выявляли ванкомицин-резистентные штаммы Ent. faecium и мультирезистентные штаммы P. aeruginosa с одинаковым профилем антибиотикочувствительности в пробах подстилки, смывах с половых путей коров из родильных отделений и в смывах со слизистых рта и носа у телят. Данный факт позволяет предположить, что обсеменение новорожденного теленка штаммами условно-патогенной микрофлоры происходит при его контакте с подстилкой, поверхностями в родильном отделении. При циркуляции в родильных отделениях резистентных штаммов высока опасность обсеменения ими телят.
Взаимосвязь структуры условно-патогенного микробиоценоза МТФ и степени техногенного загрязнения агробиоценозов, предположительно, обусловлена снижением защитных функций организма животных. В техногенно загрязненных районах крупный рогатый скот подвергается длительной хронической интоксикации тяжелыми металлами, радионуклидами, органическими ядами, что приводит к развитию хронического вторичного иммунодеффицита и снижению общей резистентности организма [1, 7, 10]. Данные условия являются благоприятными для развития патогенной и условно-патогенной микрофлоры.
Исследования, проведенные на свиноводческих предприятиях показали, что видовая структура условно-патогенной части микробиоты в них сравнительно одинакова, некоторые различия выявляли только в соотношении плесневых грибов. Типичное распределение выявлен -ных штаммов по частоте встречаемости было следующим: Ent. faecium (19,7%), P. aeruginosa (15,2%), Aspergillus spp. (14,0%), S. aureus (11,1%), C. albicans (8,7%), Enterobacter (8,2%), Proteus spp. (7,2%), Mucor spp. (4,4%), E.coli (3,9%), S. saprophyticus (3,7%), Fusaium spp. (3,5%). Штаммы S. epidermidis и Ent. faecalis обнаруживали редко, доля их в представленном выше соотношении не превышала 0,2% (рисунок 3). Установили высокий уровень обсеменения поголовья супоросных свиноматок C. albicans, S. aureus и P. aeruginosa: более половины смывов со слизистых оболочек рта, носа и влагалища были положительными по данным микроорганизмам. Инвентарь во всех обследованных предприятиях был обсеменен энтерококком, золотистым стафилококком, синегнойной палочкой, протеем (соотношение P. vulgaris и P. mirabilis составляло в среднем 5:1), а также грибковой микрофлорой. Общее микробное число в пробах воздуха из корпусов свиноводческих предприятий составляло от 1 800 до 4 926 КОЕ/м3, что свидетельствует о высокой микробной нагрузке. Зависимости структуры микробиоценозов от фонового загрязнения окружающей среды не выявили.
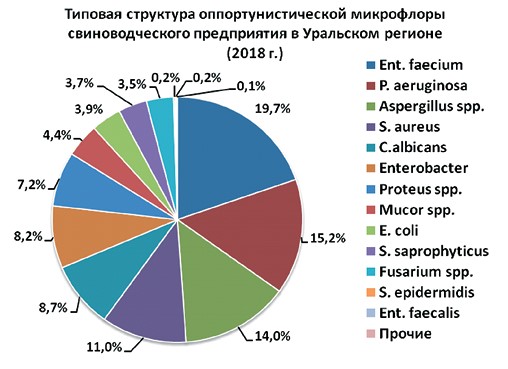
Рис. 3. Типовая структура оппортунистической микрофлоры свиноводческого предприятия в Уральском регионе (2018 год)
Исследования микрофлоры птицеводческих предприятий проводили на птицефабриках мясного и яичного направления. Наиболее распространенными типовыми представителями на всех обследованных объектах являлись Enterococcus faecium, Enterococcus faecalis, Enterococcus durans, Pseudomonas aeruginosa, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Proteus vulgaris, Proteus mirabilis, Echerichia coli, Bacillius subtilis, Enterobacter spp., Citrobacter farmeri, Klebsiella spp., Candida albicans, Aspergillus spp., Mucor spp., Penicillium spp., Fusaium spp. При этом соотношение количества выделенных штаммов варьировало в зависимости от профиля предприятия и его расположения. Преобладающим микроорганизмом, который высевали в 63-100% проб, был Enterococcus faecium. Второй по частоте встречаемости микроорганизм - Pseudomonas aeruginosa, его выделяли из 29-100% проб в зависимости от конкретного предприятия. В целом, доля P. aeruginosa была наибольшей и составляла на птицефабриках мясного направления в среднем 18,6% от всех выделенных условно-патогенных микроорганизмов, на птицефабриках яичного профиля - 19,7%. Было установлено, что на объектах, находящихся в техногенно загрязненных районах, а также, на объектах с относительно низким качеством кормов P. aeruginosa чаще выявляли в пробах из ротовой полости и клоаки кур-несушек и цыплят-бройлеров. На птицефабриках с более благополучными экологическими условиями - преимущественно в смывах с клеток и поилок (табл. 1). Данный факт может косвенно свидетельствовать о том, что в экологически неблагополучных районах существует хроническая токсическая нагрузка на пищеварительный тракт птицы, связанная с загрязнением корма металлическими поллютантами Fe, Cd, Cu, Pb и др.
Таблица 1. Встречаемость P. aeruginosa в пробах с разных объектов птицефабрик из разных районов
| Объект | Район с выраженным техногенным загрязнением (n=221) | Район с низким уровнем загрязнения среды (n=219) |
|---|---|---|
| Ротовая полость | 26 | 10 |
| Клоака | 24 | 6 |
| Наружные покровы | 14 | 13 |
| Подстилка, помёт | 25 | 11 |
| Клетка | 8 | 24 |
| Кормушка | 9 | 21 |
| Поилка | 17 | 26 |
Выводы. Проведенные исследования показали, что состав условно-патогенной микрофлоры на различных животноводческих объектах остается практически неизменным. А структура микробиоценоза, доли отдельных микроорганизмов подвержены изменениям. Зависимость структуры микробиоценоза от техногенной загрязненности окружающей среды выявлена на молочно-товарных фермах, а на свиноводческих предприятиях этот фактор влияния не оказал. Изученные показатели микрофлоры на свиноводческих предприятиях характеризовались наибольшей однородностью по сравнению с таковыми на МТФ или птицеводческих объектах.
Список литературы
Резюме. В статье приведены результаты изучения структуры условно-патогенной микрофлоры молочно-товарных ферм, свиноводческих предприятий и птицефабрик. Исследовали родовой и видовой состав микробиоты в смывах со слизистых оболочек, кожи, шерстного покрова у животных, в смывах с оборудования, кормушек, поилок, ограждений, поверхностей, инвентаря; в образцах подстилки, навоза, воды для поения, кормов, премиксов, воздуха. На молочно-товарных фермах обследовали родильные отделения, телятники, отделения дойного поголовья; на свиноводческих комплексах - отделения супоросных и опоросившихся свиноматок, животных из групп отъема, доращивания, откорма; на птицеводческих предприятиях отбирали пробы подстилки, помёта кур, смывы с клеток, кормушек, поилок, навозной ленты; смывы со слизистых оболочек, перьевого и кожного покрова, из клоаки кур-несушек разных возрастов на птицефабриках яичного направления и цыплят-бройлеров предубойного возраста на птицефабриках мясного направления. Изучено частотное распределение типовых представителей патогенной и условно-патогенной микрофлоры на различных животноводческих объектах. Проведен анализ взаимосвязей структуры условно-патогенного микробиоценоза с профилем предприятия, экологическим состоянием агробиоценоза, отдельными технологическими факторами. Установлена взаимосвязь между степенью техногенной контаминации окружающей среды и количеством P. aeruginosa, S. aureus и других представителей в структуре микрофлоры молочно-товарных ферм. Установлена низкая вариабельность микробиологической картины и высокая однородность показателей скрининга микрофлоры свиноводческих комплексов по сравнению с показателями на МТФ или птицеводческих объектах. «Исследование выполнено за счет гранта Российского научного фонда (проект № 18-16-00040)».
Ключевые слова: условно-патогенная микрофлора, патогенная микрофлора, структура микрофлоры, микробиоценоз, молочно-товарная ферма, свиноводческое предприятие, птицефабрика, техногенное загрязнение, микробиологический скрининг, антибиотикорезистентность, S. aureus, P. aeruginosa, E. faecium.
Сведения об авторах:
Донник Ирина Михайловна, вице-президент Российской академии наук, заведующий кафедрой инфекционной и незаразной патологии ФГБОУ ВО «Уральский государственный агарный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-343-371-33-63; e-mail: ktqrjp7@yandex.ru.
Кривоногова Анна Сергеевна, доктор биологических наук, доцент, ведущий научный сотрудник отдела мониторинга и прогнозирования инфекционных болезней ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр УрО РАН»; 620142, г. Екатеринбург, ул. Белинского, 112 а; тел.: 8-982-6512934; e-mail: tel-89826512934@yandex.ru.
Мусихина Нина Борисовна, ассистент кафедры инфекционной и незаразной патологии ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-905-8092603; e-mail: musikhina83@mail.ru.
Моисеева Ксения Викторовна, ассистент кафедры инфекционной и незаразной патологии ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-953-0475887; e-mail: moiseeva456@yandex.ru.
Гордеев Алексей Александрович, аспирант ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; 8-343-2214110.
Ответственный за переписку с редакцией: Исаева Альбина Геннадьевна, доктор биологических наук, доцент, профессор кафедры инфекционной и незаразной патологии ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-343-2951774; e-mail: isaeva.05@bk.ru.

http://vetkuban.com/num5_201906.html