УДК 619: 616. 993.192
DOI 10.33861/2071-8020-2023-4-42-44
Зубенко А. А., Фетисов Л. Н., Святогорова А. Е., Авагян Э. Н. Северо-Кавказский зональный научноисследовательский
ветеринарный институт - филиал Федерального государственного бюджетного научного учреждения
«Федеральный Ростовский аграрный научный центр», Ростовская область, г. Новочеркасск
Диваева Л. Н. Федеральное государственное автономное образовательное учреждение высшего образования
«Южный федеральный университет», Ростовская область, г. Ростов-на-Дону
Наши исследования направлены на создание противо-инфекционных средств неантибиотической природы, что особенно важно в связи с возрастающей проблемой лекарственной устойчивости микроорганизмов.
Актуальным направлением поиска лекарственных средств является модификация природных соединений, обладающих известной биологической активностью. Алкалоиды и их производные обладают немалым потенциалом трансформации в биологически активные структуры [2, 3]. Значительное число современных лекарственных веществ имеют в своей основе природное происхождение. Среди природных соединений алкалоиды представляют наиболее интересный класс химических веществ.
Алкалоиды ряда в-карболинов представляют собой необычное семейство природных и синтетических индолсодержащих гетероциклических соединений с различной степенью ароматичности [15]. Этот класс алкалоидов имеет плоскую трициклическую пиридоиндольную кольцевую систему и первоначально был выделен из семян Peganum harmala, дикорастущего многолетнего травянистого растения, принадлежащего к семейству Zygophillaceae. Это растение традиционно использовалось для лечения рака желудочно-кишечного тракта и малярии в Центральной Азии, на Ближнем Востоке и в Северной Африке. Почти 64 известных алкалоида в-карболина распространены по меньшей мере в восьми семействах растений. Эти алкалоиды также широко распространены в микроорганизмах [12], насекомых [8], табачном дыме [16], тканях человека, жидкостях организма, морских беспозвоночных (мшанки, гидроиды, мягкие кораллы, губки) [7, 14], морских асцидиях (род Eudistoma). Фрагмент в-карболи-на представляет собой основную структуру, присутствующую в более чем 100 алкалоидах и синтетических каркасах с широким спектром биологических свойств, таких как противовоспалительное [18], снотворное [19], противосудорожное [5], противопара-зитарное [6], противоопухолевое [17, 21], противомикробное [4] и противовирусное [20]. Разнообразие биологических активностей в последнее время сделало эти соединения предметом повышенного интереса.
Важный класс гетероциклических соединений представляют собой 1,2,3,4-тетрагидро-в-карболины, широко представленный в живой природе [20], в том числе некоторыми их простейшими производными, такими, например, как 1-метил- и 6-гидрокси-1-ме-тил-1,2,3,4-тетрагидро-бета-карболины, 1,2,3,4-тетрагидро-3-кар-бокси- и 1,2,3,4-тетрагидро-3-карбокси-1-метил-в-карболины, обнаруженными в некоторых фруктах и шоколаде [9, 10, 13]. 1,2,3,4-тетрагидро-в-карболиновое ядро является частью циклического каркаса ряда алкалоидов, в частности, резерпина, аймалина, а также эвдистоминовых алкалоидов (eudistomins), обнаруженных в некоторых морских организмах [11]. Производные карболина обладают разнообразной биологической активностью, в том числе, как циклические аналоги триптамина.
Цель настоящего исследования синтез и определение уровня антипротозойной и антибактериальной активности в ряду алко-лоида бета-карболина.
Материалы и методы исследований. Синтез новых соединений проводили в лаборатории химического синтеза СКЗНИВИ-филиал ФГБНУ ФРАНЦ и в Научно-исследовательском институте физической и органической химии Южного федерального университета.
Синтез соединений осуществляли с использованием как известных методов синтеза органических соединений, описанных в многочисленных руководствах, так и с применением разработанных нами методов, изложенных в описании к патенту РФ № 2394824 и в статьях и тезисах: Материалы Первой международной конференции «Химия и биологическая активность гетероциклов и алкалоидов» (2002 г.); Материалы международной конференции «Синтез и биологическая активность азотсодержащих гетероциклов» (2006 г.); Тезисы IV международной конференции «Новые направления в химии гетероциклов» (2010 г.).
Антибактериальную активность определяли диско-диффузионным методом. Для исследований использовали мясопептонный агар, который заливали в чашки Петри по 25 мл в каждую. Чашки подсушивали в течение 10-20 минут. На поверхность чашек Петри с питательной средой наносили микропипеткой 1-2 мл взвеси стандартных штаммов Staphylococcus aureus (штамм ВКМ V-128) или Escherichia coli (штамм ВКМ V-820) густотой 5 единиц оптического бактериального стандарта мутности. Распределяли взвесь равномерно по поверхности среды, избыток удаляли. Чашки подсушивали 20-30 минут. Размечали на сектора (3-6). В сектора размещали по 1 диску из картона фильтровального НД-ПМП-1 ГОСТ 6722-75 (Пр-во ФБУН НИИ эпидемиологии и микробиологии имени Пастера, Отдел новых технологий, Санкт-Петербург). На диск наносили микропипеткой 15 микролитров суспензии испытуемого соединения на дистиллированной воде концентрацией 1000 мкг/мл, что составляет 15 мкг препарата на каждый диск. Подготовленные чашки помещали в термостат при 370C на 24 часа. Препараты сравнения - фуразолидон и ципрофлоксацин. Оценивали величину зоны задержки роста бактериальной культуры вокруг диска в мм.
Методика в модификации СКЗНИВИ описана в высокорейтинговом зарубежном журнале Polyhedron.
Исследование протистоцидной активности проводили по методике [1] на простейших вида Colpoda steinii (полевой изолят, коллекция лаборатории паразитологии ФГБНУ СКЗНИВИ). Работу выполняли в микропланшетах для постановки ИФА. В качестве среды для переживания простейших использовали смесь кипяченой водопроводной воды и стерильной дистиллированной воды в равных объемах. Первоначальное разведение вещества готовили на дистиллированной воде в присутствии ДМСО. Препарат сравнения - толтразурил. Результат оценивали по величине минимальной ингибирующей концентрации в мкг/мл. Разработанная нами методика опубликована в журнале Polyhedron.
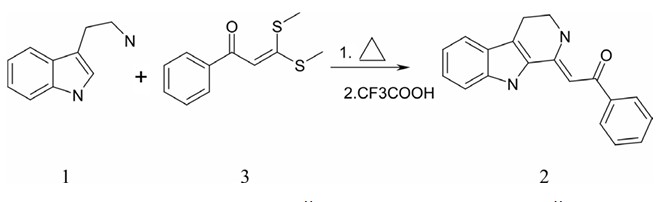
Результаты исследований и их обсуждение. Целью наших исследований являлся двухстадийный синтез (рисунок 1) соединений 2 из триптаминов 1 и винильных серусодержащих соединений 3 и изучение их антипротозойных и антибактериальных свойств. В работе по синтезу 2 нами использована описанная в литературе [6] методика получения соединений 2 с различными заместителями как в карболиновом, так и в арильном заместителе.

Рис. 1. Схема двухстадийного синтеза соединений (2) из триптаминов (1) и винильных серусодержащих соединений (3)
В таблице 1 представлены структуры синтезированных соединений и их антипротозойная (протистоцидная) и антибактериальная активность.
Таблица 1 Результаты определения антипротозойной и антибактериальной активности производных алкалоида бета-карболина
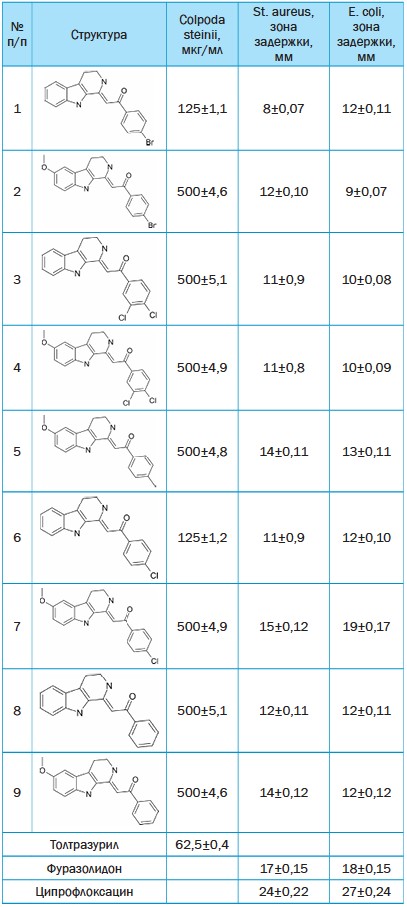
Из данных таблицы 1 видно, что все испытанные структуры обладают антипротозойной активностью, однако всего лишь два соединения (номера 1 и 6) проявляют значительную активность, хотя и в этом случае они в два раза менее активны, чем препарат сравнения толтразурил.
Более значима антибактериальная активность представленных соединений. Все структуры активны как в отношении грам-положительной бактерии St.aureus, так и грамотрицательной E.coli с зонами задержки от 8 до 19 мм, причём соединение 7 практически не уступает по активности фуразолидону, что указывает на перспективность поиска противомикробных средств среди подобных производных алкалоида карболина. Относительно влияния заместителей на величину активности, можно сделать вывод, что соединения с метоксигруппой в карболиновом фрагменте (структуры 2, 4, 5, 7 и 9) заметно активнее, чем 1, 3, 6, 8.
Выводы:
1. Синтезированы 9 производных алкалоида в-карболина.
2. Изучены антибактериальные и протистоцидные активность синтезированных соединений.
3. Соединения более активны в отношении бактериальной микрофлоры.
Список литературы:
1. Изыскание протистоцидных средств / Л. Н. Фетисов, А. А. Зубенко, А. Н. Бодряков [и др.] / Вопросы нормативно-правового регулирования в ветеринарии. 2012. № 4/1. С. 70-72.
2. Новые структурные модификации производных алкалоида котар-нина котарнона и дигидрокотарнина / В. Г. Карцев, А. А. Зубенко, Л. Н. Диваева [и др.] // Журнал общей химии. 2020. Т. 90. № 2. С. 261-267.
3. Юнусов, С. Ю. Алкалоиды / С. Ю. Юнусов // ФАН. 1981. С. 418.
4. An overview on synthetic entries to tetrahydro-p-carbolines / P. Maity et al. // Tetrahedron. 2019.
5. Application of modified Pictet-Spengler reaction for the synthesis of thiazolo- and pyrazolo-quinolines / S. Duggineni et al. // Tetrahedron. 2006. No. 62 (14). Pp. 3228-3241.
6. Application of the Pictet-Spengler reaction to aryl amine substrates linked to deactivated aromatic heterosystems / B. Saha et al. // Tetrahedron. 2008. No. 64 (37).
7. Facile construction of 1,2,6,7,12,12-p-hexahydroindolo[2,3-a] quinolizines via one-pot three-component reactions of tryptamines, propiolate, and a,e-unsaturated aromatic aldehydes or ketones / J. Sun et al. // Tetrahedron. 2013. No. 69 (26). Pp. 5451-5459.
8. Harmicines - harmine and cinnamic acid hybrids as novel antiplasmodial hits / I. Perkovic et al. // Eur. J. Med. Chem. 2020.
9. Herraiz T. // J. Agric. Food. Chem. 2000. Vol. 48(10). P. 4900 doi: 10.1021/jf000508l
10. Herraiz T., Galisteo J. // J. Agric. Food. Chem. 2003 Vol. 51 (24). P. 71561.
11. Piechowska P., Zawirska-Wojtasiak R., Mildner-Szkudlarz S. Nutrients. 2019. Vol. 11 (4). P. 814.
12. Preparation and antiprotozoal evaluation of promising в—carboline alkaloids / A. Gellis et al. // Biomed. Pharmacother. 2012. No. 66 (5). Pp. 339-347.
13. Puerto Galvis C., Kouznetsov V. Studies in Natural Products Chemistry // Elsevier. 2018. Vol. 56. P. 1.
14. Stereoselective preparation of pyridoxal 1,2,3,4-tetrahydro-p-carboline derivatives and the influence of their absolute and relative configuration on the proliferation of the malaria parasite Plasmodium falciparum / R. Brokamp et al. // Bioorg. Med. Chem. 2014. 22 (6). Pp. 1832-1837.
15. Synthesis of 1-indolyl substituted в—carboline natural products and discovery of antimalarial and cytotoxic activities / L. Liew et al. // Tetrahedron. 2014. No. 70 (33). Pp. 4910-4920.
16. Synthesis of в—carboline-fused 1,4-oxazepines and their assessment as antiplasmodial agents / V. Yadav et al. // Tetrahedron. 2017. No. 73 (38). Pp. 5680-5689.
17. Synthesis of fused polycyclic nitrogen-containing heterocycles via cascade cyclization / B. Saha et al. // Tetrahedron Lett. 2006. No. 47 (16). Pp. 2765-2769.
18. Synthesis of tetrahydro-e-carbolines, в-carbolines, and natural products, (±)-harmicine, eudistomin U and canthine by reductive Pictet Spengler cyclization / D. Pakhare et al. // Tetrahedron Lett. 2015.
19. The Carbolines / R. Abramovitch et al. // 1964.
20. The early preclinical and clinical development of cipargamin (KAE609), a novel antimalarial compound / S. Bouwman et al. // Travel MedInf. Disp. 2020.
21. Water as an efficient medium for the synthesis of tetrahydro-в-carbolines via Pictet-Spengler reactions / B. Saha et al. // Tetrahedron Lett. 2007. No. 48 (8). Pp. 1379-1383.
Резюме. Актуальным направлением поиска лекарственных средств является модификация природных соединений, обладающих известной биологической активностью. Алкалоиды и их производные обладают немалым потенциалом трансформации в биологически активные структуры. Значительное число современных лекарственных веществ имеют в своей основе природное происхождение. Среди природных соединений алкалоиды представляют наиболее интересный класс химических веществ. Наши исследования направлены на создание противоинфекционных средств неантибиотической природы, что особенно важно в связи с возрастающей проблемой лекарственной устойчивости микроорганизмов. В условиях ТК «Химического синтеза новых лекарственных соединений» Северо-Кавказского зонального научно-исследовательского ветеринарного института проведены синтезы соединений ряда производных алкалоида бета-карболина. Синтезы осуществляли с помощью известных методов, описанных в руководствах по органической химии и в литературных источниках. Для всех соединений определяли уровень антипротозойной активности на модели инфузорий вида Colpoda steinii и показатели антибактериальной активности в отношении грамположительных бактерий St. aureus и грамотрицательных бактерий E.coli. Было установлено, что среди изученных производных алкалоида активными в отношении простейших оказались все синтезированные соединения, но уровень их активности был незначительным. Напротив, антибактериальная активность соединений оказалась более значимой. Все структуры были активны как в отношении грамположительных бактерий St. aureus, так и грамотрица-тельных E.coli. Уровень активности производных алкалоида бета-карболина в отношении St. aureus составлял 70,5% уровня активности фуразоли-дона и 50% уровня активности ципрофлоксацина; уровень активности в отношении E. coli составлял 66% уровня активности фуразолидона и 44% от уровня активности ципрофлоксацина.
Ключевые слова: синтез производных алкалоида бета-карболина, скрининг антибактериальной и антипротозойной активности, колподы, кишечная палочка, золотистый стафилококк.
Сведения об авторах:
Зубенко Александр Александрович, доктор биологических наук, главный научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-928-6049743; e-mail: alexsandrzubenko@yandex.ru.
Фетисов Леонид Николаевич, кандидат ветеринарных наук, ведущий научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-908-1978224; e-mail: fetisoff.leonid2018@yandex.ru.
Авагян Элен Нверовна, лаборант-исследователь творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-908-1882434, e-mail: elen.avagyan.1999@inbox.ru.
Диваева Людмила Николаевна, кандидат химических наук, ведущий научный сотрудник лаборатории органического синтеза НИИ ФГАОУ ВО «Южный федеральный университет»; 344090, г. Ростов-на-Дону, пр. Стачки, 194/2; тел.: 8-928-1756654; e-mail: divaevaln@mail.ru.
Ответственный за переписку с редакцией: Святогорова Александра Евгеньевна, младший научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-988-9525755; e-mail: sviatogorova.a@yandex.ru.
http://vetkuban.com/num4_202312.html