УДК: 619:616-006.44
DOI 10.33861/2071-8020-2022-4-4-6
Староселов М.А. Федеральное государственное бюджетное научное учреждение
«Краснодарский научный центр по зоотехнии и ветеринарии», г. Краснодар
В последние годы резко изменились условия ведения молочного скотоводства: на фоне интенсификации производства создаются крупные молочно-товарные комплексы, ввозятся из-за рубежа высокопродуктивные животные. Интенсивность нагрузки на организм резко возрастает. В связи с этим все чаще регистрируются болезни продуктивных животных, которые сопровождаются снижением показателей иммунитета. Следует отметить, что причины снижения резистентности могут крыться в нарушении технологии кормления и условий содержания животных [1, 6], а также при специфических причинах [3, 5], и, как следствие, вторичных иммунодефицитов. Многие заболевания (диспепсия, эндометрит, бронхопневмония) развиваются на фоне вирусных и микробных патогенов, которые понижают показатели иммунитета (вирусной диареи-болезни слизистых, герпесвирус, парамиксовирус и другие) [4].
На Кубани, в других регионах Российской Федерации, как и в зарубежных странах с развитым животноводством широко распространены острые вирусные болезни органов дыхания и пищеварения крупного рогатого скота, часто приводящие к вспышкам, наносящим существенный экономический ущерб. Болезни органов дыхания молодняка крупного рогатого скота различного генеза, развиваются, как правило, на фоне развития иммунодефицитных состояний [2].
Для профилактики острых респираторных вирусных инфекций крупного рогатого скота широко применяются вирусные вакцины, как инактивированные, так и аттенуированные. По нашим данным, эффективность иммунопрофилактики ОРВИ крупного рогатого скота редко превышает 70%, независимо от вида вакцины. При изучении напряженности поствакцинального иммунитета при ОРВИ у 20-25% животных выявлен его дефицит.
В свете сказанного выше, значение коррекции иммунитета при терапии и профилактике болезней сельскохозяйственных животных различного генеза, трудно переоценить [8].
С учетом всего изложенного важно постоянно вести поиск новых высокоэффективных иммуномодуляторов, повышающих иммунитет, устойчивость к стрессам, нормализующих обменные процессы, которые совмещали бы в себе доступность и безопасность. Поэтому определение эффективности иммунотропных препаратов при профилактике и терапии болезней органов дыхания крупного рогатого скота - является актуальной проблемой.
Цель исследования - изучить влияние иммуномодуляторов Имак-тин и Иммунофан на иммунобиологические показатели у 3-месячных телят, больных бронхопневмонией.
Материалы и методы исследований. Исследования проводили в лаборатории терапии Краснодарского НИВИ и на ТФ № 2 АО «Кубань» Усть-Лабинского района Краснодарского края.
Комплексный гематологический анализ проведен на автоматизированном анализаторе «Mythic 18 vet» (Швейцария), скорость оседания эритроцитов (далее, СОЭ) - методом Панченкова; количественная оценка лимфоидных элементов - с помощью гематологического электронного цифрового счетчика, согласно методическим рекомендациям по ветеринарной гематологии [7]. Биохимические исследования -на автоматизированном биохимическом анализаторе «Vitalab SelectraJunior».
Бактерицидную активность сыворотки крови - нефелометрическим методом по отношению к референтному штамму E. coli О55 в нашей модификации; лизоцимную активность сыворотки крови - нефелометрическим методом с M. lysodeiticus (ацетоновая культура); фагоцитарную активность нейтрофильных гранулоцитов периферической крови - с тест-культурой St. aureus 209р; оценку функциональной активности микробицидной системы нейтрофильных гранулоцитов - по спонтанному и стимулированному NBT-тесту, стимуляцию проводили тест-культурой St. aureus 209р; количество Т-лимфоцитов - методом спонтанного розеткообразования со стабилизированными эритроцитами барана; количество В-лимфоцитов -розеткообразованием с ЕАС-комплексом с использованием стабилизированных эритроцитов быка, основываясь на «Методических указаниях по тестированию естественной резистентности телят» (1980) и «Методах оценки функциональной активности нейтрофильных гранулоцитов» (1992).
Результаты исследований и их обсуждение. Для проведения исследований на следующем этапе работы на ТФ № 2 АО «Кубань» Усть-Лабинского района из 30 телочек голштинской породы в возрасте трех месяцев, больных острой серозно-катаральной бронхопневмонией, было сформировано 3 группы по 10 голов в каждой. До начала эксперимента у трех животных из каждой группы отобрали кровь для проведения лабораторных исследований.
Животным первой группы, на фоне принятой в хозяйстве схемы терапии вводили Имактин в дозе 0,15 мг/кг массы тела в виде 3% водного раствора, однократно, через 24 часа, трижды. Животным второй опытной группы по аналогичной схеме вводили Иммунофан в дозе 1,0 мл. Животным третьей, контрольной группы иммуностимуляторы не применяли.
Животным первой, второй и контрольной групп проводилась терапия, применяемая в хозяйстве: антибиотик Энрофлоксацин раствор 1 раз в сутки, в дозировке 2,5 мг/1 кг 5 дней подряд; Элео-вит, однократно, в дозировке 5 см3/гол внутримышечно.
Через 10 дней после последнего введения препаратов у всех телят опытных и контрольной групп отбирали кровь из яремной вены для проведения лабораторных исследований.
При изучении гематологических показателей у телят 3-месячного возраста, при применении иммуномодуляторов, установили, что в группе, где применялась терапия с включением в нее иммуномодулятора Имактин, эритроциты увеличились на 28%, тогда как в группе с препаратом Иммунофан увеличились на 12% и составили 9,8*1012/л и 8,7*1012/л, соответственно.
Уровень гемоглобина в группах, где применялись иммуномодуляторы был выше контрольной группы на 17,6% и 19,2%, соответственно, по сравнению с контрольной группой. Было отмечено меньшее количество лейкоцитов в сравнении с контрольной группой, где данный показатель составлял 11,2*109/л - в группе с Иммунофаном -10,0*109/л и с Имактином - 10,5х109/л.
Применение Имактина и Иммунофана нормализуют у больных бронхопневмонией телят количество лейкоцитов и сегметоядерных нейтрофилов, что свидетельствует о снижении воспалительной реакции, недостоверно повышается количество гемоглобина, повышается количество общего белка и нормализуется его фракционный состав; снижается ацидоз (табл. 1, 2).
При исследовании - применении Имактина и Иммунофана у больных телят активизировалось фагоцитарное звено иммунитета, возросло количество Т-лимфоцитов и нормализовались ЦИК.
Таблица 1 Влияние иммуностимулирующих препаратов на показатели крови 3-месячных телят, больных бронхопневмонией (M±m; n=10)
| Показатели | Единицы измерения | ФОН | 1 опытная — Имактин | 2 опытная — Иммунофан | Контроль |
|---|---|---|---|---|---|
| Эритроциты | 1012/л | 7,6±0,1 | 9,89±0,02 | 8,78±0,05 | 7,7±0,02 |
| Гемоглобин | г/л | 108±1,2 | 120,5±0,1 | 121,6±0,07 | 102,4±0,05 |
| Лейкоциты | 109/л | 13,0±5,2 | 10,5±0,1 | 10,05±0,1 | 11,28±0,05 |
| Лейкограмма Эозинофилы | % | 6,1±0,4 | 4,4±0,2 | 5,0±0,26 | 4,9±0,23 |
| Нейтрофилы: Юные | % | 0,6±0,24 | 0,8±0,1 | 0,7±0,2 | 0,8±0,2 |
| палочкоядерные | % | 3,6±0,2 | 3,4±0,4 | 4,5±0,34 | 3,3±0,37 |
| сегментоядерные | % | 34,9±0,9 | 28,9±0,53 | 29,1±0,53 | 33,7±0,4 |
| Лимфоциты | % | 57,1±0,9 | 62,9±0,39 | 64,0±0,45 | 60,4±0,4 |
| Моноциты | % | 3,8±0,2 | 4,0±0,21 | 1,7±0,21 | 1,7±0,25 |
| Общий белок | г/л | 67,0±0,9 | 79,1±0,1 | 78,1±1,8 | 69,1±2,6 |
| Белковые фракции: альбулины | % | 38,4±0,4 | 43,1±1,2 | 40,0±2,8 | 37,8±2,5 |
| а-глобулины | % | 17,3±1,0 | 13,3±0,8 | 16,8±0,7 | 14,1±1,8 |
| в-глобулины | % | 13,8±0,7 | 14,1±1,6 | 12,2±1,2 | 23,5±3,6 |
| Y-глобулины | % | 30,5±0,8 | 29,5±1,6 | 31,0±2,4 | 24,6±1,5 |
| Общий Са | ммоль/л | 2,6±0,2 | 3,31±0,05 | 3,017±0,05 | 3,07±0,05 |
| Неорганический Р | ммоль/л | 2,3±0,05 | 2,32±0,029 | 2,14±0,03 | 1,98±0,02 |
| Резервная щелочность | Об%СО2 | 41,6±112 | 52,55±1,0 | 50,55±2,1 | 48,55±0,9 |
Таблица 2 Влияние иммуностимулирующих препаратов на показатели крови 3-месячных телят, больных бронхопневмонией (M±m; n=10)
| Показатели | Фон | Имактин | Иммунофан | Контроль |
|---|---|---|---|---|
| IgA г/л | 1,28±0,3 | 0,9±0,15 | 1,14±0,24 | 0,04±0,01 |
| IgM г/л | 1,75±0,65 | 1,03±0,13 | 0,86±0,15 | 1,06±0,24 |
| IgG г/л | 17,0±3,7 | 23,05±2,7 | 21,98±3,0 | 17,4±4,32 |
| ЦИК | 76,8±15,1 | 66,6±1,6 | 63,0±3,7 | 68,0±7,2 |
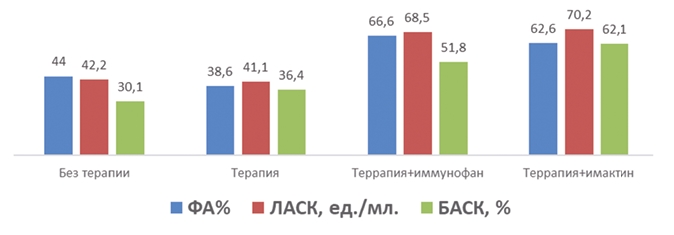
| ФА% | 44,0±1,2 | 62,6±1,3 | 66,6±3,7 | 38,6±0,6 |
| ФЧ, ед | 0,9±0,2 | 1,4±0,1 | 1,3±0,2 | 1,3±0 |
| ЗФ | 0,81±0,1 | 1,1±0,08 | 1,2±0,1 | 1,0±0 |
| Т, % | 58,2±3,1 | 64,0±2,0 | 63,6±2,0 | 56,3±2,3 |
| В, % | 30,2±2,8 | 27,3±0,6 | 30,0±2,0 | 27,6±2,1 |
| Т, 109/л | 2,3±0,2 | 3,9±1,3 | 2,0±0,5 | 2,8±0,3 |
| В, 109/л | 1,19±0,34 | 1,7±0,6 | 0,9±0,2 | 1,2±0,2 |
| Т-л% / В-л% | 1,92±0,1 | 2,3±0,1 | 2,1±0,1 | 2,4±0,2 |
| Фарм. Поз. NBT сп. % | 30,1±2,6 | 33,3±4,6 | 31,3±3,4 | 29±3,7 |
| Фарм. Поз. NBT ст. % | 38,2±3,7 | 42±3 | 40,3±1,8 | 45,6±0,8 |
| СЦИсп. | 0,3±0 | 0,3±0 | 0,3±0 | 0,3±0 |
| СЦИст. | 0,3±0 | 0,4±0 | 0,4±0 | 0,5±0 |
| КМ, ед. | 2,6±0,3 | 0,8±0,1 | 2,1±0,4 | 3,0±0,5 |
| ЛАСК, ед./мл. | 42,2±4,7 | 70,28±4,6 | 68,5±23,0 | 41,1±21,2 |
| БАСК, % | 30,1±21,9 | 62,1±15,4 | 51,8±8,9 | 36,46±5,1 |
Под воздействием иммуностимуляторов в крови повышается количество иммуноглобулина G (рисунок 1), однако, поскольку гуморальный иммунитет не оказывает существенного влияния на развитие болезней органов дыхания, мы провели параллельно исследование влияния иммуностимуляторов на показатели секреторных антител.

Рис. 1. Влияние иммуностимулирующих препаратов на показатели крови 3-месячных телят, больных бронхопневмонией
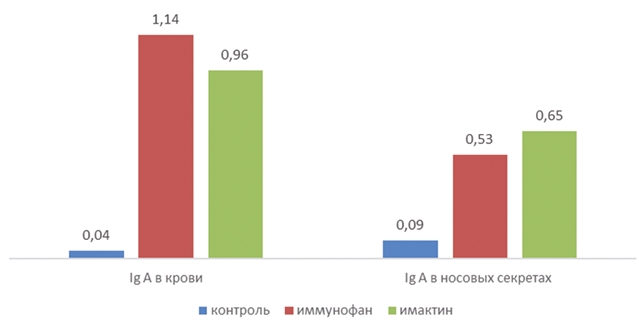
Рис. 2. Влияние иммуномодуляторов на Ig A у телят 3-месячного возраста, больных острой серозно-катаральной бронхопневмонией, г/л
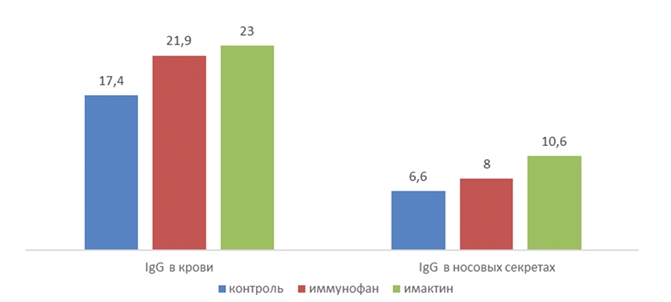
Рис. 3. Влияние иммуномодуляторов на Ig G у телят 3-месячного возраста, больных острой серозно-катаральной бронхопневмонией, г/л
Как видно из данных рисунков 2 и 3, Иммунофан значительно повышает количество IgA в сыворотке крови и носовых секретах: в сыворотке увеличение от 0,04 г/л до 1,14 г/л, что в 28 раз выше, тогда как в носовых секретах это увеличение составило в 5,8 раз от 0,09 г/л до 0,53 г/л. Что касается IgG, то у животных, где применялся Иммунофан по сравнению с контрольной группой, в сыворотке крови увеличение составило 25%, с 17,4 г/л до 21,9 г/л, а в носовых секретах на 21% с 6,6 г/л до 8 г/л.
В сыворотке крови телят опытной группы, в которой применялся Имактин, было отмечено увеличение содержания иммуноглобулинов: IgA до 0,96 г/л (контрольная группа 0,04 г/л) и IgG до 23 г/л, в сравнении с контролем, где этот уровень составлял 17,4 г/л. В носовых секретах телят уровень IgG составил 10,6 г/л, тогда как в контрольной группе данный показатель был на уровне 6,6 г/л. IgA был на уровне 0,65 г/л, что в 7,2 раза выше, чем в контроле. Содержание IgM было без видимых изменений и колебалось в среднем по группам в сыворотке крови от 0,86 г/л до 1,06 г/л; в носовых секретах от 0 до 0,03 г/л.
Заключение. Показатели гуморального звена иммунитета (ли-зоцимная активность сыворотки крови) у больных телят были ниже, чем у здоровых в обеих возрастных группах, соответственно, на 3,5 и 45,5%, а БАСК снижена только у телят старшего возраста на 50%, установлен дефицит звена фагоцитоза, при этом количество иммуноглобулинов в сыворотке крови существенно не изменилось. Поскольку основными показателями, влияющими на развитие респираторной патологии у телят является снижение активности системы фагоцитоза и клеточного звена иммунитета как общего, так и системного, при этом активность гуморального звена существенного влияния на развитие патологии органов дыхания не оказывает, наиболее доступными для нормализации показателей иммунитета, влияющие на развитие и тяжесть течения респираторных болезней у молодняка крупного рогатого скота являются Имактин и Иммунофан. Имактин и Иммунофан при использовании в схеме терапии бронхопневмонии повышают показатели фагоцитоза, снижают воспалительную реакцию и активизируют выработку секреторных антител респираторного тракта.
Список литературы:
1. Бузлама В.С. Экологический фактор// Предложения ученых по профилактике желудочно-кишечных болезней телят до месячного возраста: материалы круглого стола отделения ветеринарной медицины Россельхозакадемии. 2000. С. 25-27.
2. Влияние пребиотика Баскин-вет на микробиоценоз кишечника новорожденных телят/ М.А. Старосёлов, Н.Ю. Басова, А.К. Схатум, Ю.Е. Фёдоров, В.В. Пачина, А.Н. Марков// Российский журнал. Проблемы ветеринарной санитарии, гигиены и экологии. 2016. № 1 (17). С. 72-75.
3. Дементьева М.С., Крысенко Ю.Г., Иванов И.С. Изучение показателей крови телят при применении вакцины «Клостбовак-8» в сочетании с иммуномодулятором// Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2021. Т. 248. № 4. С. 58-61.
4. Иммунобиотехнологический подход к регуляции репродуктивной функции, обмена веществ и продуктивности животных/ В.А. Галочкин, Л.К. Эрнст, Л.И. Триндо и др.// Сельскохозяйственная биология. 1994. № 2. С. 3-19.
5. Инфекционный ринотрахеит крупного рогатого скота/ А.Г. Глотов, А.Ф. Шу-ляк, Т.И. Глотова, А.Н. Сергеев// 2006. 194 с.
6. Повышение устойчивости телят к смешанным вирусно-бактериальным респираторным инфекциям/ П. Сисягин, Е. Сисягина, Г. Реджепова, И. Убити-на// Ветеринария сельскохозяйственных животных. 2015. № 12. С. 23-28.
7. Староселов М.А. Оценка сравнительной эффективности иммунокорректоров для повышения резистентности крупного рогатого скота: дисс. на соиск. уч. степ.канд.вет.наук// КубГАУ. 2008.
8. Федоров Ю.Н. Иммунологический фактор как причина желудочно-кишечных заболеваний у телят// Предложения ученых по профилактике желудочнокишечных болезней телят до месячного возраста: материалы круглого стола отделения ветеринарной медицины Россельхозакадемии. 2000. С. 36-37.
Резюме. Для коррекции иммунитета при профилактике и терапии вирусных инфекций респираторного тракта молодняка крупного рогатого скота применяются иммунокорректоры различных фармакологических групп. При использовании иммунокорректоров следует учитывать состояние системы иммунитета у животных разного возраста: у новорожденных и молодых телят до 2-месячного возраста низкая функциональная активность иммунной системы, защита организма осуществляется по гуморальному звену (колостральный иммунитет) и системе фагоцитоза. В старшем возрасте увеличивается зрелость иммунной системы, для осуществления защиты подключается клеточное звено, животное способно активно реагировать на вирусные и бактериальные антигены. Изучено влияние двух иммунокорректоров, обладающих широким спектром действия -Имактин и Имунофан - на иммунобиологические показатели у телят трехмесячного возраста, больных бронхопневмонией при использовании наряду с традиционной схемой лечения. Препараты у больных бронхопневмонией телят нормализуют количество лейкоцитов и сегментоядерных нейтрофилов, что свидетельствует о снижении воспалительной реакции, недостоверно повышается количество гемоглобина, повышается количество общего белка и нормализуется его фракционный состав; снижается ацидоз. Под воздействием иммуностимуляторов значительно повышается в крови количество иммуноглобулинов класса G и A. Имактин и Иммунофан при использовании в схеме терапии бронхопневмонии повышают показатели фагоцитоза, снижают воспалительную реакцию и активизируют выработку секреторных антител респираторного тракта.
Ключевые слова: крупный рогатый скот, иммунитет, профилактика, гематологическая реакция, иммунология, иммунобиологический показатель, иммунокорректор, Иммунофан, Имактин.
Сведения об авторе: Староселов Михаил Александрович, кандидат ветеринарных наук, заведующий отделом терапии и акушерства ФГБНУ «Научный центр по зоотехнии и ветеринарии»; г. Краснодар, ул. 1-я линия, 1; тел.: 8-953-1122803; e-mail: knivitherapy@gmail.com - ответственный за переписку с редакцией.
http://vetkuban.com/num4_202201.html