УДК 619:615.065:615.281.9:636.028
DOI 10.33861/2071-8020-2020-4-10-12
Востроилова Г.А., Корчагина А.А., Чаплыгина Ю.А., Хохлова Н.А. Федеральное государственное бюджетное
научное учреждение «Всероссийский научно-исследовательский ветеринарный институт патологии,
фармакологии и терапии», г. Воронеж
Введение. Поиск новых противомикробных средств является одной из первостепенных задач современной ветеринарии. Основным ограничением эффективности антимикробных препаратов является способность микроорганизмов формировать резистентность к их действию, что вызвано часто необоснованным их применением в качестве средств профилактики. Поэтому предпочтение отдается разработке комплексных лекарственных средств, обладающих широким спектром действия, терапевтическим потенциалом и минимальным риском возникновения побочных эффектов [8, 14].
В состав исследуемого препарата входит комбинация полусинтети-ческих антибиотиков пенициллиновой группы - амоксициллин и клок-сациллин, сочетанное применение которых обеспечивает синергизм антимикробных свойств и увеличение спектра действия, что снижает формирование резистентности у микроорганизмов и способствует повышению эффективности лечения; в качестве противовоспалительного компонента препарат содержит кортикостероид - преднизолон, который влияет на альтернативную и экссудативную фазы воспаления, препятствует распространению воспалительного процесса в тканях вымени [11].
Для классификации лекарственных препаратов по критериям безопасности для плода на территории Российской Федерации используются данные Американской классификации лекарственных и пищевых препаратов Food and Drug Administration (FDA). Согласно данной классификации все лекарственные средства делятся на пять групп, обозначаемых буквами A, B, C, D, X. Антибиотики в-лактамной группы относят к категории FDA-В, при этом в исследованиях на животных не выявлено увеличения частоты повреждения плода или такие доказательства получены, но доказанной зависимости полученных результатов от применения препарата не выявлено [5, 15]. Полусинтетические пенициллины проникают через плаценту, в амниотической жидкости и эмбриональных и фетальных тканях выявляются в терапевтической концентрации, не оказывая при этом токсического влияния на плод [12].
Преднизолон подавляет продукцию множества факторов, которые являются критическими для запуска и развития воспалительной реакции. Его действие направлено на основные компоненты воспаления: медиаторы, сосудистый и клеточный компоненты. Противовоспалительный эффект неспецифичен и проявляется при любых повреждающих стимулах, что делает его пригодным для воздействия на многочисленные патологические процессы. Преднизолон проникает через плаценту, при этом фетальные концентрации ниже материнских в 810 раз. Через плаценту проникает от 51 до 67% кортизола, который может вызвать развитие недостаточности надпочечников и гипоплазию тимуса плода при применении высоких доз кортикостероидов [1, 4, 16].
Различают прямое и опосредованное действие антибактериальных препаратов на плод. Выделяют следующие виды повреждения плода: тератогенный эффект (развитие аномалий плода), эмбриолетальный эффект (пред- и постимплантационная гибель плода), эмбрио- и фе-тотоксический эффект (морфофункциональные нарушения отдельных клеточных систем эмбриона и плода). Реакция эмбриона и плода на воздействие фармакологических препаратов, в том числе и антибиотиков, определяется скоростью и степенью их трансплацентарного перехода, стадией эмбриогенеза в момент введения препарата, его химической структурой, а также особенностями метаболизма матери, плода и плаценты [13].
В процессе онтогенеза существуют периоды наиболее интенсивного формирования органов, когда отмечается повышенная чувствительность зародыша к повреждающему действию факторов внешней среды. Высокая степень чувствительности зародыша к действию химических веществ является характерным признаком критических периодов развития эмбриона и плода [3].
У белых лабораторных крыс обнаружены два критических периода, во время которых отмечается максимальная смертность в результате действия патогенных факторов, первый критический период относится к 4-му дню беременности и приходится на процесс имплантации, второй - к 9-12-му дню беременности и соответствует процессу плацентации [9]. Поэтому проведение экспериментов по определению эмбриотоксических свойств новых ветеринарных препаратов является неотъемлемым этапом токсикологических исследований. Его задача - установить вероятность развития отдаленных последствий для потомства животных после использования лекарственных средств [2].
Целью исследования явилось определение эмбриотоксических и тератогенных свойств комплексного антибактериального препарата для лечения мастита у коров.
Материалы и методы исследований. Опыт по определению эмбриотоксичности и тератогенности нового комплексного антибактериального препарата проводился на белых крысах породы Wistar. Все манипуляции проводились согласно руководству по доклиническим испытаниям препаратов [7], были рассмотрены и одобрены биоэтической комиссией ФГБНУ «ВНИВИПФиТ», соответствовали ГОСТ 33044-2014, European Convention for the Protection of Vertebrate Animals Used for Experimental and other Scientific Purposes (ETS 123), Strasbourg, 1986 и Директиве 2010/63/EU (2010 г.).
Для проведения эксперимента было отобрано 75 половозрелых самок массой 200-220 г, раннее не участвующих в опытах, и 15 самцов. В клетку к самкам в стадии эструса и проэструса на ночь подсаживали самцов из расчёта один самец на пять самок. Беременность считали наступившей при наличии спермиев во влагалищных мазках (рисунок 1) и начинали отсчет дней беременности. Беременные самки были рандомно распределены по группам. Первая группа (n=20) получала препарат в дозе 250 мг/кг перорально с 1 по 7-й день беременности, вторая группа (n=20) получала препарат с 7 по 19-й день беременности, третья группа служила контролем (n=20) - препарат не применяли и эквиобъемно вводили стерильное растительное масло.

Рис. 1. Сперматозоиды в смыве из влагалища белой крысы
Наступление беременности подтверждали при исследовании влагалищных мазков на 4-5-е и 10-11-е сутки после оплодотворения.
На протяжении эксперимента вели наблюдение за опытными животными, обращали внимание на их поведенческую активность, наличие аппетита, развитие негативных явлений на применение препарата. На 1, 4, 7, 10, 13, 16, и 19 дни проводили индивидуальное взвешивание крыс для определения возможного токсического действия препарата на организм беременного животного.
На 20-й день беременности половина самок из каждой группы была подвергнута эвтаназии гуманным способом. Оставшиеся животные родоразрешались естественным путем.
После вскрытия матки у выведенных из эксперимента крыс устанавливали число живых, мертвых и резорбированных плодов, определяли их вес и краниокаудальный размер (рисунок 2), также учитывали вес плаценты. Часть эмбрионов помещали в формалин и подвергали патоморфологическому исследованию.
Рис. 2. Измерение краниокаудального размера эмбриона
Для анализа внутриутробной смертности у крыс были извлечены репродуктивные органы и оценено эмбритоксическое действие препарата по трём показателям:
![]()
![]()
![]()
где ЖТ - количество желтых тел, ЖП - количество живых плодов, МИ - количество мест имплантации, ПП - количество погибших плодов [6, 10].
После рождения крысят определяли количество живых и мертвых плодов, наличие уродств и аномалий развития. За молодняком наблюдали на протяжении 21 суток - на 1, 7, 14 и 21-й день выполняли контрольные взвешивания животных и проводили оценку степени их физического развития.
Определение степени достоверности различий между контролем и опытом проводили по t-критерию Стьюдента с общепринятым уровнем достоверности Р<0,05.
Результаты исследований и их обсуждение. Ежедневный осмотр подопытных крыс не выявил нарушений течения беременности, родов или изменений в поведении у подопытных крыс.
Динамика изменения массы тела подопытных животных представлена на диаграмме (рисунок 3). Из представленных в диаграмме данных видно, что прирост массы проходил равномерно во всех группах, при этом крысы 1-й группы увеличили вес в среднем на 26,5%, крысы 2-й группы на 22,5%, крысы контрольной группы - 19,9%.
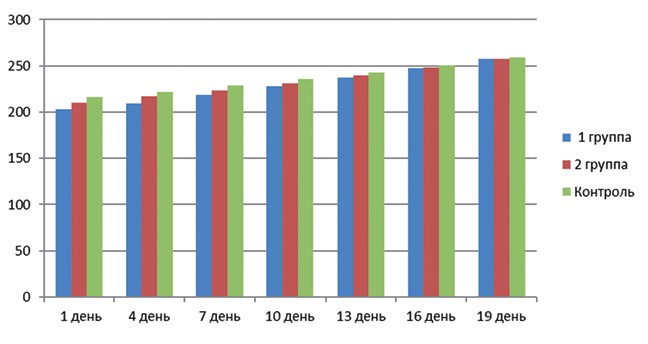
Рис. 3. Динамика изменения массы тела подопытных животных во время беременности
Результаты исследований по определению эмбриотоксического и тератогенного действия нового комплексного антибактериального препарата представлены в таблице 1.
Таблица 1 Результаты исследования эмбрио- и фетотоксичности комплексного антибактериального препарата
| Показатель | 1 группа (n=10) | 2 группа (n=10) | 3 группа (n=10) |
|---|---|---|---|
| Количество живых плодов, голов | 10,56±0,377 | 10,90±0,180 | 10,90±0,233 |
| Количество погибших плодов, голов | 0,90±0,233 | 1,20±0,133 | 1,20±0,133 |
| Количество желтых тел, шт | 13,30±0,300 | 13,30±0,213 | 13,60±0,267 |
| Количество мест имплантации, шт | 11,40±0,452 | 12,10±0,233 | 12,10±0,314 |
| Масса плода, г | 3,71±0,056 | 3,91±0,111 | 3,70±0,032 |
| Масса плаценты, г | 0,54±0,022 | 0,51±0,049 | 0,50±0,004 |
| Размер плода, см | 4,60±0,031 | 4,77±0,107 | 4,68±0,031 |
| Предимплантационная гибель, % | 14,40±2,438 | 10,50±1,194 | 11,05±1,236 |
| Постимплантационная гибель, % | 7,49±1,901 | 9,82±0,939 | 9,79±0,860 |
| Общая эмбриональная смертность, % | 21,12±1,501 | 17,93±1,492 | 19,82±1,007 |
В результате подсчета количества плодов, желтых тел, сравнения масс плодов и плацент, а также размеров плодов не было выявлено статистически значимых отклонений в показателях опытных групп относительно контроля, следовательно, препарат не оказывал негативного эффекта при применении в исследуемой дозе.
При визуальном осмотре плодов аномалий развития не выявлено ни в одной из групп.
При патоморфологическом исследовании установлено, что в опытных группах в структуре внутренних органов изменения отсутствовали; развитие плодов соответствовало сроку гестации. Это указывает на отсутствие эмбриотоксического и тератогенного эффекта препарата.
При естественном родоразрешении количество живых и мертворожденных крысят на самку во всех группах значительно не отличалось. У всех крысят, за которыми проводилось наблюдение, аномалий и уродств после рождения отмечено не было. Статистически значимых различий в физиологическом развитии (отлипание ушей, открытие глаз, прорезывание резцов, появление первичного волосяного покрова) как в опытных, так и в контрольной группах не наблюдалось (табл. 2).
Таблица 2 Оценка развития потомства крыс в постнатальный период
| Показатель | 1 группа | 2 группа | 3 группа |
|---|---|---|---|
| Количество живых крысят на самку, голов | 7,3±0,949 | 7,4±1,174 | 7,5±0,85 |
| Количество мертворожденных крысят на самку, голов | 0,1± 0,316 | 0,1±0,316 | 0,2±0,422 |
| Отлипание ушной раковины, сутки | 1,99± 0,207 | 1,97±0,285 | 2,01±0,202 |
| Появление первичного волосяного покрова, сутки | 4,99± 0,271 | 5,01±0,267 | 4,94±0,287 |
| Прорезывание резцов, сутки | 8,0±0,246 | 7,99±0,271 | 8,0±0,297 |
| Открытие глаз, сутки | 15,97 ± 0,347 | 15,97±0,382 | 15,99±0,271 |
Увеличение массы тела крысят в опытных группах было равномерным и статистически не отличалось от группы контроля (рисунок 4).
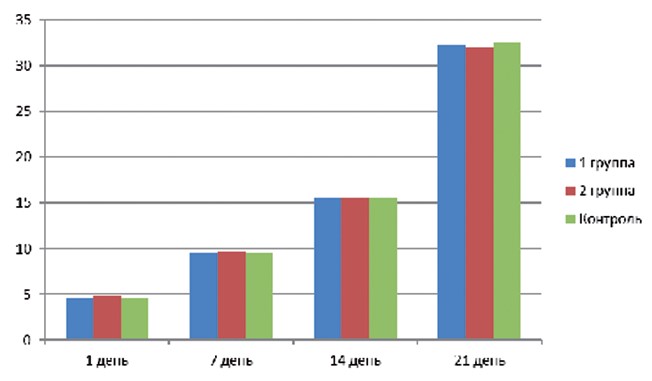
Рис. 4. Динамика прироста массы тела подопытных крысят
Выводы. Эксперимент по выявлению эмбриотоксических и тератогенных свойств комплексного антибактериального препарата для лечения мастита у лактирующих коров показал, что его введение в критические периоды беременности лабораторным крысам не оказывает отрицательного влияния на эмбриональное развитие и ранний постнатальный период жизни крысят. На основании этого можно сделать вывод, что данный препарат в изученной дозировке не обладает эмбриотоксическим и тератогенным действием.
Список литературы:
Резюме. Цель исследования заключалась в оценке влияния нового комплексного антибактериального препарата для лечения мастита у лактирующих коров на белых лабораторных крыс в период эмбрионального и раннего постнатального развития. Установлено, что препарат в изученной дозировке 250 мг/кг при применении с 1 по 7-й и с 7 по 19-й дни беременности не вызывал нежелательных реакций у белых крыс, а также не влиял на формирование и развитие плодов. Прирост массы тела беременных самок проходил равномерно во всех группах. При этом количество плодов, желтых тел, массы плодов и плацент, размеры плодов не имели статистически значимых различий в опытных группах относительно контроля. Анализ показателей внутриутробной смертности так же не выявил статистически значимых различий в группах. При макроскопическом осмотре плодов аномалий развития не выявлено ни в одной из групп. При патоморфологическом исследовании установлено, что изменения в структуре внутренних органов отсутствовали; развитие плодов соответствовало сроку гестации. Количество живых и мертворожденных детёнышей на самку во всех группах существенно не отличалось. У всех крысят аномалий и уродств после рождения отмечено не было. Увеличение массы тела потомства в опытных группах было равномерным. Статистически значимых различий в физиологическом развитии, как в опытных, так и в контрольной группах не наблюдалось. Таким образом, применение лабораторным крысам исследуемого препарата в критические периоды беременности не вызвало негативных эффектов в эмбриональном и раннем постнатальном периоде жизни потомства. На основании этого авторами сделан вывод, что данный препарат в изученной дозировке не обладает эмбрио-токсическим и тератогенным действием.
Ключевые слова: эмбриотоксичность, тератогенность, белые крысы, амоксициллин, клоксациллин, преднизолон, комплексный препарат, желтое тело, эмбрион, масса тела.
Сведения об авторах:
Востроилова Галина Анатольевна, доктор биологичеких наук, главный научный сотрудник отдела экспериментальной фармакологии Федерального государственного бюджетного научного учреждения «Всероссийский научно-исследовательский ветеринарный институт патологии, фармакологии и терапии»; 394087, г. Воронеж, ул. Ломоносова, 114-б; тел.: 8-906-6781203; e-mail: gvostroilova@mail.ru.
Корчагина Анастасия Андреевна, аспирант отдела экспериментальной фармакологии Федерального государственного бюджетного научного учреждения «Всероссийский научно-исследовательский ветеринарный институт патологии, фармакологии и терапии»; 394087, г. Воронеж, ул. Ломоносова, 114-б; тел.: 8-952-1092661; e-mail: a.a.korch@mail.ru.
Чаплыгина Юлия Алексеевна, младший научный сотрудник отдела экспериментальной фармакологии Федерального государственного бюджетного научного учреждения «Всероссийский научно-исследовательский ветеринарный институт патологии, фармакологии и терапии»; 394087, г. Воронеж, ул. Ломоносова, 114-б; тел.: 8-951-5553510; e-mail: kantorovich.yuliya@mail.ru.
Ответственный за переписку с редакцией: Хохлова Нина Алексеевна, научный сотрудник отдела экспериментальной фармакологии Федерального государственного бюджетного научного учреждения «Всероссийский научно-исследовательский ветеринарный институт патологии, фармакологии и терапии»; 394087, г. Воронеж, ул. Ломоносова, 114-б; тел.: 8-908-1376923; e-mail: nina_xoxlova@mail.ru.
http://vetkuban.com/num4_202003.html