УДК: [636.7:616.72-018.3-007.245:616.728.3-089.8:611]-092.9
Степанов М.А., Ступина Т.А. ФГБУ «Российский научный центр «Восстановительная травматология и
ортопедия» им. акад. Г.А. Илизарова» Минздрава России, г. Курган
Введение. Остеоартроз у человека и разных видов животных описывается как характерный комплекс клинических признаков (боль, ограничение движений) и патологических изменений тканей сустава (деструкция хряща, синовит, изменения субхондральной кости и суставной капсулы) [9]. Изучая современную значимость проблемы остеоартрозов, можно сделать вывод о большом распространении этой патологии среди собак и ее актуальности в практике ветеринарного врача. Большинство авторов наиболее часто отмечают появление первых признаков патологии уже в возрасте от 10 месяцев [2].
Экспериментальные модели были и остаются одним из важных инструментов исследования патогенеза и разработки технологий лечения многих заболеваний. В настоящее время для лечения остеоартроза широко применяют модифицированные методики субхондральной туннелизации [8, 11]. В условиях субхондральной туннелизации биохимическое окружение - биологически активные вещества, образующиеся при некротизации костной стружки, белковые биорегуляторы костного мозга; биофизические факторы - уровень содержания кислорода, давление, могут иметь существенное влияние на пролиферацию, остео- и хондрогенную дифференцировку клеток [3, 8,10].
Цель - апробация методики внесуставной субхондральной туннелизации коленного сустава собак с индуцированным остеоартрозом.
Материал и методы исследования. Исследование выполнялось на 22 беспородных собаках, которым моделировали остеоартроз (ОА) [4, 5]. Через 28 суток после окончания иммобилизации 5 животных выводили из опыта (серия 1). В серии 2 (n=9) после окончания иммобилизации проводили внесуставное туннелирование субхондральной зоны. Через 1, 3, 6 и 12 месяцев после туннелирования животных выводили из опыта. В серии 3 (n=8) туннелизацию не выполняли, собак выводили из опыта в сроки, соответствующие срокам экспериментов серии 2. Содержание животных и оперативные вмешательства проводили в соответствии с требованиями Министерства здравоохранения Российской Федерации к работе экспериментально-биологических клиник (приказ МЗ СССР №755 от 1977 г.) и принципами Европейской конвенции (г. Страсбург, 1986). Манипуляции, проводимые на животных, рассмотрены и одобрены этическим комитетом «РНЦ «ВТО» им. академика Г.А. Илизарова».
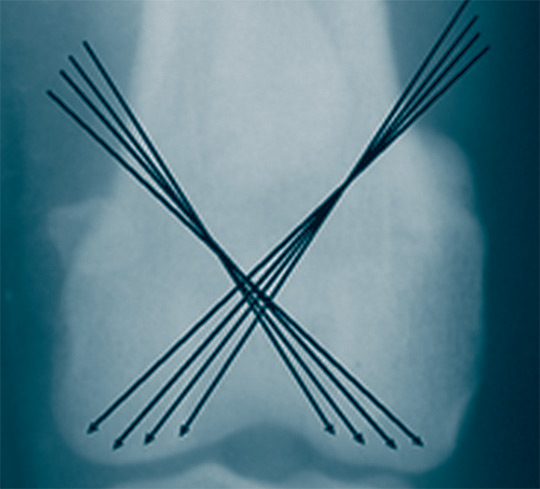
Методика проведения внесуставной субхондральной туннелизации. Внесуставное туннелирование осуществляли в условиях операционной под внутривенным наркозом тиопентала-натрия в дозе 15 мг/кг массы животного. Для туннелирования применяли электродрель и инъекционную иглу диаметром 0,8 мм типа «Рекорд» с металлической канюлей. Туннелирование медиальных мыщелков производили с латеральной стороны конечности, и наоборот латеральных - с медиальной. Вкол иглы в мягкие ткани до кости осуществляли под углом от 30 до 60° на уровне верхнего края надколенника по направлению к суставным поверхностям не проникая в полость сустава. В каждом мыщелке делали по 4 тоннеля (рисунок 1).

Рис. 1. Схема туннелирования мыщелков бедренной кости
Для рентгенологического исследования применяли рентген-аппарат фирмы TOSHIBA E-7239X (Япония). Для гистоморфометричес- кого исследования применяли полутонкие эпоксидные срезы суставного хряща с подлежащей субхондральной костью большой площади (до 8 мм2) [7], которые окрашивали метиленовым синим-основным фуксином, с последующим их сравнительным морфометрическим изучением. Изображения микропрепаратов оцифровывали на АПК «ДиаМорф» (Россия, г. Москва) и анализировали в программе «Видео Тест-Мастер-Морфология» (Россия, г. Санкт-Петербург). Определяли толщину суставного хряща (h, мкм), объемную плотность хондроцитов ^хц, в %) в ткани, численную плотность хондроцитов (ЫАхц, мкм-2) и долю (%) пустых лакун (NAпуст лак) и изогенных групп (NAиз. гр) в общем объёме выборки. В качестве контроля морфометрировали суставной хрящ интактных животных (n=5). Цифровой материал анализировали по критериям вариационной и непараметрической статистик в программе AtteStat, версия 1.0 [1] в электронных таблицах Microsoft Excel 97.
Результаты исследований и их обсуждение. Оперативные вмешательства, осуществляемые на животных, носили малотравматичный характер, о чем свидетельствовал легкий послеоперационный период. Иммобилизация коленных суставов в течение 28 суток вызывала временную контрактуру, которая разрабатывалась через 14 суток после снятия аппарата. Внесуставная субхондральная туннели- зация не вызывала изменений в общем состоянии животных.
Рентгенологически при моделировании ОА по сравнению с ин- тактным суставом наблюдалось сужение суставной щели, остеопороз метафизов бедренной и большеберцовой костей, очаговый остеосклероз субхондральной зоны, контуры суставных поверхностей имели неоднородный рисунок с участками пониженной и повышенной плотности напоминающие перфорацию (рисунок 2).
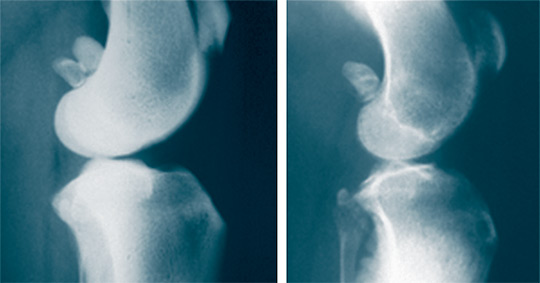
Рис. 2. Рентгенограммы коленного сустава, боковая проекция: а – до моделирования остеоартроза; б – после моделирования остеоартроза
Через месяц после моделирования ОА у животных серий 2 и 3 признаки остеопороза отсутствовали, но структура костной ткани оптически была плотнее в серии 2 (рисунок 3). В серии 3, в некоторых случаях, прослеживался локальный остеосклероз субхондральной зоны (рисунок 3 б).
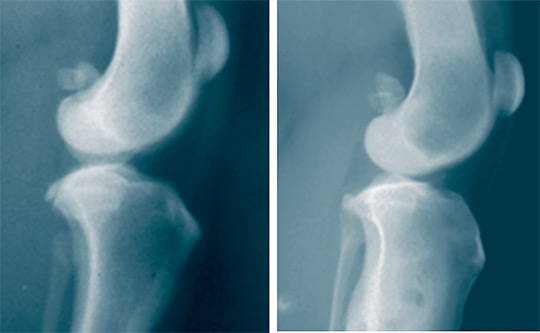
Рис. 3. Рентгенограммы коленных суставов в боковой проекции через месяц после моделирования остеоартроза: а – серия 2; б – серия 3
Через 3 месяца после моделирования ОА рентгенологически структура костной ткани и суставных поверхностей коленного сустава у собак серий 2 и 3 была однородной без видимых признаков деструктивных процессов. В серии 2 сохранялась повышенная оптическая плотность костной ткани (рисунок 4).
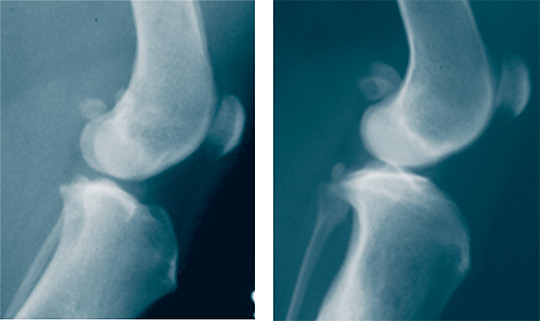
Рис. 4. Рентгенограммы коленных суставов в боковой проекции через 3 месяца после моделирования остеоартроза: а – серия 2; б – серия 3
Через 6 месяцев после моделирования ОА рентгенологически у собак серии 2 признаки остеоартроза не выявлены, контуры мыщелков четкие, структура костной ткани однородная (рисунок 5 а). В серии 3 рентгенологически в боковой проекции выявлен экзостоз на верхнем крае надколенника размером 1 мм, что свидетельствовало о формировании артроза (рисунок 5 б).
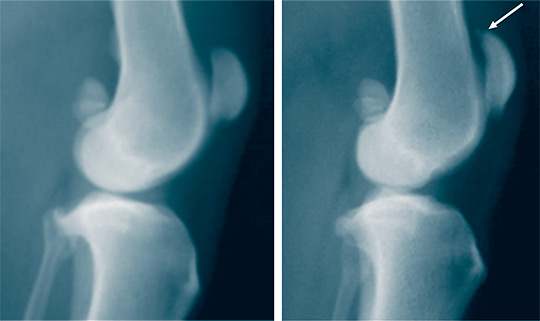
Рис. 5. Рентгенограммы коленных суставов в боковой проекции через 6 месяцев после моделирования остеоартроза: а – серия 2; б – серия 3
Через 1 год после моделирования ОА в серии 2 мыщелки бедренной кости имели однородную структуру, линия субхондральной зоны была четкая. В серии 3 в мыщелках бедренной кости просматривались локальные участки пониженной оптической плотности, линия субхондральной зоны имела нечеткие края (рисунок 6).
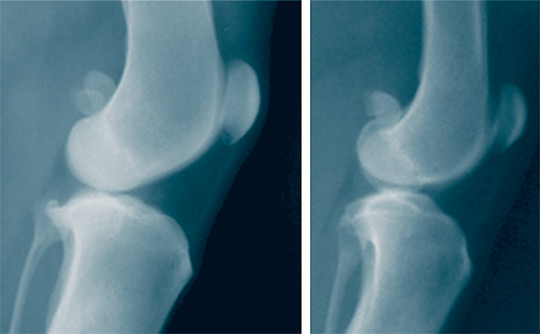
Рис. 6. Рентгенограммы коленных суставов в боковой проекции через 1 год после моделирования остеоартроза: а – серия 2; б – серия 3
При гистоморфометрическом исследовании при моделировании ОА (серия 1) в суставном хряще обнаружены очаги разволокне- ния в поверхностной зоне, основная часть хондроцитов этой зоны в состоянии лизиса, нарушена целостность базофильной линии, отмечены высокие значения доли пустых лакун и изогенных групп, численная и объемная плотность хондроцитов и толщина хряща достоверно ниже контроля (табл. 1).
Таблица 1. Количественные характеристики суставного хряща мыщелков бедра
| Параметры | h (мкм, M±m) | NA хц (M±m) | NA пуст лак (%) | NA^ гр (%) | VV хц (%,M±m) | |
| Контроль | 475,5±1,3 | 6,2±0,56 | 13,6 | 14,5 | 9,03±0,46 | |
| Серия 1 | 318,6±2,7 | 5,3±0,3 | 43,39 | 23,8 | 4,62±0,36 | |
| 1 месяц | Серия 2 | 366,17±2,52! | 7,31±0,52! | 23,6 | 13,3 | 5,77±0,33! |
| Серия 3 | 510,9±1,8*! | 6,4±0,62*! | 35,7 | 16,1 | 5,41±0,38! | |
| 3 | Серия 2 | 410,48±9,35! | 6,51±0,42! | 22,3 | 12,3 | 6,64±0,27! |
| месяца | Серия 3 | 326,6±6,3* | 8,6±0,6*! | 40,3 | 8,9 | 6,19±0,35*! |
| 6 | Серия 2 | 412,59±4,78! | 7,67±0,55! | 22,1 | 7,43 | 5,93±0,39! |
| месяцев | Серия 3 | 375,78±8,24*! | 10,97±0,95*! | 26,2 | 35,5 | 4,74±0,27* |
| 12 | Серия 2 | 423,86±0,09! | 8,22±0,75! | 16,14 | 15,1 | 6,96±0,99! |
| месяцев | Серия 3 | 306,86±0,99* | 8,75±1,36! | 27,08 | 4,8 | 4,77±0,41* |
Примечание: жирным шрифтом выделены достоверные отличия серии 1 с контролем, ! – между 1 серией с сериями 2 и 3, * – между сериями 2 и 3.
В туннелированных суставах (серия 2) через 1 месяц после моделирования ОА в суставном хряще разволокнена лишь суперфици- альная часть поверхностной зоны, целостность базофильной линии не нарушена. Как и в серии 1 в поверхностной зоне часть хондроцитов находилась в состоянии лизиса, отмечены пустые лакуны (рисунок 7 а). В промежуточной и глубокой зонах преобладали функционально активные хондроциты, такие клетки увеличены в размерах, имели светлые гомогенные ядра, базофильную цтоплазму. Значения параметров численной, объемной плотности хондроцитов и толщины хряща достоверно превышали таковые в серии 1, но не достигали значений контроля. По сравнению с серией 1 отмечено снижение доли пустых лакун и изогенных групп в общем объеме выборки.
Через 3 и 6 месяцев после моделирования ОА в суставном хряще сохранялось нарушение гомогенности межклеточного вещества верхней суперфициальной части поверхностной зоны, хондроциты этой зоны округлой формы, увеличены в размерах, без признаков деструкции (рисунок 7 б, в). Выявлено достоверное увеличение толщины хряща относительно серии 1.
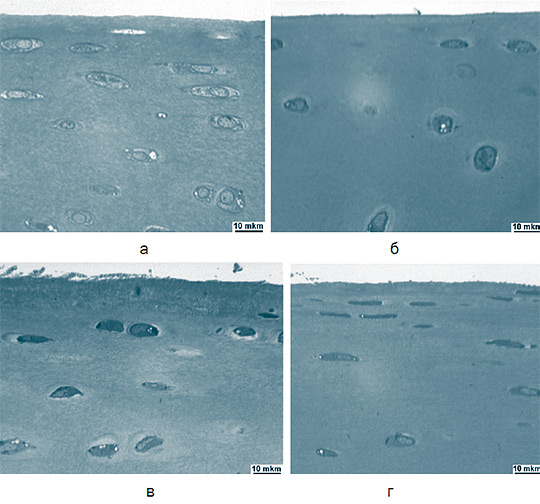
Рис. 7. Суставной хрящ мыщелков бедра. Серия 2. Полутонкие срезы, окраска метиленовым синим и основным фуксином. Об. – 40; ок. – 12,5×. Через 1 месяц (а), 3 месяца (б), 6 месяцев (в) и 12 месяцев (г) после моделирования остеоартроза.
Изогенные группы встречались редко. Относительно предыдущего срока эксперимента в срок 3 месяца после моделирования ОА численная плотность была снижена, но за счет увеличения размеров хондроцитов их объемная плотность увеличивалась. Через 6 месяцев после моделирования ОА незначительное снижение объемной плотности относительно предыдущего срока обусловлено достоверным увеличением толщины хряща. Почти в 2 раза по сравнению с серией 1 снижена доля пустых лакун в общем объеме выборки.
Через 1 год после моделирования ОА репаративные процессы преобладали над деструктивными, межклеточное вещество поверхностной зоны было гомогенным, очаги разволокнения не выявлены (рисунок 7 г), целостность базофильной линии не нарушена. Морфометрически отмечено увеличение объемной плотности хондроцитов по сравнению с предыдущим сроком эксперимента и с серией 1. Увеличение данного параметра было обусловлено как увеличением численной плотности клеток, так и увеличением размеров хондроци- тов. По сравнению с серией 1 существенно снижены значения доли пустых лакун, увеличена доля изогенных групп клеток. Толщина хряща продолжала увеличиваться и достоверно превышала значения серии 1.
В нетуннелированных суставах (серия 3) на всех срока эксперимента в суставном хряще выявлены деструктивные изменения, наблюдалось разволокнение межклеточного вещества со снижением интенсивности его окраски, большая часть хондроцитов находилась в состоянии деструкции (рисунок 8 а, б, в, г). В промежуточной зоне выявлены бесклеточные поля, в глубокой зоне отсутствовало колончатое расположение клеток. В срок 1 месяц после моделирования ОА выявлено достоверное увеличение толщины хряща за счет разволокнения и набухания основного вещества поверхностной зоны. Выраженность признаков регенерации была незначительной, с увеличением срока эксперимента деструктивные изменения прогрессировали. В отдаленный срок эксперимента - через 12 месяцев после моделирования ОА отмечено нарушение цитоархитектоники, демаскировка коллагеновых волокон (рисунок 8 г), нарушение целостности базофильной линии, проникновение сосудов в хрящ.
На всех сроках эксперимента относительно серии 2 снижены параметры - толщина хряща, объемная плотность хондроцитов. Увеличение доли пустых лакун на фоне подавленной пролиферации свидетельствовало о срыве компенсаторных возможностей хряща. Закономерным выглядело достоверное (p<0,001) снижение толщины хряща (табл. 1).
Таким образом, выбранная модель воспроизводит основные рентгенологические признаки остеоартроза; сужение суставной щели, остеопороз дистального метафиза бедренной кости, очаговый остео- 26 склероз субхондральной зоны. Туннелизация субхондральной зоны вызывает более ранние рентгенологические признаки восстановления плотности костной ткани мыщелков бедренной кости. Выявленные гистологические изменения суставного хряща при индуцированном в эксперименте ОА соответствовали начальным стадиям ОА - степень 1-3 по гистологической классификации Международного общества изучения остеоартроза OARSI, 2006 [12]. В проведенных нами ранее исследованиях [4, 6] показано, что при данном патологическом процессе собственные регенераторные возможности суставного хряща подавлены, и его восстановление невозможно без дальнейшего потенцирования внешних по отношению к хрящу механизмов.

Рис. 8. Суставной хрящ мыщелков бедра. Серия 3. Полутонкие срезы, окраска метиленовым синим и основным фуксином. Об. – 40; ок. – 12,5×. Через 1 месяц (а), 3 месяца (б), 6 месяцев (в) и 12 месяцев (г) после моделирования ОА.
Особенностью методики внесуставной субхондральной тунне- лизации является ее малотравматичность, сустав не вскрывается, не нарушается синовиальная среда сустава. В туннелированных суставах гистологически выявлены отчетливые признаки торможения разрушения суставного хряща. Массовая гибель хондроцитов и деструкция матрикса компенсировались быстрой репопуляцией клеточного состава и активизацией синтеза компонентов межклеточного матрикса, в результате увеличивались количество и размеры хондроцитов, нормализовалась структура матрикса, восстанавливалась толщина хряща. Рентгенологический и гистоморфометрический методы оценки позволили установить, что внесуставная субхондральная туннелизация оказывает стимулирующее действие на репаративную регенерацию хрящевой ткани, тем самым замедляет разрушение хрящевой ткани суставов.
В нетуннелированных суставах с увеличением срока эксперимента отмечен нарастающий артроз. Выраженность признаков регенерации суставного хряща была незначительной, с увеличением срока эксперимента деструктивные изменения прогрессировали.
Заключение. На основании полученных результатов, методику внесуставной субхондральной туннелизации можно рассматривать как перспективную в плане стимуляции репаративной регенерации хряща. Проведенное исследование подтвердило эффективность применения данной технологии в лечении остеоартроза.
Список литературы.
Резюме. В эксперименте проведена апробация методики внесуставной субхондральной туннелизации коленного сустава собак с индуцированным остеоартрозом. Исследование выполнялось на 22 беспородных собаках, которым путем иммобилизации обоих коленных суставов с пересечением бедренной артерии моделировали остеоартроз. Через 28 суток после окончания иммобилизации 5 животных выводили из опыта (серия 1). В серии 2 (n=9) после окончания иммобилизации проводили туннелирование субхондральной зоны. Через 1, 3, 6 и 12 месяцев после туннелирования животных выводили из опыта. В серии 3 (n=8) туннелизацию не выполняли, собак выводили из опыта в сроки, соответствующие срокам экспериментов серии 2. Эффективность методики внесус- тавной субхондральной туннелизации оценивали с помощью рентгенологического и гистоморфометрического исследования. Установлено, что внесуставная туннелизация субхондральной зоны вызывает более ранние рентгенологические признаки восстановления плотности костной ткани мыщелков бедренной кости и оказывает стимулирующее действие на репаративную регенерацию суставного хряща. В серии 2 выявлены отчетливые признаки торможения разрушения суставного хряща, по сравнению с серией 1 отмечено увеличение объемной плотности хондроцитов, существенно снижены значения доли пустых лакун, увеличена доля изогенных групп клеток, толщина хряща увеличивалась и достоверно (р<0,001) превышала значения серии 1. В серии 3 на всех срока эксперимента в суставном хряще выявлены деструктивные изменения, относительно серии 2 снижены параметры - толщина хряща, объемная плотность хон- дроцитов, увеличение доли пустых лакун на фоне подавленной пролиферации свидетельствовало о срыве компенсаторных возможностей хряща. Закономерным выглядело снижение (p<0,001) толщины хряща. Выявлено стимулирующее действие внесуставной субхондральной туннелизации на репаративную регенерацию хрящевой ткани. Проведенное исследование подтвердило эффективность применения данной методики в лечении остеоартроза.
Ключевые слова: собака, остеоартроз, суставной хрящ, субхондральная кость, туннелизация, гистоморфометрия, хондроцит, пролиферация, репаратив- ная регенерация.
Сведения об авторах
Степанов Михаил Александрович, кандидат ветеринарных наук, ведущий научный сотрудник лаборатории гнойной остеологии и замещения дефектов ФГБУ «Российский научный центр «Восстановительная травматология и ортопедия» им. акад. ГА. Илизарова» Минздрава России; 640014, г. Курган, ул. М. Ульяновой, 6; тел.: 8-3522-415227; е-mail: m-stepanov@mail.ru.
Ответственный за переписку с редакцией: Ступина Татьяна Анатольевна, доктор биологических наук, старший научный сотрудник лаборатории морфологии ФГБУ «Российский научный центр «Восстановительная травматология и ортопедия» им. акад. Г.А. Илизарова» Минздрава России; 640014, г. Курган, ул. М. Ульяновой, 6; тел.: 8-3522-415227; e-mail: stupinasta@mail.ru.
http://vetkuban.com/num4_201708.html