
Гулюкин М.И., Козырева Н.Г., Иванова Л.А. ГНУВИЭВ
Генджиева О.Б. Калмыцкий госуниверситет
Лейкоз крупного рогатого скота - хроническая инфекционная болезнь вирусной этиологии, занимающая в России первое место в структуре инфекционной патологии животных этого вида. Этиологическим агентом болезни является вирус лейкоза крупного рогатого скота (ВЛКРС или BLV. bovine leukemia virus), относящийся к семейству Retroviridae, роду Delta retrovirus [2. 5. 6. 12]. Отличительной чертой всех ретровирусов является наличие в их составе фермента РНК-зависимой ДНК-полимеразы. осуществляющей важный этап жизненного цикла - синтез ДНК на матрице РНК [10]. Затем ДНК-копия вирусного генома встраивается в геном клетки хозяина и остаётся в нём пожизненно.
В настоящее время учеными во всем мире исследуется генетическое разнообразие ВЛКРС. Наиболее интенсивно проводятся исследования по гену env ВЛКРС. Кодируемые им белки - наружный гликопротеид gp51 и трансмембранный gp30 - отвечают за слияние, проникновение вируса в клетку и вызывают мощный иммунный ответ организма хозяина. В последнее время согласно предложенной классификации ВЛКРС Rodriguez S.M. et al.. 2009 [13] по гену env выделено 7 генотипов вируса. Зарубежными учеными также исследуется влияние того или иного генотипа ВЛКРС на проявление иммунного ответа организма хозяина [7. 9. 12].
ВЛКРС формирует отдельную филогенетическую ветвь внутри семейства ретровирусов. Внутри подгруппы ВЛКРС расхождение в нуклеотидных последовательностях составляет менее 6% для генов pol и env, что свидетельствует о высокой степени консерватизма штаммов вируса из различных географических регионов мира. Несмотря на то, что причины консерватизма неизвестны, такая стабильность генома может быть результатом высокой точности прохождения процесса обратной транскрипции или строгого ограничения условий репликации [3, 14]. Филогенетический анализ разных штаммов ВЛКРС на основе нуклеотидных последовательностей гена pol. показывает, что различие между ВЛКРС и Т-лимфотропным вирусом приматов (PTLV) по нуклеотидной последовательности составляет 42% [8. 11].
В научных целях, определение первичной структуры вируса лейкоза из разных регионов Российской Федерации позволит оценить генетическое разнообразие циркулирующих вирусов, установить их филогенетическое родство и проследить эволюцию. Выявление того или иного генотипа ВЛКРС может играть определенно важную роль в исследовании этапов лейкомогенеза. В спорных случаях, связанных с импортом племенного скота, определение нуклеотидной последовательности ВЛКРС может помочь в выяснении источника инфицирования животных.
Цель исследований - изучение полиморфизма изолятов вируса лейкоза крупного рогатого скота, циркулирующих в некоторых хозяйствах Городовиковского района Республики Калмыкия методом секвенирования. и проведение филогенетического анализа на основе гена pol ВЛКРС.
Методика. Использовали 30 образцов провирусной ДНК. выделенных из цельной крови коров калмыцкой породы из хозяйств Городовиковс-кого района Республики Калмыкия в возрасте старше 5 лет.
На начальном этапе пробы крови исследовали в РИД и ПЦР. Экстракцию ДНК из 100 мкл цельной крови проводили методом преципитации НК спиртом с помощью наборов реагентов отечественного производства по инструкции производителя. Элюировали ДНК в 50 мкл ТЕ-буфера. Для амплификации и секвенирования участка гена pol ВЛКРС использовали разработанные праймеры PF2/PR2.
ПЦР проводили на матрице ДНК ВЛКРС в программируемом термо-циклере "Терцик" в конечном объеме 25 мкл. Реакционная смесь содержала 5 мкл ДНК пробы. 5 мкл буфера ПЦР. ЗмМ MgCI2. 10 мМ каждого дНТФ, по 10 пмоль каждого праймера, 5 ед. полимеразы Taq. бидистиллирован-ную воду. Для прохождения реакции амплификации искомого участка ДНК использовали следующие параметры: начальная денатурация ДНК при 95"С - 3 мин: затем 35 циклов: 94"С - 20 с. 62"С - 30 с. 72°С - 1 мин: 72С-З мин.
Детекцию продуктов ПЦР проводили методом электрофореза в 1,5% ном агарозном геле в объеме 15 мкл, содержащем 2.5 мкл раствора бромистого этидия. Результаты электрофореза регистрировали с помощью системы гельдокументирования PowerShotA510 и заносили в базу данных.
Секвенирование образцов ДНК проводили в сторонней организации. Нуклеотидные последовательности, полученные в результате секвенирования. были идентифицированы в базах данных GenBank с помощью сервиса BLAST.
Филогенетический анализ выполняли с помощью программы Mega 3.1. Дендрограммы построены дистанционными методами присоединения соседей NJ (neighbor-joining method. Saitou and Nei. 1987). минимума эволюции ME (minimum evolution. Cavalli-Sforza and Edwards. 1967. Saitou and lmanishi.1989. Rzhetskyand Nei. 1993) с использованием р-дистанций. Статистическую достоверность топологии филогенетического древа оценивали с помощью метода бутстрэп-анализа при количестве случайных выборок 1000. Для сравнения использовали нуклеотидные последовательности гена pol изолятов ВЛКРС. представленные в БД GenBank.
Результаты и обсуждение. Распространение лейкоза в республике связывают с завозом в 60-е-80-е годы XX века молочного красного степного скота, инфицированность которого к 90-м годам достигла 80%. Вместе с тем, значительное сокращение поголовья крупного рогатого скота в эти годы повлекло за собой и снижение уровня инфицированноеTM. Местный аборигенный скот, не контактировавший с привозным скотом, остаётся практически свободным от индуцированной ВЛКРС инфекции. В 2003-2009 гг. наивысший по республике уровень инфицированности крупного рогатого скота ВЛКРС был зарегистрирован в Городовиковском районе с колебаниями от 9.0 до 28.8%. В таблице 1 приведены результаты серологических исследований скота на лейкоз в 4 хозяйствах этого района в течение последних трех лет.
Таблица 1. Результаты серологических (РИД) исследований за 2009-2011 гг.
| Наименование хозяйств | 2009 год | 2010 год | 2011 год | |||
|---|---|---|---|---|---|---|
| исследовано, гол. | выявлено РИД+, гол.(%) | исследовано, гол. | выявлено РИД+, гол.(%) | исследовано, гол. | выявлено РИД+, гол.(%) | |
| БАК КГУ | 43 | 24(55.8) | 39 | 22(66.4) | Поголовье ликвидировано | |
| с. Дружное | 213 | 99(46.4) | 176 | 60(34) | 84 | 13(15.4) |
| п. Шин-Бядл | 776 | 451(58.1) | 580 | 190(32) | 810 | 197(24.3) |
| КФХ Демкино | 260 | 91 (35) | 336 | 86(25.5) | 117 | 31(26.4) |
Из 30 исследованных проб крови - 23 (77%) были серопозитивными (РИД+) и 7 (23%) - серонегативными (РИД-). В 21 пробе была выявлена ДНК провируса ВЛКРС (ПЦР+). для 9 проб обнаружен отрицательный результат в ПЦР (ПЦР-).
При сравнении результатов серологических и молекулярно-биологических исследований обнаружены 4 случая несоответствия: РИД-/ПЦР+ - у 1 животного: РИД+/ПЦР- - у 3 животных. В 26 случаях выявлено совпадение результатов РИД и ПЦР.
При проведении амплификации целевого фрагмента гена pol с использованием разработанных праймеров PF2-PR2 получены участки ДНК изолятов провируса ВЛКРС размером 438 п.о.
Таблица 2. Характеристика исследованных изолятов провируса ВЛКРС
| Хозяйство | Количество изолятов | Название изолята |
|---|---|---|
| КФХ Демкин П.В. | 2 | 10/8k KALMIKIYA |
| 10/2k KALMIKIYA | ||
| с. Дружное, индосектор | 1 | 10/2d KALMIKIYA |
| БАК КТУ гурт Алиева A.M. | 1 | 10/5b KALMIKIYA |
| п.Шин-Бядл, Южный индосектор | 1 | 10/15sh KALMIKIYA |
| ПКО ДНК ВЛКРС* | 1 | K+FLK-BLV |
*- положительный контрольный образец ПЦР
При анализе филогенетических отношений нуклеотидные последовательности исследуемых изолятов ВЛКРС (табл. 2) были выровнены с соответствующими консенсусными последовательностями провирусного гена pol изолятов ВЛКРС. представленными в БД GenBank. По результатам филогенетического анализа на основе pol гена построены дендрограммы (рисунок 1,2).
Pиc. 1. Филогенетическое сравнение участков гена pol ВЛКРС.

Puc. 2. Дендрограмма построена дистанционным методом минимума эволюции (ME) с использованием 2-х параметрической модели Кимура и бутстрэп-анализа (N=100) [2].
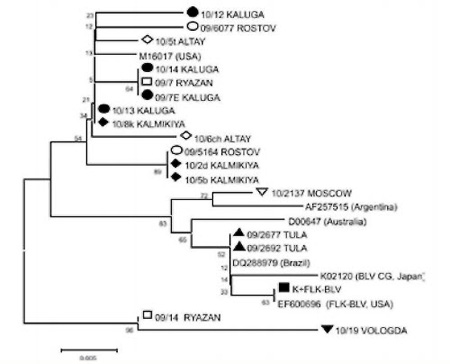
Дендрограмма построена дистанционным методом минимума эволюции (ME) с использованием р-дистанций и бутстрэп-анализа (N=1000). Массив составляет 22 последовательности.
Согласно топологии древа (на рис. 1) исследуемые изоляты провируса лейкоза КРС циркулирующие на территории Городовиковского района республики Калмыкии отнесены к группе изолятов. к которой принадлежат штаммы из Аргентины. Австралии, Японии. США. Бразилии. При этом данные изоляты отличаются от штаммов из США (М10987). Северной Италии (S83529) и также США (NC001414. AF033818), которые формируют отдельные клады.
По результатам ранее проведенного филогенетического анализа на основе гена pol провируса лейкоза КРС выявлена идентичность изолятов 10/5b KALMIKIYA. 10/2d KALMIKIYA с изолятом 09/5164 ROSTOV (JQ400141) из Ростовской области, а изолята 10/8k KALMIKIYA с изолятом 10/13 KALUGA (JQ400146) из Калужской области [1. 2].
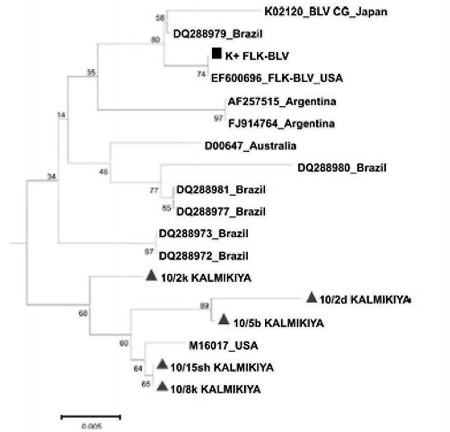
Высокая степень сходства для анализируемых штаммов с перечисленными международными изолятами в среднем составляет от 97-100% в зависимости от референсной последовательности. Максимальное совпадение выявлено с изолятом M16017_USA: в случае штаммов 10/8к KALMIKIYA и 10/15sh KALMIKIYA обнаруживается 100% сходство: для остальных изолятов 10/2d KALMIKIYA. 10/5b KALMIKIYA. 10/2k KALMIKIYA такое совпадение составляет 98-99% (рисунок 3).
Рис. 3. Ветвь филогенетического древа, представленного на рис. 1.
При сравнении нуклеотидных последовательностей изолятов из Калмыкии относительно референсных последовательностей выявлены наиболее частые замены следующих видов - транзиции: A—>G, G—>А, Т—>С, трансверсии: Т —>А.
В результате филогенетического анализа выявлена гомология участка гена pol исследуемых изолятов ВЛКРС между собой и принадлежность их к одной группе совместно со штаммами из Японии. Австралии, Аргентины, США и Бразилии.
Определение нуклеотидной последовательности ВЛКРС может помочь в выяснении источника инфицирования животных. В данном случае установление близкородственных отношений изолятов 10/5b KALMIKIYA, 10/2d KALMIKIYA и 09/5164 ROSTOV подтверждается действительно имевшим место фактом ввоза скота из Ростовской области на территорию республики Калмыкия, что. вероятно, и послужило источником инфекции. Так. только в 1981 г. из Ростовской области было ввезено 479 коров и 46 быков производителей красно-степной породы и 215 коров калмыцкой породы [4]. При этом следует отметить, что в других районах республики, где не было контакта местного КРС с инфицированными животными, скот остается здоровым. Частое перемещение скота между двумя соседними регионами отмечается и сегодня. В свою очередь, не исключается факт перевоза скота в Ростовскую область из Калужской области, что объясняет присутствие филогенетического родства изолятов 10/13 KALUGA и 10/8к KALMIKIYA. Для полного сравнительного филогенетического анализа в будущем мы планируем изучить полиморфизм изолятов вируса лейкоза крупного рогатого скота, циркулирующих в Ростовской. Ставропольской. Калужской и других областях РФ.
Таким образом, испытания разработанной системы праймеров PF2-PR2 продемонстрировали их универсальность при обнаружении провирусной ДНК ВЛКРС на территории России, что немаловажно для проведения диагностики лейкоза крупного рогатого скота. Кроме того, применение этих праймеров дало возможность проведения секвенирования с целью изучения полиморфизма ВЛКРС.
Работа проводилась в рамках выполнения проекта по государственному контракту с Министерством образования и науки Российской Федерации от 29 апреля 2011 года N16.M04.11.0018 по теме: "Разработка препаратов и тест-систем для диагностики вируса лейкоза крупного рогатого скота", шифр "2011-16-МЦП/18".
Список литературы
Реферат
Для изолятов провируса лейкоза КРС. выделенных от животных из некоторых хозяйств республики Калмыкии, определена нуклеотидная последовательность участка гена pol. На основании проведенного филогенетического анализа выявлено, что все исследуемые изоляты принадлежали к одной группе, в которую входили штаммы вируса из Аргентины. Австралии. Бразилии. США и Японии.
Ключевые слова: вирус лейкоза крупного рогатого скота. ПЦР секвенирова-ние. филогенетический анализ.
Сведения об авторах
Гулюкин Михаил Иванович, доктор ветеринарных наук, профессор, академик РАСХН. директор ГНУ "Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени Я.Р. Коваленко": 109428. г. Москва. Рязанский проспект, д. 24. корп. 1: телефон: 8(495)9700368: e-mail: viev@mail.ru.
Иванова Людмила Александровна, кандидат биологических наук, ведущий научный сотрудник лаборатории лейкозологии ГНУ "Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени Я.Р. Коваленко": 109428. г. Москва. Рязанский проспект, д. 24. корп. 1: телефон: 8(495)9700366: e-mail: viev@mail.ru
Генджиева Ольга Бекяевна. кандидат ветеринарных наук, доцент кафедры зоо-технииФГБОУ ВП0 "Калмыцкий государственный университет": 358000. Республика Калмыкия, г. Элиста, ул. Пушкина. 11: телефон: 88472239038: e-mail: gend_olga@mail.ru.
Ответственный за переписку с редакцией: Козырева Наталия Геннадиевна, младший научный сотрудник ГНУ 'Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени Я.Р. Коваленко"; 109428, г. Москва, Рязанский проспект, д. 24, корп. 1; телефон: 8(495)9700366, м/т 89151137500; e-mail: nk07-73@rambler.ru.
UDC 619:616.98:578.828.11
GENOTYPING OF BLV ISOLATES SPREAD AT THE TERRITORY OFTHE REPUBLIC OF KALMYKIA
Gulyukin Ml., Kozyreva N.G., Gendzhieva O.B., Ivanova LA.
Summary
Amplification of the desired fragment of the pol gene was carried out with the use of developed primers PF2-PR2 complementary to a section of the BLV pol gene. The 438 bp fragments of the genome of BLV provirus isolates from mature seropositive cows were obtained by the PCR method. The nucleotide sequence of a section of the provirus pol gene of bovine leukemia virus (BLV) isolates from animals from some farms in Gorodovikovsky region of the Republic of Kalmykiya is determined whereby permit concluding homology of circulating viruses and belongtothesame group as BLV isolates from Argentina. Australia, Brazil, and the United States. On the basis of the revealed homology of the section of the pol gene of BLV isolates, primers PF2-PR2 can be used also for detecting BLV proviral DNA when conducting routine PCR diagnosis of bovine leucosis.
Key words: bovine leucosis virus. PCR. sequencing, phylogenetic analysis.
References
Author affiliation
Gulyukin Mikhail I.. D.Sc. in Veterinary Medicine, professor, academician of the Russian Academy of Agricultural Sciences, director of the Kovalenko All-Russian Institute of Experimental Veterinary Medicine: 24/1. Ryazansky ave.. Moscow. 109428: phone: 8(495)9700368: e-mail: viev@mail.ru.
Ivanova Lyudmila A.. Ph.D. in Biology, leadingscientific researcher of the laboratory of leucosis of the Kovalenko All-Russian Institute of Experimental Veterinary Medicine: 24/1, Ryazansky ave. Moscow. 109428: phone: 8(495)9700366: e-mail: viev@mail.ru.
Gendzhieva Olga В.. Ph.D. in Veterinary Medicine, senior lecturer of the department of zootechny of the Kalmyk state university: phone: 8(847)2239038: e-mail: gend_olga@ mail.ru.
Responsible for correspondence with the editorial board:
Kozyreva Nataliya G., junior scientific researcher of the laboratory of leucosis of the Kovalenko All-Russian Institute of Experimental Veterinary Medicine; 24/1, Ryazansky ave., Moscow, 109428; phone: 8(495)9700366, 8-915-113-7500; e-mail: nk07-73@rambler.ru.
http://vetkuban.com/num4_20122.html