УДК: 579.842.11:636-053.2(470.620)
DOI 10.33861/2071-8020-2021-3-15-16
Тищенко А.С., Кощаев А.Г. Федеральное государственное бюджетное образовательное учреждение
высшего образования «Кубанский государственный аграрный университет
имени И.Т. Трубилина», г. Краснодар
Терехов В.И. Государственное бюджетное профессиональное образовательное учреждение
Краснодарского края «Пашковский сельскохозяйственный колледж», г. Краснодар
Процесс антителообразования является следствием сложного каскада клеточных реакций в ответ на введение антигена. От природы чужеродного агента, его антигенных и иммуногенных свойств зависит сила и продолжительность иммунного ответа. В свою очередь, макрооорганизм тоже может по-разному взаимодействовать с различными антигенами. Многое будет зависеть от первичного реагирования клеток крови, системы фагоцитоза, медиаторов воспаления и других антигенпрезентирующих механизмов [3].
Микробиоценоз кишечника животных представлен как нормальной микрофлорой, так и условно патогенными микроорганизмами, в частности энтеротоксигенными вариантами кишечной палочки, что влияет на механизмы врожденного и приобретенного иммунитета [1, 5, 8].
Энтеротоксигенные варианты кишечной палочки (Escherichia coli) обладают широким набором патогенных факторов, которые в совокупности способствуют возникновению заболевания, при этом одним из главных является токсинообразование [10]. Возбудитель эшерихиоза способен вырабатывать три вида основных экзотоксинов, имеющих значимость в развитии болезни [8, 9]. Исследованиями установлено, что экзотоксины кишечной палочки в обезвреженной форме обладают антигенными свойствами, стимулируют фагоцитоз, сохраняют функциональную активность нейтрофилов, не обладают токсическим действием. Можно сказать, что они оказывают положительное влияние на клеточное звено и механизмы врожденного иммунитета у животных. В связи с этим для профилактики эшерихиозной инфекции целесообразно применять обезвреженные формы токсинов Escherichia coli, предварительно изучив их взаимодействие с клетками иммунной системы [5, 9].
Цель работы заключалась в определении динамики накопления специфических антител у животных после иммунизации их матерей инактивированными формами токсинов кишечной палочки.
Материалы и методы исследований. В качестве объекта исследования использовали крупный рогатый скот чёрно-пёстрой голштинской породы и свиней крупной белой породы. Из стельных коров и супоросных свиноматок, вакцинированных токсоидными препаратами кишечной палочки, по принципу аналогов сформировали опытные и контрольные группы. После родов проводили исследование на потомстве, полученном от иммунизированных животных. Все животные содержались в одинаковых условиях. Поствакцинальных реакций и осложнений выявлено не было.
Препараты, включающие инактивированные экзотоксины кишечной палочки (анатоксины) получали путем раздельного культивирования в условиях термостата токсигенных штаммов возбудителя эшери-хиоза в пробирках с питательным бульоном объемом 10 мл, а затем в колбах по 400 мл в течение 6-7 дней. Токсигенных свойств лишали путём добавления формалина.
Для определения степени накопления антитоксических антител использовали новорожденных поросят и телят, матерей которых сформировали по группам и иммунизировали двукратно - свиноматок в дозе 5 см3, коров в дозах 5 см3 и 10 см3 внутримышечно по следующей схеме: I опытная - бульонная культура термостабильного токсина (ST); II опытная - бульонная культура термолабильного токсина (LT); III опытная - бульонная культура шига-подобных токсинов (STX); IV опытная - LT, ST и STX-токсины кишечной палочки; V группа - контроль (0,85%-ный физиологический раствор).
Отбор крови у поросят для исследования сыворотки крови на наличие антитоксических антител осуществляли на 1, 3, 5 и 7 сутки, у телят - на 2, 7, 14 день. У коров также исследовали молозиво на содержание колостральных антитоксических антител. В качестве серологической реакции использовали реакцию непрямой гемагглютинации.
Результаты исследований и их обсуждение. При изучении титра антител у новорожденных животных установили повышение титра антитоксических антител (табл. 1).
У поросят наибольшее их количество было в группе животных, чьи матери были иммунизированы комплексным анатоксином (3,4±0,4 log2). В других группах у поросят уровень иммуноглобулинов в первый ден2ь после рождения был ниже в 1,2-1,4 раза. Следует отметить, что в контрольной группе у животных также отмечены следы антител, которые достигали значений в первый день 1,4±0,6 log2, а в последующие дни показатель хоть и снижался, но оставался на уровне 0,2±0,4 log2.
Таблица 1 Количество антитоксических антител у новорожденных животных, полученных от матерей, вакцинированных инактивированными токсинами E. coli
| Возраст животного, дни | Титры антител к определенному виду токсина, log2 | Контроль (V) | |||
|---|---|---|---|---|---|
| I (ST- токсин) | II (LT- токсин) | III (STX- токсины) | IV (LT+ST+STX- токсины) | ||
| у поросят | |||||
| 1 | 2,6±0,6 | 2,4±0,6 | 2,8±0,4 | 3,4±0,4 | 1,4±0,6 |
| 3 | 2,0±0,4 | 2,2±0,6 | 2,4±0,6 | 2,8±0,4 | 0,8±0,4 |
| 5 | 1,2±0,4 | 1,4±0,4 | 1,2±0,8 | 1,6±0,4 | 0,6±0,4 |
| 7 | 0,4±0,4 | 0,2±0,4 | 0,4±0,6 | 0,6±0,4 | 0,2±0,4 |
| у телят | |||||
| 2 | 4,0±0,6 | 3,8±0,4 | 4,2±0,4 | 4,4±0,5 | 2,8±0,4 |
| 7 | 3,4±0,5 | 3,2±0,4 | 3,4±0,5 | 3,8±0,4 | 1,4±0,5 |
| 14 | 1,8±0,4 | 1,6±0,8 | 1,8±0,4 | 2,6±0,5 | 1,2±0,4 |
На третьи сутки титр иммуноглобулинов у животных снизился по каждой группе в среднем в 1,2-1,3 раза, при этом максимальное их количество было у поросят из IV опытной группы (2,8± 0,4 log2). На пятые сутки динамика снижения антител в сыворотке крови поросят усилилась, минимальным титр иммуноглобулинов был в 1 и 3 группах животных - 1,2 log2, а во 2-й группе - 1,4± 0,4 log2, в IV группе зарегистрировали максимальное значение в этот период времени -1,6± 0,4 log2. На 7-е сутки значения титров антител практически выровнялись с контрольными.
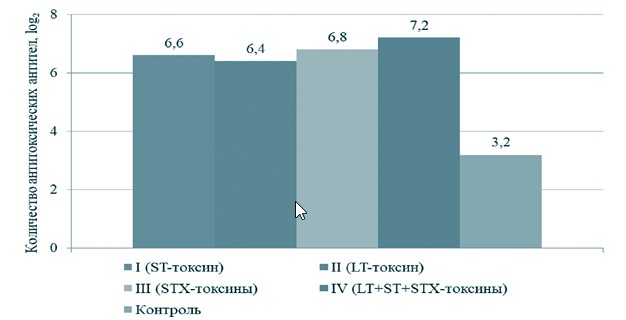
При изучении гуморальных факторов защиты у крупного рогатого скота вначале определили уровень накопления колостральных антител, у иммунизированных коров, поскольку из-за особенностей строения плаценты новорожденный теленок может получить иммуноглобулины к токсинам кишечной палочки только через молозиво [2, 6, 7]. На 1-й день у всех коров, иммунизированных токсоидными препаратами, в молозиве содержатся антитоксические антитела (рисунок 1). В группе контроля у животных также выявили иммуноглобулины, которых в 2-2,2 раза меньше, чем у животных из опытных групп. Максимальное значение колостральных антител зафиксировали в IV группе животных, вакцинированных комплексным анатоксином - 7,2±0,4 log минимальное во II группе иммунизированных ST-токсином кишечной палочки животных - 6,4±0,5 log2. После отела все телята из опытной и контрольной группы получили 2молозиво от своих матерей в течение первых двух часов и в последующем содержались в одинаковых условиях.
На 2-й день определили уровень накопления антитоксических антител в сыворотке крови у телят. В результате установили, что у родившихся животных от иммунизированных обезвреженными токсинами кишечной палочки коров титр специфических иммуноглобулинов выше, чем у потомства из контрольной группы. Через 48 часов после рождения было отмечено максимальное значение титра колостральных антител у телят в опыте, которые были выше показателей контроля в 1,3-1,5 раза. Комплексный анатоксин в лучшей мере стимулировал антителообразование, чем использование токсинов по отдельности, при этом максимальное значение уровня колостральных антител регистрировали у животных из IV группы - 4,4±0,5 log2 и III группы - 4,2±0,4 log2, а минимальное значение у телят из II и I гр2уппы - 4,0±0,6 log2 и 3,8±20,4 log2, соответственно.

Рис. 1. Титр антитоксических антител в молозиве у коров, вакцинированных инактивированными токсинами E. coli
Через неделю после рождения у телят, полученных от иммунизированных коров, наблюдали снижение титра колостральных антител в среднем в 1,6 раза. Количество антител уменьшилось примерно на 59,3-61% по сравнению с предыдущими исследованиями, но было большим, чем у телят, родившихся от неиммунизированных коров (контроль). Максимальным было значение антител у животных из IV группы - 3,8±0,4 log2, минимальным во II группе - 3,2±0,4 log2.
Через две2 недели исследований титры иммуноглоб2улинов у телят снизились в 1,4-2 раза по сравнению со значениями 7-го дня, но были выше, чем у животных контрольной группы. При этом максимальный уровень колостральных антител был у телят из IV группы - 2,6±0,5 log2. У животных в группах III, II и I значения антител находились в предела2х 1,6±0,8-1,8±0,4 log2.
Заключение. Таким образом, результаты исследований показали, что при иммунизации стельных коров инактивированными препаратами из токсинов кишечной палочки накопление антител у потомства происходит интенсивнее, чем у свиноматок. Применение комплексного токсоидного препарата было более эффективным, чем моновакцинация каждым токсином по отдельности, что выражается в увеличении количественного состава антител, как в молозиве у коров, так и в сыворотке крови новорожденных животных. Минимальным уровень накопления колостральных антител был у поросят на 1-й день исследования (3,4±0,4 log2), у телят на 2-й день - 4,4±0,5 log2. В последующие дни наблюдали р2асходование антител - у поросят ур2овень иммуноглобулинов снизился к 5-7 дню, у телят - к 14 дню. Результаты полученных исследований позволяют предположить, что комплексный эшерихиозный анатоксин целесообразнее применять в комплексе с адъювантами - помощниками в усилении иммунного ответа. Также можно сделать вывод, что вакцинацию поросят и телят при энтеротоксигенном эше-рихиозе следует проводить на 5-7 день после рождения, а телят - на 15 день.
Исследование выполнено при финансовой поддержке РФФИ и администрации Краснодарского края в рамках научного проекта №19-416-233007.
Список литературы:
Резюме. Энтеротоксигенный эшерихиоз занимает существенное положение среди острых кишечных патологий телят и поросят. Основными факторами патогенности при данной форме заболевания являются экзотоксины кишечной палочки трех видов - термостабильный, термолабильный и шигаподобный. 0тсюда следует, что разработка биопрепаратов на основе инактивированных форм этих токсинов и изучение их влияния на организм восприимчивых животных представляется актуальным. Для достижения поставленной в исследовании цели авторами изучена степень накопления антител против токсинов кишечной палочки у новорожденных животных. 0бъектами исследований служили супоросные свиноматки и стельные коровы, иммунизированные инактивированными токсинами кишечной палочки, а также их потомство, у которых определяли содержание антитоксических антител в сыворотке крови с помощью реакции непрямой гемагглютинации. Результатами исследований установили, что применение анатоксина на основе обезвреженных токсинов кишечной палочки на беременных животных обеспечивает накопление антител у родившихся от них телят и поросят. Использование комплексного токсоид-ного препарата при вакцинации стельных коров и супоросных свиноматок было эффективнее, что выражается в увеличении количественного состава антител и накоплению иммуноглобулинов в более высоких титрах. Количество иммуноглобулинов достигло максимума в первые дни жизни животных, затем происходило их снижение - у поросят к 5-7 дню, у телят - к 14 дню исследований. Для обеспечения более напряженного и длительного иммунного ответа, а также повышения иммуногенных свойств инактивированных токсинов кишечной палочки целесообразно их применять совместно с адъювантными веществами.
Ключевые слова: экзотоксины, кишечная палочка, антитела, гуморальный иммунитет, анатоксин, эшерихиоз, супоросные свиноматки, стельные коровы, поросята, телята.
Сведения об авторах:
Кощаев Aндрeй Георгиевич, член-корреспондент PAH, доктор биологических наук, профессор, проректор по научной работе ФГБ0У В0 «Кубанский государственный аграрный университет имени И.Т. Трубилина»; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8-861-2215637; e-mail: koshhaev.a@kubsau.ru.
Терехов Владимир Иванович, доктор биологических наук, профессор, преподаватель специальных дисциплин ГБП0У КК «Пашковский сельскохозяйственный колледж»; 350910, г. Краснодар, ул. Е. Бершанской, 220; тел.: 8-988-4742115; e-mail: vterekhov@list.ru.
Ответственный за переписку с редакцией: Тищенко Александр Сергеевич, кандидат ветеринарных наук, доцент кафедры микробиологии, эпизоотологии и вирусологии факультета ветеринарной медицины ФГБОУ ВО «Кубанский государственный аграрный университет имени И. Т. Трубилина»; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8-928-4692399; e-mail: mephisto83@inbox.ru.
http://vetkuban.com/num3_202104.html